BIOORGANIK KIMYO fanidan lab
























































![7. Oshqozon-ichak traktiga tushgan peptidining tarkibi quyidagicha:
Quyida keltirilgan fermentlar qaysi bog‘larni uzadi?
Pepsin
Tripsin
Ximotripsin
Karboksipeptidaza
Aminopeptidaza
8. Qoramol qon zardobining albumini molekular massasi 204 ga teng bo‘lgan 0,58 % (o‘g‘irlik
bo‘yicha) triptofandan ibotat.
Qoramol albumin zardobining minimal molekulyar massasini hisoblang.
Qoramolning albumin zardobining molekulyar massasi gel’-filtratsiya usuli bo‘yicha
hisoblanganda 70 000 ni tashkil etdi. Albumin zardobi molekulasidagi triptofan qoldig‘i
nechta?
9. Preparat tarkibidagi 2,0 mg arginaza 10 min davomida t=38°C va рН 9,0 sharoitda 30 mkmol
mochevina namunasini katalizladi. Arginazaning solishtirma aktivligini hisoblang.
10. 37 0
C va pH 7,0 da suksinatdegirogenazaning 1 mg miqdori 5 min davomida yantar
kislotasining oksidlanishini katalizlab, 10 mkmol fumar kislotasini hosil qildi. Optimal sharoitda
fermentning solishtirma aktivligini hisoblang.
11 . 6-dezoksi-L-galaktoza (fukoza) ning epimerlanish reaksiyasi sxemasini keltiring. Bunda
olingan monosaxaridlarning perspektiv formulalarini yozing.
12. D-glyukozaning qaytaruvchilik xususiyati farq qiluvchi ikki xil pentaasetatining sintezi
sxemasini keltiring [Shabarov, Oreskaya].
1 3 . Quyida keltirilgan monosaxaridlarning qaysilarini borat kislota bilan reaksiyasidan
anomerlarini ( α - va β -shakllar) farqlash mumkin:
D-galaktopiranoza, D-idopiranoza, D-fruktofuranoza, L-sorbofuranoza?
1 4 . Ma’lumki, L-idofuranozaning normal tuzilishli spirtlardan n-geptildan boshlab hosil qilgan
glikozidlari termotrop suyuq kristallar hisoblanadi. Ushbu birikmalarning tuzilish formulalarini
yozing.
15 . Quyidagi disaxaridlarning perspektiv formulalarini yozing:
a) β -D-galaktopiranozil[1→5]-D-arabinoza;
b) β -D-mannopiranozil [1→4]-D-mannoza;
v) β -D-glyukopiranozil[1→3]-D-arabinoza;
g) α -L-arabinofuranozil[1→6]-D-glyukoza;
d) β -D-mannopiranozil- α -D-fruktofuranozid;
e) β -D-glyukopiranozil- α -L-sorbofuranozid;](/data/documents/100da072-7c8a-4892-8de7-d6d531dce147/page_62.png)
![j) β -D-glyukopiranozil[1→6]-L-sorboza.
16 . Quyidagi moddalarning mo‘l miqdordagi fenilgidrazin, bromli suv va natriy bordeyterid
bilan ta’siri reaksiyalarining sxemasini keltiring:
a) maltoza ( α -D-glyukopiranozil[1→4]-D-glyukopiranoza);
b) laktoza ( β -D-galaktopiranozil[1→4]-D-glyukopiranoza);
c) β -D-glyukopiranozil[1→3]-D-arabinofuranoza.
17 . 0,8 va 1,0 spesifiklik koeffisiyentiga ega ikki DNK molekulasining qaysi birining
suyuqlanish temperaturasi yuqori bo‘ladi? Nima uchun?
18 . DNK aza – ferment, DNK molekulasidagi nukleotid bog‘larni parchalaydi, virus
(adenovirus, gerpes virusi) DNK sining ko‘payishini to‘xtatadi. Hujayrada bu ferment va
viruslar makromolekula singari bo‘lib, pinositoz pufagida izolirlangan holda bo‘ladi va
pinositoz yo‘li orqali hujayraga tushadi. Nima uchun bu ferment hatto juda ko‘p miqdorda
bo‘lsa ham hujayraning DNK molekulasiga ziyon yetkazmaydi?
Xulosa.
.
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………](/data/documents/100da072-7c8a-4892-8de7-d6d531dce147/page_63.png)















O‘ZBEKISTO N RESPUBLIKASI OLIY VA O‘RTA MAX SUS TA’LIM VAZIRLIGI SAMARQAN D DAVLAT UN IVERSITETI TFF KIMY O BO‘LIMI III KURS 30_ GURUH TALABASI ________________________________________________________ _____________ ning FA N I DA N I. Laborat oriy a ishlari II. Must aqil ishi - Case-st udy (Variant № 2 )BIOORGANIK KIMYO
Samarqand – 20 21
LABORATORIYA MASHG‘ULOTLARI I. MODUL. OQSILLAR KIMYOSI ................................................ OQSIL ERITMALARINI TAYYORLASH ....................................... 1. Rangli va cho‘ktirish reaksiyalari uchun tuxum oqsili eritmasini tayyorlash 2. Tuzlanish va dializ uchun tuxum oqsili eritmasini tayyorlash 3. Sut albumini eritmasini tayyorlash 4. O‘simlik oqsillarini ajratib olish 5. Tuxum albuminini tuz bilan cho‘ktirish orqali ajratib olish 6. Qoramol sutidan kazienni ajratish 7 . Mushak to‘qimalaridan oqsillarni ajratish OQSILLARNI TOZALASH ........................................................... 1. Oqsillarni dializ usulida tozalash OQSILLARNING DENATURA T SIYASI ........................................ 1 . Oqsillarning denaturatsiyasini o‘rganish 2. Ammoniy sulfat bilan cho‘ktirish 3. Osh tuzi bilan cho‘ktirish 4. Oqsillarni organik erituvchilar yordamida cho‘ktirish 5. Oqsillarni yuqori harorat ta’sirida cho‘kmaga tushirish 6. Oqsillarni organik va mineral kislotalar ta’sirida cho‘ktirish 7. Oqsillarni og‘ir metall tuzlari yordamida cho‘ktirish 8. Oqsillarni alkaloidlar ga xos reaksiyalar yordamida cho‘ktirish 9 . Tuxum albuminining izoelektrik nuqtasini aniqlash OQSIL VA AMINOKISLOTALARGA XOS RANGLI REAKSIYALAR 1 . Biuret reaksiyasi 2. Ningidrin reaksiyasi 3. Ksantoprotein reaksiyasi 4. Fol reaksiyasi 5. Milon reaksiyasi 6. Metioninga nitroprussid reaksiyasi 7. Argininga Sakagu ch i reaksiyasi 8. Triptofanga Adamkevich reaksiyasi 9. Gistidinga Pauli reaksiyasi 10. Aminokislotalarni qog‘oz xromatografiyasi yordamida ajratish 11. Oqsil miqdorini L o uri usulida miqdoriy aniqlash MURAKKAB OQSILLAR .............................................................. 1. So‘lak tarkibidagi mutsinni aniqlash 2. Gemoglobining gemin guruhini uchun sifat reaksiya II. MODUL. UGLEVODLAR KIMYOSI ......................................... UGLEVODLARNI AJRATIB OLISH .............................................. 1. Uglevodlarni quruq mevalar (mayiz, turshak, meva qoqilari) dan ajratib olish 2. Saxarozaning gidrolizi MONOSAXARIDLARGA XOS SIFAT REAKSIYALARI .................. 1. Uglevodlarni α –naftol yordamida aniqlash 2. Fruktozani rezorsin (Selivanov usuli) yordamida aniqlash 3. Pentozalarni orsin yordamida aniqlash
4. Dezoksiribozani difenilamin yordamida aniqlash 5. Nilander reaksiyasi 6. Barfed reaksiyasi 7. Feling reaksiyasi 8. Polisaxaridlarga xos rangli reaksiyalar 9. O‘simliklarning yashil barglaridagi kraxmalni aniqlash 10. Piyoz ekstraktidagi glukoza va boshqa qaytaruvchi shakarlarni aniqlash 11. Kraxmalni miqdoriy aniqlash III. MODUL. NUKLEIN KISLOTALAR KIMYOSI ......................... NUKLEOPROTEIDLARNI AJRATIB OLISH VA GIDROLIZ REAKSIYALARINI O‘RGANISH ................................................. 1. Achitqidan nukleoproteidlarni ajratib olish va gidrolizlash 2. O‘simlik to‘qimalaridan DNK ni ajratib olish 3. Buqoq bezi yoki qora taloq, to‘qima dezoksiribonukleoprotei d ini ajratish NUKLEIN KISLOTALARNI SIFAT VA MIQDORIY ANIQLASH ..... 1. Hayvon to‘qimalaridagi DNK miqdorini aniqlash 2. DNK ning nukleotid tarkibini aniqlash 3. DNK mi q dor i ni kolorimetrik usul bilan aniqlash 4. Kolorimetrik usul bilan RNK miqdorini aniqlash IV. MODUL. LIPIDLAR KIMYOSI ............................................... YOG‘LARNI AJRATIB OLISH ...................................................... 1. Biologik suyuqliklardan yog‘ ajratib olish 2. Yog‘larning sovunlanishi va yog‘ kislotalari olish 3. Yog‘larning eruvchanligini aniqlash 4. Yog‘larni emulsiya holatiga o‘tkazish 5 . Yog‘lardagi glitsirenga xos reaksiya YOG‘LARNING ASOSIY SIFAT KO‘RSATKICHLARINI ANIQLASH …………………………………………………………………. 1. Yog‘larning to‘yinganlik darajasini aniqlash 2. Yog‘larning kislota sonini aniqlash 3. Yog‘larning sovunlanish sonini aniqlash TAVSIYA ETILADIGAN ADABIYOTLAR ......................................
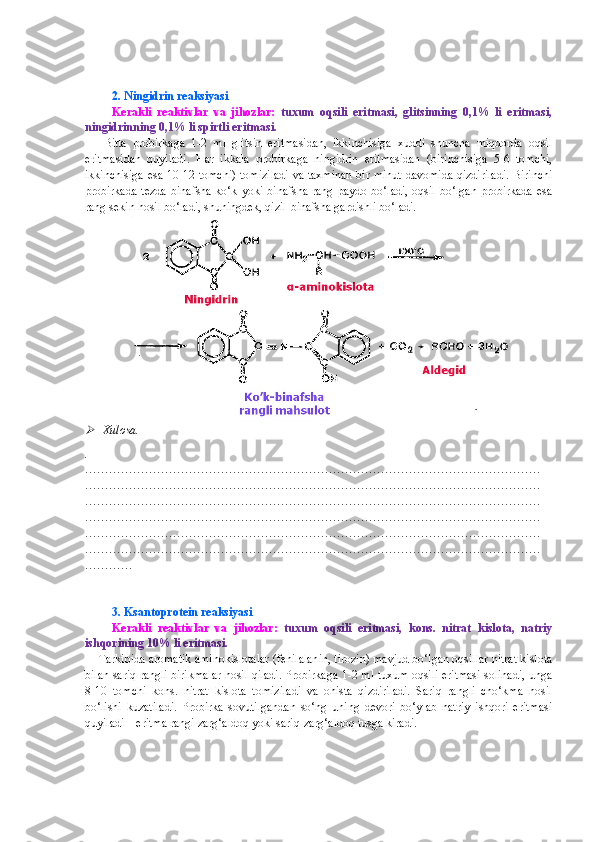
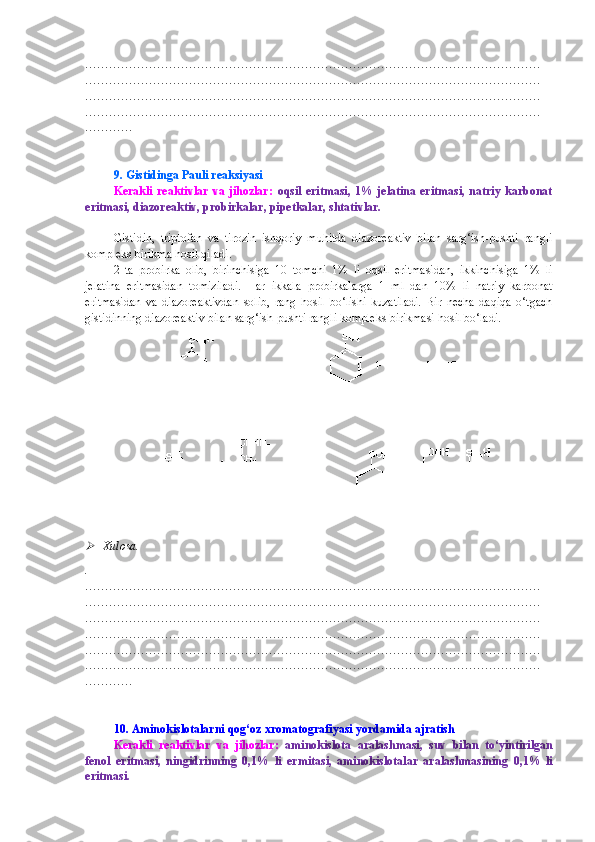
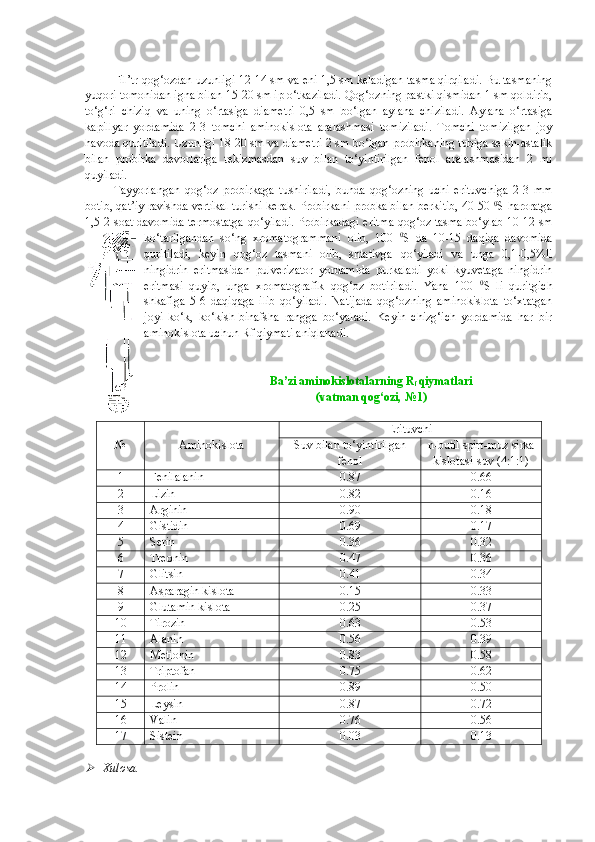
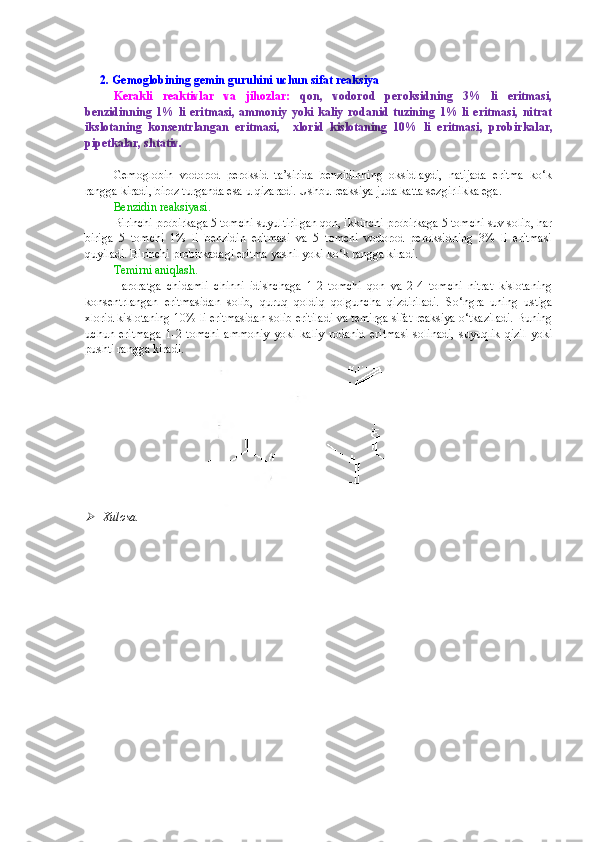
I. MODUL. OQSILLAR KIMYOSI OQSILLARNI TABIIY MANBALARDAN AJRATIB OLISH OQSIL ERITMALARINI TAYYORLASH VA TOZALASH 1. Rangli va cho‘ktirish reaksiyalari uchun tuxum oqsili eritmasini tayyorlash Kerakli reaktivlar va jihozlar: tuxum, distillangan suv, tubi yassi kolbalar, o‘lchov silindrlari yoki stakanlari, bint (doka, surp). Bitta tovuq tuxumining oqi sarig‘idan ajratiladi va 15-20 barobar ko‘p miqdordagi (ta x minan, 500 ml) distillangan suvda eritiladi. Eritma 3-4 qavat qilingan doka ( surp ) dan fil’trlanadi. Tayyorlangan eritma muzlatgichda saqlanadi. Xulosa. . …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… ………… 2. Tuzlanish va dializ uchun tuxum oqsili eritmasini tayyorlash Kerakli reaktivlar va jihozlar: tuxum, distillangan suv, osh tuzining to‘yingan eritmasi, tubi yassi kolbalar, o‘lchov silindrlari yoki stakanlari, bint (surp). Uch dona tovuq tuxumi sarig‘idan ajratiladi va 700 ml distillangan suvda eritiladi va ustiga 300 ml osh tuzining to‘yingan eritmasi quyiladi. Eritma 3-4 qavat qilingan doka ( surp ) dan fil’trlanadi. Tayyorlangan eritma muzlatgich da saqlanadi. Xulosa. . …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… ………… 3. Sut albumini eritmasini tayyorlash Kerakli reaktivlar va jihozlar: qoramol suti, distillangan suv, ammoniy sulfatning to‘yingan eritmasi, tubi yassi kolbalar, o‘lchov silindrlari yoki stakanlari, bint (doka, surp), qog‘oz fil’trlar.
