Vodorod ftoridning tebranish polosasini komplekslarda shakllanish mexanizmi









![elektron bilan bir qatorda, yakka elektron va uch elektron orqali ham tortilishi
mumkin.
Metall bog’lanish - metallarning kristall panjaralari tugunlarida metal atomi
ioni joylashadi. Kristall panjarada uning tugunlarida metall atom ionlari bilan
elektronlar o’rtasida yuzaga keladigan tortishuv kuchlari metall bog’lanish
deyiladi.
Metall bog’lanish kuchli bog’lanish bo’lib, u asosan barcha metallarning
xossalarini belgilab beradi. Metallarda oson harakatlanuvchi elektronlar oqimi
borligi uchun ular issiqlikni, elektr tokini yaxshi o’tkazadi.
1.2. Molekulalararo o’zaro ta’sir va uning tebranish spektrida
namoyon bo’lishi
Molekula aylanish yoki tebranish spektriga ega bo‘lishi uchun u dipol
momentiga yoki qutblanuvchanlikka ega bo‘lishi lozimligini yuqorida keltirilgan
boblarda ko‘rib o‘tdik. Demak, molekulaning elektr xossalari uning optik xossalari
bilan chambarchas bog‘liq ekan. Buning asosiy sababi qutblanuvchanlik va dipol
momenti molekulaning elektron bulutining xossasini bildiradi. Dipol momenti va
qutblanuvchanlik molekulalar o‘rtasidagi o‘zaro ta’sir kuchlarini belgilaydi.
Molekulalar orasidagi masofa yaqin bo‘lganda gazning suyuqlikka
aylanishida va molekulyar kristallar hosil bo‘lishida molekulalararo o‘zaro ta’sir
muhim ahamiyatga ega bo‘ladi. Molekulalararo o‘zaro ta’sir kuchlari ko‘p hollarda
Van-der-Vaals kuchlari ham deyiladi, shu kuchlar tufayli moddalarning suyuq
holati vujudga keladi. Savol tug‘iladi, nima sababdan elektrik nuqtayi nazardan
neytral bo‘lgan molekulalar o‘zaro bir-biriga tortiladi. Bu savolga javob berish
uchun dastlab qutbli molekulalarni qaraymiz [48]. Qutbli molekulalarda musbat va
manfiy zarrachalarning og‘irlik markazlari bir-biriga nisbatan siljigan va turli
molekulalardagi qarama-qarshi zaryadlar bir-birini elektrostatik (kulon) kuchlari
tufayli tortadi. Bunda molekulalar rasmdagidek ketma-ket yoki antiparallel
joylashadi (1-rasm).
10](/data/documents/d5998555-6cd9-4c9b-9408-a9e7931e059f/page_10.png)

![ko‘rsatadi. Shu tufayli oriyentatsion ta’sir energiyasini bilish uchun issiqlik
harakatining ta’sirini hisobga olish kerak. Bu ta’sirni hisobga olish uchun
qutblanuvchanlikka ega bo‘lgan sistemaning kuchlanganligi E bo‘lgan
maydondagi qutblanishini qaraymiz. Bunday maydon ta’sirida induksiyalangan
dipol momenti hosil bo‘ladi. Dipolning ana shu maydondagi energiyasi
quyidagiga teng bo‘ladi:
(5)
Molekulaning dipol momenti maydon tomonidan induksiyalanganligi uchun uning
yo‘nalishiga mos tushadi, natijada cos ( E)=1 bo‘ladi. Bu hosil bo ‘ lgan maydon
kattaligining o ‘ zgarish chegarasi 0 dan E gacha bo ‘ ladi [47]. Natijada oriyentatsion
ta’sir energiyasi quyidagicha hisoblanadi:
Endi o‘z yo‘nalishi bo‘yicha dipolni hosil qilgan maydon kuchlanganligini
hisoblaymiz:
yoki
(8)
Molekulalar orasidagi masofaning uchinchi darajasi juda kichik miqdor bo‘lganligi
uchun (8) dagi ni hisobga olmasak ham bo‘ladi, natijada:
Oriyentasion o‘zaro ta’sirda, issiqlik harakati xalaqit berganligi tufayli
qutblanuvchanlik rolini quyidagi oriyentatsion qutblanuvchanlik o’ynaydi:
12](/data/documents/d5998555-6cd9-4c9b-9408-a9e7931e059f/page_12.png)


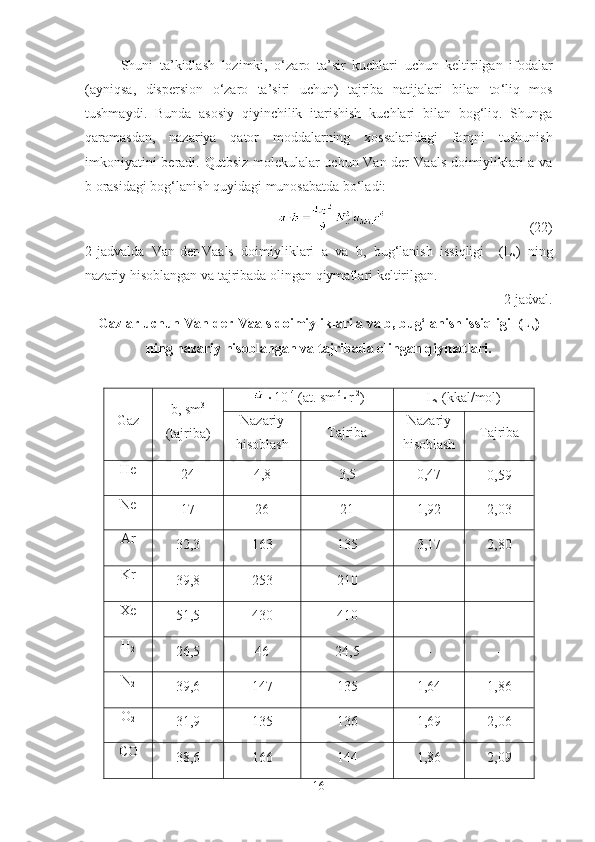


![o‘lchamlariga ham bog‘liq. Aytaylik, ikki atomli molekulalarda aylanma harakat
saqlanib qolganligi tufayli tebranma aylanma polosaning kengligi ancha katta
bo‘lsa ( 100 sm -1
), ko‘p atomli molekulalarda erkin aylanish deyarli
bo‘lmaganligi tufayli faqat tebranma harakatga tegishli polosaning yarim kengligi
ancha kichkina bo‘ladi ( 10 sm -1
atrofida). Masalan, HCl molekulasining (gaz
holatida) tebranma-aylanma spektrida aniq aylanma strukturaga ega bo‘lgan P va R
qanotlaridan tashkil topgan [53] tebranma-aylanma polosa kuzatilsa, modda inert
erituvchida argon, krepton, ksenon yoki to‘rtxlorli uglerod kabi erituvchilarda
eritilganda, birinchidan tanlash qoidasiga ko‘ra taqiqlangan Q komponenta ham
paydo bo‘ladi [46]. (2-rasm). Ikkinchidan, 0-0 o‘tishlarga mos keluvchi
00
chastota past chastota tomonga siljiy boradi. Uchinchidan polosaning umumiy
intensivligi ortadi [38]. Bunga sabab HCl molekulasining erituvchi atomlari bilan
o‘zaro ta’siridir. H-bog’lanish energiyasi 2-3 kkal/mol dan ortganda ν AH tebranish
polosasining formasi murakkablashadi, shuningdek, tebranish polosasining
aylanma strukturasi o’zgaradi.
19](/data/documents/d5998555-6cd9-4c9b-9408-a9e7931e059f/page_19.png)








![qabul qiluvchanligi) qobiliyatini baholaydigan aniq ma’lumot topish qiyin. Ayrim
hollarda birinchi ionizitsiya potensialidan foydalaniladi, chunki ionlashishda erkin
juftlik elektrondan uzoqlashadi, aynan, shu elektron vodorod bog‘lanishda ishtirok
etadi. Potensial qancha kichik bo‘lsa, protonseptorlik xususiyati shunchalik
effektiv bo‘ladi. Lekin bu universal g‘oya emas. Masalan, galoidovodorodlar
qatorida (HF, HCl, HBr) proton akseptorlik qobiliyati ortadi, ionizatsiya potensiali
esa kamayadi HF (I1=16.4eV), HCl (12.8eV), HBr (11.7eV), ayrim sistemalarda
bunday emas. Aniq tajriba natijalariga ko‘ra uchlangan aminlarda azot atomi
mustahkam bog‘ hosil qiladi. Karbonil guruhda C=O (asetonda), karboksil guruhda
O (efirda) kislorod kuchsiz bog‘lanish hosil qiladi, yana ham kuchsiz bog‘lanish
NO
2 da azot bo‘ladi. C≡H guruhda spirtlar molekulalarida kislorod, C=O guruhda
C atomi aromatik birikmalar [10] yoki qo‘sh bog‘lardagi -elektronlar kuchsiz
bog‘lanish hosil qiladi. Shartli ravishda barcha H-bog‘lanishlarni bitta bog‘ga
to‘g‘ri keladigan ta’sir energiyasining miqdoriga qarab bir necha guruhga bo‘lish mumkin.
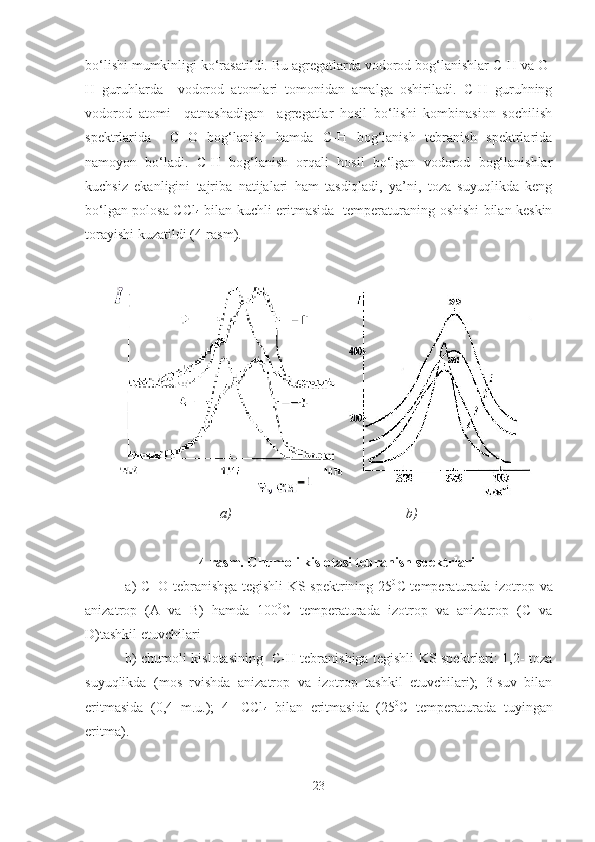
Kuchsiz
H-bog‘lanish O‘rtacha
H-bog‘lanish Kuchli
H-bog‘lanish O‘ta kuchli
H-bog‘lanish
< 3
kkal/mol ~3 – 6
kkal/mol ~ 6 – 9
kkal/mol > 10
kkal/mol
Eng yuqori o‘zaro bog‘lanish (samoassotsiatsiya) suvda bo‘ladi. Har bir suv
molekulasi 4 ta bog‘lanishda qatnashadi. Ikkitasi vodorod atomi orqali donor
proton sifatida, ikkitasi kislorod atomi orqali akseptor sifatida. Vodorod bog‘lanish
mavjudligi ko‘pgina moddalarning makroskopik xossalarini o‘zgartiradi. Turdosh
brikmalar qatorida H
2 O ning qaynash temperaturalari birinchisida eng yuqori
bo‘ladi. Bu qatordagi qonuniyatga ko‘ra suv normal sharoitda qaynashi lozim
bo‘lgan temperaturga nisbatan ancha yuqori temperaturada qaynaydi. Bu qatordagi
qonuniyatga ko‘ra suv taxminan 200 0
C dan pastroq temperaturada, ya’ni -100 0
C
temperaturada qaynashi lozim. Ma’lumki, molekula bog‘lanishlari zanjirlarining
oriyentatsiyasi tufayli sistemalarning dielektrik doimiyliklari ortadi.
II BOB . TADQIQOT OB’EKTI VA USULLARI
29](/data/documents/d5998555-6cd9-4c9b-9408-a9e7931e059f/page_29.png)





![2.3 §. Zichlik funksiyalar nazariyasi (DFT) usuli
Bugungi kunda zichlik funksional nazariyasi (DFT-Density Functional
Theory) - kimyo va fizika sohalaridagi ko‘pchilik muammolarni yechishda keng
qo‘llanilib kelinmoqda. Maxsus, faqat DFT hisoblashlarini amalga oshiradigan
majmualar yaratilgan. DFT usullari Firefly/Gamess, Gaussian va boshqa
majmualarga kiritilgan [3,6,14].
Bu usul asosida Kon-Shem yondoshuvi yotadi. Bunga, 1964 yilda
Xoenberg va Kon tomonidan taklif qilingan teoremalar asos bo‘lgandi. Unga ko‘ra
molekulaning asosiy elektron holatdagi xossalari asosiy holat elektron zichlik
funktsiyasi ρ
0 (x,y,z) bilan aniqlanadi.
Matematika kursidan ma’lumki, funksiya biron bir sonni xuddi shunday
songa yoki boshqasiga o‘girish xususiyatidir. Buni kalkulyatorda amallarni
bajarishga o‘xshatish mumkin. Masalan, 2 sonini yozib x 3
funksiyasini bajarsak 8
soni chiqadi.
Xoenberg-Kon teoremasiga ko‘ra, molekulaning asosiy holatdagi xossasi
asosiy holat zichligining funksiyasidir. Masalan, sistema energiyasi E
0 zichlik
funksiyasi natijasida topilishi mumkin: ρ
0 (x,y,z) - E
0 .
Funksiyani F[ρ
0 ] bilan belgilasak, E
0 = F[ρ
0 ] = E[ρ
0 ] (23).
Kon va Shem tomonidan orbitallarni hisoblash sxemasining kiritilishi DFT-
ning kompyuter kimyoda keng miqyosda qo‘llanilishiga olib keldi. Kon-Shem
nazariyasining asosiy g‘oyasi kinetik energiya funksionalini ikki qismga (T
s va T
c )
bo‘lishdan iborat [3].
37](/data/documents/d5998555-6cd9-4c9b-9408-a9e7931e059f/page_37.png)
![1-chisi (T
s ), ta’sirlashmayotgan elektronlar sistemasi hisoblanishini, 2-chisi
(T
c ) to‘ldiruvchi qismni ifodalaydi (correction).
T[ρ] = T
s [ρ] + T
c [ρ]
Bu yondoshuv asosida molekulyar sistemalarni xuddi XFR usulidek o‘rganish
imkoniyati tug‘ildi, yani orbitallarni tuzish MO AOChK usulida olib boriladi va
atom orbitallarni ifodalash basis to‘plamlari yordamida olib boriladi, yana
shuningdek, orbitallar va ularning energiyalari MMU bilan aniqlanadi.
Zichlik funksionali nazariyasida xuddi XFR tenglamasidek Kon-Shem
tenglamasi mavjud:
DFT yondoshuvida K ,
v - matritsasi Fok matritsasiga o‘xshash. Kon-Shem
orbitallarining energiyasi quyidagi asriy tenglamadan topiladi:
(28)
Umumiy energiya XFR usulida quyidagicha topilishini inobatga olsak:
E
Total =T + E
ne + J + K+E
nn (29)
DFT usulida ham xuddi shunga o‘xshash:
E
DFT [ ρ ]=T
s [ ρ ] + E
ne [ ρ ] + J[ ρ ] + E
xc [ ρ ] (30)
(29) tenglamada E
ne - elektronlarning yadroga tortishish energiyasi, J-
elektronlarning o‘zaro itarishish kulon energiyasi, K -almashinuv energiyasi, Enn-
yadrolararo ta’sirlashuv, Born-oppengeymer yaqinlashuviga ko‘ra E
nn =const.
38](/data/documents/d5998555-6cd9-4c9b-9408-a9e7931e059f/page_38.png)

![TOTAL KINETIC ENERGY= 151.9512681745
VIRIAL RATIO (V/T)= 2.0001321177
(30) tenglamadagi tenglamadagi E
XC qiymatini topish orqali ko ‘ p elektronli
sistemalarning umumiy energiyasini aniqlash mumkin . Ammo, amaliyotda uning
aniq qiymati ma’lum emas. Ma’lum bo‘lgan DFT usullari parametrlash natijasida
topilgan E
xc [ρ] funksionali bilan farq qiladi [6].
Bir nechta yondoshuvlarga asoslangan DFT usullari taklif qilingan. Masalan,
lokal spin zichlik yondoshuvi (Local Spin Density Approximation), gradientli
korreksiya (GGA-Generalized Gradient Approximation) va gibrid usullar.
LSDA usullarida XFR hisoblash aniqligidagi natijalar olingan. GGA
yondoshuviga asoslangan usullar sarasiga B88 va LYP usullarini kiritish mumkin.
B88 1988-yil Bekke tomonidan taklif qilingan . LYP usulining avtorlari Li, Yang
va Parr hisoblanadi. Hisoblashlarda GGA yondoshuviga asoslangan usullarda LDA
yondoshuviga nisbatab aniqroq natijalar olingan.
Bugungi kunda gibrid yondoshuvga asoslangan usullar keng tarqalgan,
(31)
Masalan, B3LYP. B u yerda, a, b va с Ве kk е tomonidan aniqlangan
konstantalar. Ifoda Xartri-Fok (HF), B88 va LSDA usullaridan topiladigan
tuzatish almashinuv qismlarini o‘z ichiga olgan. Yana shuningdek, korrelyasion
energiyalarni ifodalashda Vosko, Vilk va Nusair (Vosko, Wilk, Nusair)
formulasidan foydalanilgan hamda gradient korreksiya kiritilgan.
Firefly/Gamess programmasidagi B3LYP1 boshqa programmalardagi
B3LYP bilan ekvivalent. Firefly-ga B3LYP5 usuli ham kiritilgan. Undan tashqari
bu programmaga LYP, BLYP, BHHLYP, BVWN5 kabi 20-dan ortiq DFT usullari
kiritilgan .
Gaussian programmasida LSDA, BPV86, B3LYP, CAM-B3LYP, B3PW91,
MPW1PW91, PBEPBE, HSEH1PBE, HCTH, TPSSTPSS, WB97XD va boshqa
usullari mavjud [2,26].
40](/data/documents/d5998555-6cd9-4c9b-9408-a9e7931e059f/page_40.png)


![CH
3 CHO∙∙∙HF va CH
2 O∙∙∙HF komplekslari ham vodorod ftorid kompleksi kabi
kimyoviy xususiyatlarga va C
s simmetriyaga ega [61].
Noempirik hisoblashlar Gaussian-09 dasturi yordamida asetaldegid va
formaldegid molekulalarining HF bilan komplekslarining optimizatsiyalangan
tuzilishlari uchun MP2 usulida, 6-311++G(2d,2p) bazislar to‘plamida amalga
oshirildi. Quyidagi 13- va 14- rasmlarda Asetaldegid va formaldegid
molekulalarining HF bilan komplekslarining geometrik tuzilishlari keltirilgan.
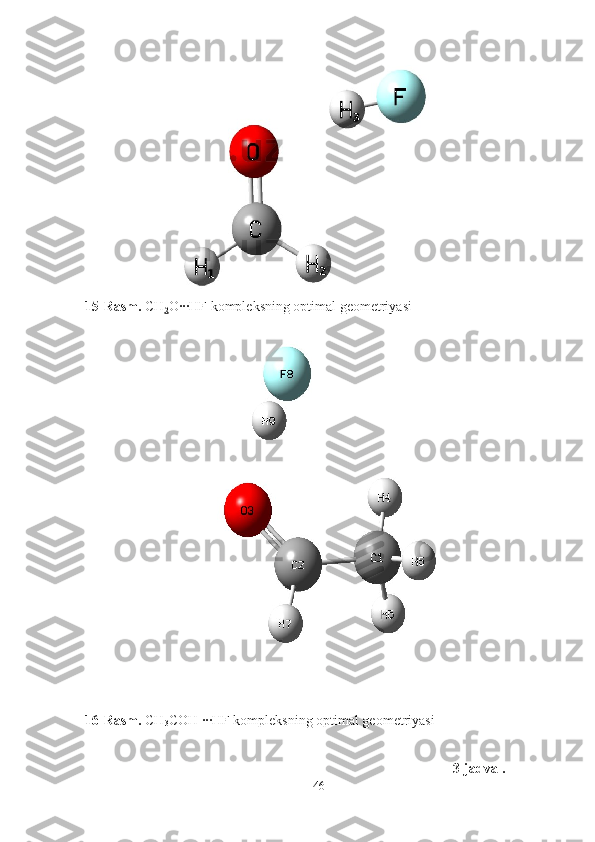
1 3 -rasm. CH
2 O∙∙∙HF kompleksining geometrik tuzilishi
14-rasm. CH
3 CHO∙∙∙HF kompleksining geometrik tuzilishi
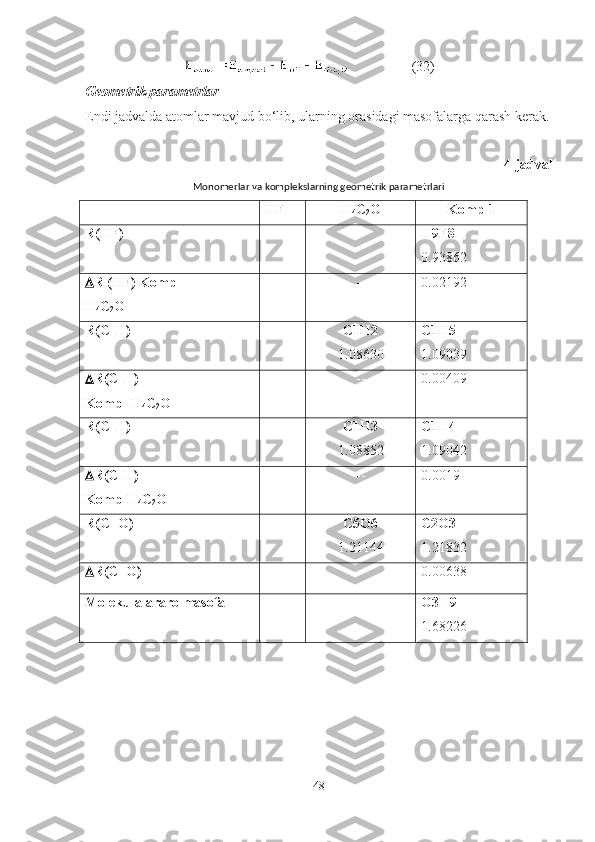
O’zaro ta’sirlashuvchi molekulalarning geometrik parametrlari quyidagicha
atomlar orasidagi masofalar qiymatlari CH
3 CHO∙∙∙HF kompleksida
, , ,
43](/data/documents/d5998555-6cd9-4c9b-9408-a9e7931e059f/page_43.png)

![3.2 CH
2 O (CH
3 COH)∙∙∙HF komplekslari ishtirokida HF molekulasining
tebranish polosasining hosil bo’lish mexanizmini o’rganish
Alohida molekulalarning tebranma va tebranma-aylanma harakati, ularning
o ’ zaro ta ’ siri va bu ta ’ sirlarning spektrda namoyon bo ’ lishini tahlil qilish
ixtiyoriy agregat holatdagi moddalarning tabiatini ularni tebranish spektriga qarab,
tushuntirishda muhim rol o’ynaydi. Т ebranma-aylanma polosalarning hosil
bo ’ lish mexanizmini tushuntirish bugungi kunda spektroskopiyaning dolzarb
muammolaridan biri hisoblanadi. K eyingi yillarda bu borada ancha yutuqlar
qo’lga kiritilgan, tajribada olingan natijalarni kvanto-ximik hisoblash yo’li bilan
tahlil qilib, molekulyar komplekslarning tebranma-aylanma polosalarning har bir
energetik sahtdagi o’tishlarni hisoblash yo’li bilan tiklashga erishilmoqda.
Boshqacha aytganda tebranma-aylanma polosalarning hosil bo’lish mexanizmini
nazariy jihatdan tushuntirish imkoni yaratilmoqda. Lekin bunday olingan
tajribalar ва kvanto-ximik hisoblangan komplekslar soni sanoqli va bu boradagi
izlanishlar jadal davom etmoqda. Ushbu ishda HF molekulasining CH
2 O
(CH
3 COH) molekulalari bilan hosil qilgan komplekslarining IQ yutilish spektrini
tajribada kuzatish va ularni kvanto-ximik hisoblash yo’li bilan yutilish polosalarini
taqqoslash maqsad qilib qo’yilgan. Bu esa tebranish spektroskopiyasida qator
fundamental masalarni yechishda muhim rol o’ynaydi. Jumladan, molekulalararo
o’zaro ta’sir tufayli tebranish polosalarining hosil bo’lish tabiati va mexanizmini
tushuntirish imkonini beradi.
H
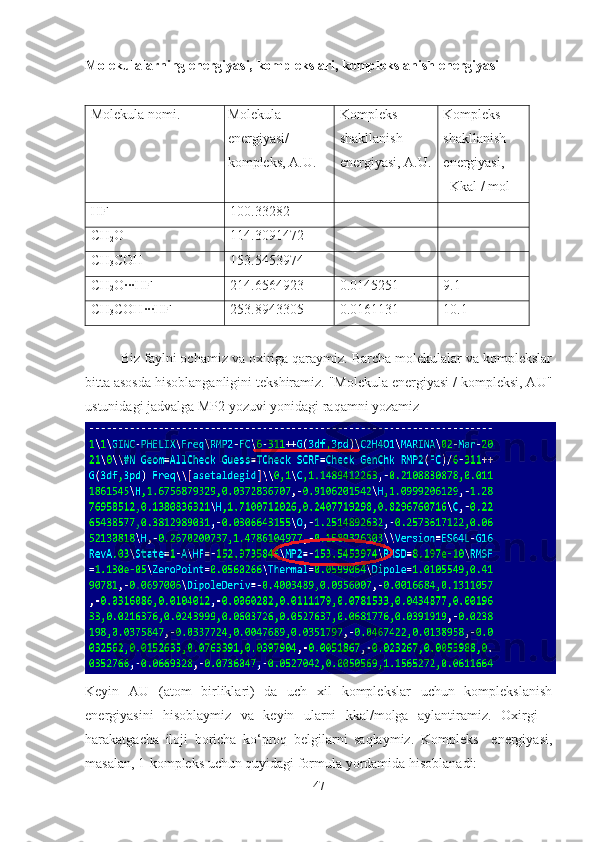
2 CO (CH
3 COH) •••HF komplekslari uchun mp2//6-311++G(3df,3pd)
yaqinlashishda muvozanat geometriyasi, bog’ hosil bo’lish energiyasi, garmonik
va angarmonik spektral parametrlari ba’zislar to’plami xatoligini hisobga olgan
holda Gaussian 09 dasturida ikkinchi tartibli yordamida hisoblangan. Formaldegid
va asetaldegid molekulalarining HF molekulasi bilan hosil qilgan komplekslarining
geometrik tuzilishi, parametrlari keltirilgan va tahlil qilingan. Alohida- alohida bir
nechta bazislarda hisoblanib, o’rganib chiqilgan [56-61] .
45](/data/documents/d5998555-6cd9-4c9b-9408-a9e7931e059f/page_45.png)








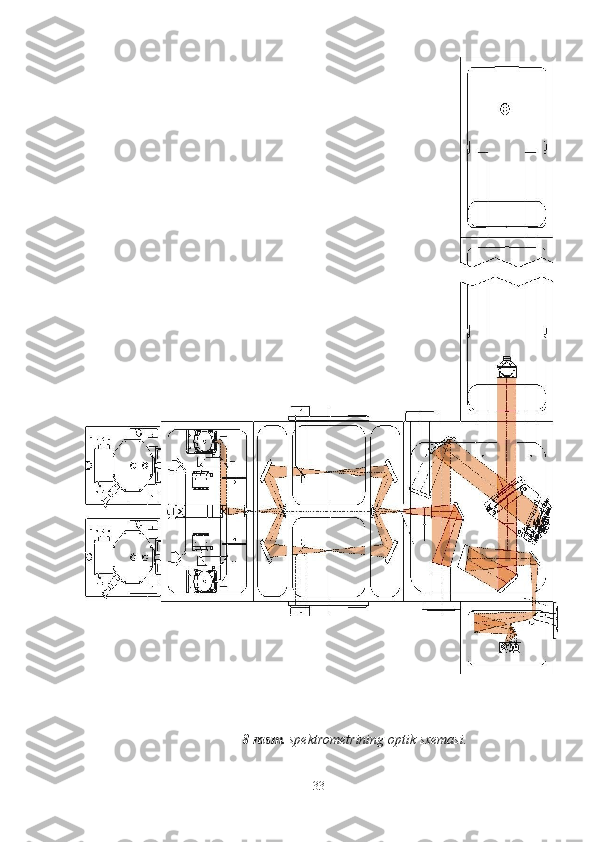
Vodorod ftoridning tebranish polosasini komplekslarda shakllanish mexanizmi MUNDARIJA KIRISH 2 I-BOB . Nazariy qism 5 1.1 Molekula lar ning hosil bo‘lish tabiati 5 1.2 Molekulalararo o’zaro ta’sir va uning tebranish spektrida namoyon bo’lishi 10 1.3 Vodorod bog’lanishli komplekslar va ularning spektral parametrlari, vodorod bog’lanishli komplekslarining umumiy xarakteristikasi 21 II-BOB. Tadqiqot ob’ekti va usullari 31 2.1 Tadqiqot ob’ektini tanlash 31 2.2 Molekulalararo o’zaro ta’sir va vodorod bog’lanishli komplekslarni o’rganuvchi spektral asboblar 33 2.3 Zichlik funksiyalar nazariyasi (DFT) usuli 38 III-BOB . Olingan natijalar va ularning tahlil i 43 3.1 IQ yutilish spektri yordamida CH 2 O (CH 3 COH)∙∙∙HF komplekslarining spektral parametrlarini aniqlash 43 3.2 CH 2 O (CH 3 COH)∙∙∙HF komplekslari ishtirokida HF molekulasining tebranish polosasining hosil bo’lish mexanizmini o’rganish 46 Asosiy natijalar va xulosalar 52 Foydalanilgan adabiyo tlar 53 1
KIRISH Mavzuning dolzarbligi. Alohida molekulalarning tebranma va tebranma- aylanma harakati, ularning o ’ zaro ta ’ siri va bu ta ’ sirlarning spektrda namoyon bo ’ lishini tahlil qilish ixtiyoriy agregat holatdagi moddalarning tabiatini ularni tebranish spektriga qarab, tushuntirishda muhim rol o’ynaydi. Т ebranma-aylanma polosalarning hosil bo ’ lish mexanizmini tushuntirish bugungi kunda spektroskopiyaning dolzarb muammolaridan biri hisoblanadi. K eyingi yillarda bu borada ancha yutuqlar qo’lga kiritilgan, tajribada olingan natijalarni kvanto- ximik hisoblash yo’li bilan tahlil qilib, molekulyar komplekslarning tebranma- aylanma polosalarning har bir energetik sahtdagi o’tishlarni hisoblash yo’li bilan tiklashga erishilmoqda. Boshqacha aytganda tebranma-aylanma polosalarning hosil bo’lish mexanizmini nazariy jihatdan tushuntirish imkoni yaratilmoqda. Lekin bunday olingan tajribalar ва kvanto-ximik hisoblangan komplekslar soni sanoqli va bu boradagi izlanishlar jadal davom etmoqda. Ushbu ishda HF molekulasining CH 2 O (CH 3 COH) molekulalari bilan hosil qilgan komplekslarining IQ yutilish spektrini tajribada kuzatish va ularni kvanto-ximik hisoblash yo’li bilan yutilish polosalarini taqqoslash maqsad qilib qo’yilgan. Bu esa tebranish spektroskopiyasida qator fundamental masalarni yechishda muhim rol o’ynaydi. Jumladan, molekulalararo o’zaro ta’sir tufayli tebranish polosalarining hosil bo’lish tabiati va mexanizmini tushuntirish imkonini beradi. Shuningdek molekulyar kompleks hosil bo’lishini tushuntirishda qaysi potensialni tanlash to’g’ri bo’ladi degan savolga javob izlanadi. Tadqiqot maqsadi – Formaldegid va asetaldegid molekulalarining HF molekulasi bilan hosil qilgan komplekslarining tebranish spektrini o’rganish, molekulaning spektral parametrlarining o’zgarishini tahlil qilish va kvanto- kimyoviy hisoblashlar yordamida tajribada kuzatish imkoni bo’lgan parametrlarni aniqlashdan iborat. Tadqiqot vazifalari quyidagilardan iborat: 2
1. Formaldegid va asetaldegid molekulalarining molekulyar tuzilishi va molekulalararo o'zaro ta'sirlarini kvanto-kimyoviy hisoblashlar yordamida aniqlash. 2. Noempirik hisoblashlar Gaussian-03 va Gaussian-09 dasturi yordamida formaldegid va asetaldegid molekulalarining optimizasiyalangan tuzilishlari uchun mp2 usulida, 6-311++G(2d,2p), 6-311++G(3df, 3pd) bazislar to‘plamida amalga oshirish. Tadqiqot obyekti Mavzuning maqsadidan kelib chiqqan holda tadqiqot davomida quyidagi asosiy vazifalarni hal etish maqsad etib qo’yilgan: - Oddiy ikki atomli HF molekulasining argon, azotdagi spektrlari tajribada olinadi va kvanto-ximik hisoblashlar bajariladi. - HF molekulasining turli ketonlar (O=CH 2 ; OCH,CH 3 ; OCC 2 H 5, CH 3 )lar bilan vodorod bog’lanishli IQ yutilish spektrlari tajribada olinadi va ular argarmonik kvanto-ximik masalalar yechiladi. Tadqiqot predmeti HF va uning ketonlar bilan hosil qilgan tebranma- aylanma polosalarining IQ yutilish spektrlari va uning kvanto-kimyoviy hisoblashlar yo’li bilan tahlil qilish. Tadqiqot usuli sifatida yorug’likning infraqizil yutilish spektri va kvanto- kimyoviy hisoblash usullari tanlandi. Bu esa molekulyar komplekslarning strukturasini, atomlarda zaryadlarning taqsimotini shuningdek ularning dipol momenti va nihoyat bog’lanish energiyasini ma’lum bir aniqlik bilan hisoblash imkonini bermoqda. Ishning ilmiy yangiligi: Ushbu bitiruv malakaviy ishida bog‘lanishlar orasidagi qonuniyatlar, xarakterli va qat’iy agregatlarni ajratish, molekulyar tuzilishidan tashqari shu modda tuzilishi mexanizmlari to‘g‘risida natijalar olindi; Vodorod ftoridning asetaldegid bilan kompleksi noempirik usulda kvanto- kimyoviy hisoblashlar o‘ tkazildi; 3
CH 3 CHO∙∙∙HF misolida vodorod bog’lanishli komplekslar hosil bo’lishi natijasida molekulalarning spektral parametrlarida bo’ladigan o’zgarishlarni tushuntirishdan iborat. Bitiruv malakaviy ishining tuzilishi va hajmi. Ish kirish, 3 ta bob, xulosa va 61 nomdagi foydalanilgan adabiyotlar ro’yxatidan iborat bo’lib, 58 sahifada bayon qilingan. Ishda 17 ta rasm mavjud. 4
I-BOB . Nazariy qism 1.1 Molekula lar ning hosil bo‘lish tabiati Molekulalarning tuzilish nazariyasini o’tgan asrning o’rtalarida A. M. Butlerov yaratdi. Bu nazariyaga muvofiq, molekulalarning xossalari uning tarkibiga kirgan atomlarning tabiati va sonidan tashqari, ular orasidagi bog’lanish xarakteriga va ularning fazoda bir-biriga nisbatan joylashishiga ham bog’liq. Kvant mexanikasiga asoslanib, atomlar orasidagi bog’lanishning tabiatini, atomlarning bir-biriga bevosita ta’sir qilishini va fazoda qanday joylashuvini aniqlashga muvoffaq bo’linadi. Ma’lumki, molekula barqaror sistemadir. Molekuladagi atomlarni bir- biridan ajratish uchun ma’lum energiya sarf qilish kerak bo’ladi. Bu esa molekuladagi atomlarning biror kuch bilan bir-biriga tortishib turganligini ko’rsatadi. Atomlar orasida ularni bir-biriga tortib turadigan bog’lar bor. Atomlar orasidagi bunday bog’lar kimyoviy kuchlarning, ya’ni valent kuchlarning ta’sir qilishini natijasida vujudga keladi. Atomlar orasidagi valent bog’lanishning elektr tabiatli ekanligini 1908-yilda V. Ya.Kurbatov ta’riflab bergan edi. Kimyoviy reaksiyalarda elektronlarning gruppalanish xarakteriga qarab, elektron nazariyasi asosida, bir qancha bog’ borligi aniqlanadi. Qanday bog’lanish vujudga kelishiga elementlarning elektromanfiyligi (oddiy hollarda) katta ta’sir ko’rsatadi. Quyida biz ba’zi bog’lanishlarni ko’rib o’tamiz. Ion bog’lanish (yoki elektrovalent bog’lanish). Ion bog’lanish nazariyasini 1916-yilda Kossel ta’riflagan. Ion bog’lanish elektromanfiylik jihatidan bir-biridan katta farq qilgan ikki element orasida vujudga keladi. Demak, ion bog’lanish birinchi gruppa elementlari (ishqoriy metallar ) bilan yettinchi gruppa elementlari (galoidlar) orasida vujudga keladi. Eng tipik ion bog’lanish LiF birikmasida bo’ladi. Ion bog’lanishning vujudga kelishini NaCl misolida ko’rib chiqaylik. Xlor atomi natriy atomiga qaraganda anchagina eletromanfiydir, shu sababli ular bir-biriga ma’lum masofagacha yaqinlashganda natriy atomi o’zining sirtqi qavatidagi bir elektronini 5
