Galvanik elementlar















Mavzu: Galvanik elementlar.
RE J A : • Galvanik element; • Elektrod potensial miqdori; • Fizik va fizik-kimyogar olimlar; • EYUK ni hisoblash; • Foydalanilgan adabiyotlar.
• Galv anik element lar deb, ok sidlanish- qay t arilish reak siy alari nat ijasida k imy ov iy energiy ani elek t r energiy asiga ay lant irib beruv chi elek t rok imy ov iy sist emalarga ay t iladi. • Galvanik elementlar boshqacha nom bilan kimyoviy tok manbalari ham deb aytiladi. Bular qatoriga akkumulyatorlar, batareyalar kiradi.
Ga l v a n i k el em en t l a r n i n g e l e k t r y u r i t u v c h i k u c h i h a qi da gi t a’ l i m ot e l e k t rok i m y on i n g a sosi y bo’ l i m l a r i da n bi r i di r. • EYUK ni o’rganishni dastlab Lomonosov (1750) boshlagan. U kimyoviy hodisalar bilan elektr hodisalari o’zaro bog’liqligini aniqladi.
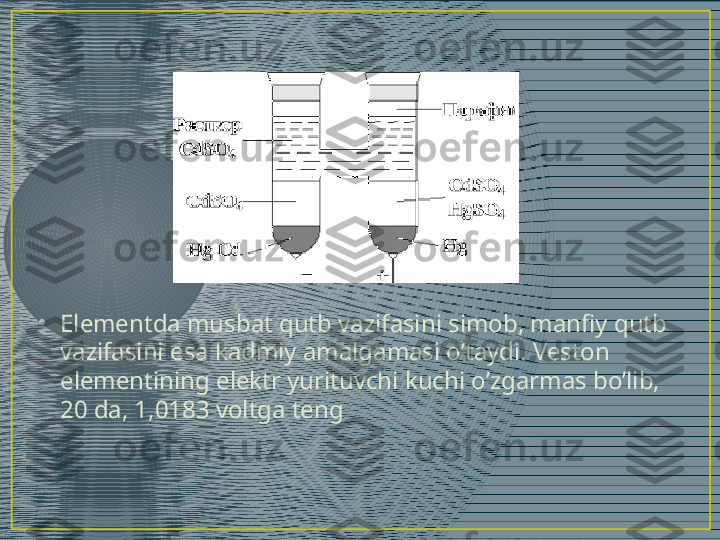
• Keyinchalik italyan fiziologi Galvani (1780) va italyan fizigi Voltaning (1780) ishlari galvanik elementlarni yaratish imkonini berdi.
