Organik moddalarning mass-spektrlari




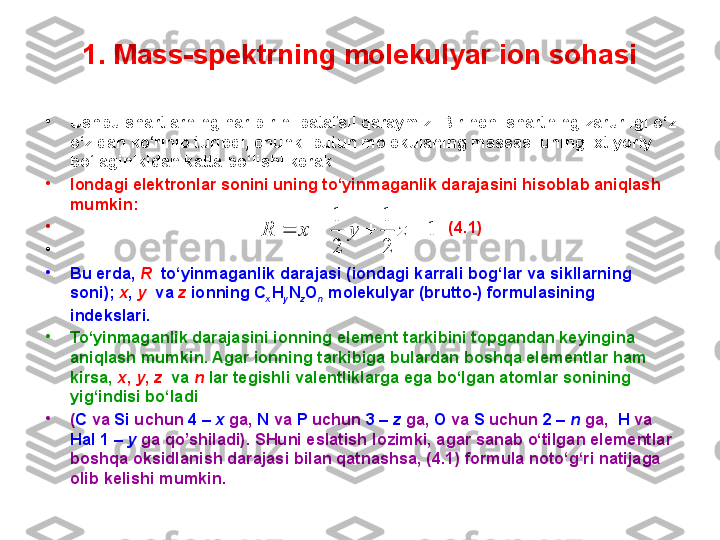






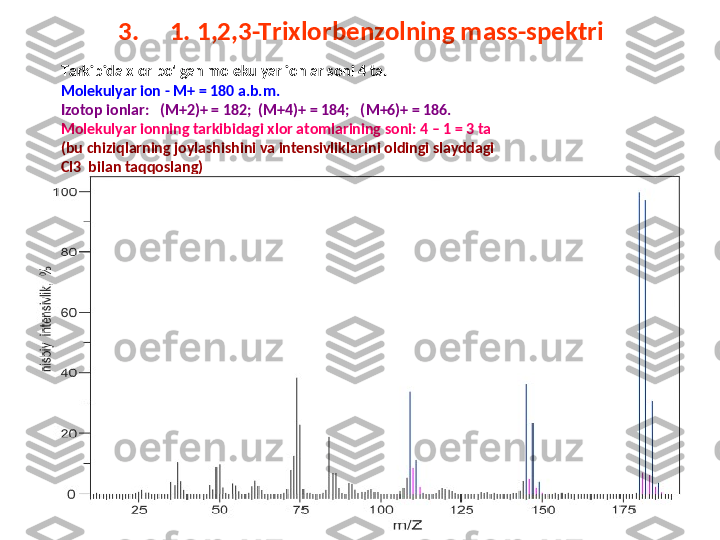

![3. 1,2,3-T riхlorbenzolning mass-spektri
•
M assa soni 180 a.b.m bo'lgan molekulyar ionga tegishli chiziqning intensivligi 100 %,
massasi 181 bo'lgan izotop ionga tegishli chiziqniki esa 7,0 % ga teng (jadvalga qarang) .
•
H ar bi r 13 C atomining 181 D alton izotop chiziq intensivligiga qo'shgan ulushi 1,1 %
ekanligini hisobga olib uglerod atomlarining sonini topamiz. (7,0:1,1) = 6,36 . D emak
molekulaning tarkibidagi uglerod atomlarining soni 6 ta . [massa sonlari 1 a.b.m. ga farq
qiluvchi 182 va 183 hamda 184 va 185 izotop chiziqlarning intensivliklarini nisbati ham
molekulaning tarkibida 6 ta uglerod atomlari borligini ko'rsatadi.] U larning massasini
hisoblaymiz. (6*12) = 72. U chta хlor va oltita uglerod atomlarining massa soni 105 + 72 =
177 bo'ladi.
•
M olekulyar ionning massasidan bu sonni ayirib 180 – 177 = 3 ni topamiz. D emak
molekulaning tarkibida 3 ta vodorod atomi bor.
•
S hularni h isobga olib molekulaning brutto formulasini yozamiz. C 6 H 3 Cl 3 . triхlor benzol.](/data/documents/52f2596f-5142-43c8-96ac-5f811099b859/page_15.png)





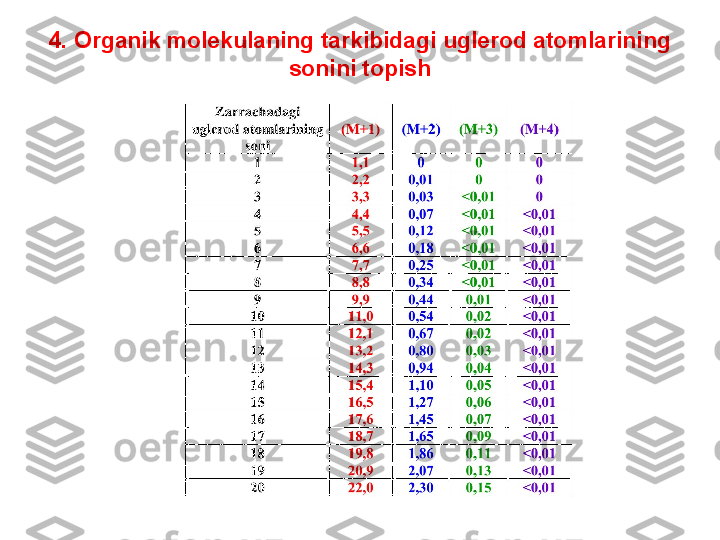
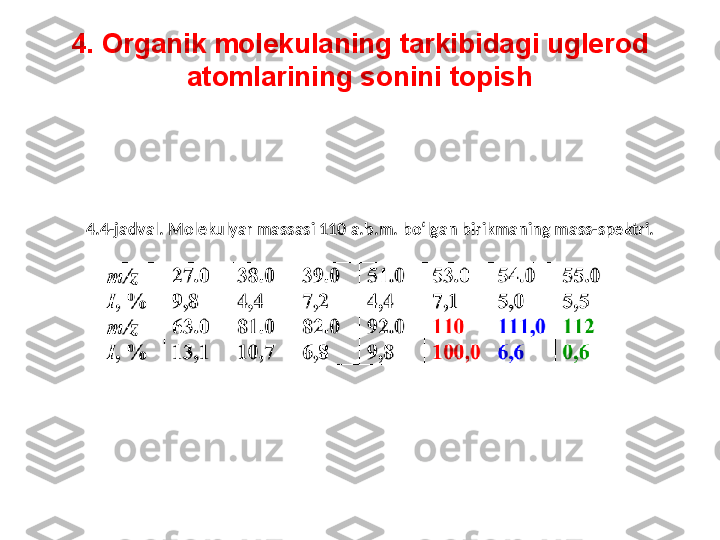
![4. Organik molekulaning tarkibidagi uglerod
atomlarining sonini topish
•
Uglerod organik birikmalarning muhim elementi hisoblanadi. Mass - spektrlarni
talqin qilishda odatda 13
C ning miqdori 12
C ga nisbatan 1,1% deb olinadi.
•
Metan molekulasidagi bitta uglerod atomi spektrda M +
ionga tegishli m/z ti 16 va
intensivligi M +
ning 1,1 % ga teng bo‘lgan m/z 17 signallarning paydo bo‘lishiga
olib keladi. Bu izotop signal tabiatda har 1000 ta 12
CH
4 molekulaga to‘g‘ri keluvchi
11 ta 13
CH
4 molekulaga tegishli bo‘ladi.
•
Molekulada uglerod atomlari sonining ko‘payishi M+1 ionlarga tegishli signal
intensivligini 1,1 n % ga ko‘payishiga olib keladi.
•
Bu erda n – molekuladagi uglerod atomlarining soni. Mass-spektr bo‘yicha
molekuladagi uglerod atomlarining sonini aniqlash uchun, M ga nisbatan
foizlarda hisoblangan M+1 ion signali intensivligini 1,1 ga bo‘lish kerak. Olingan
bo‘linma molekuladagi uglerod atomlarining soniga teng bo‘ladi.
•
Spektrda [M – H] +
ionga tegishli signal bo‘lgan hollarda (quyiga qarang) hisob-
kitobning murakkablashishini esda tutish kerak.](/data/documents/52f2596f-5142-43c8-96ac-5f811099b859/page_24.png)
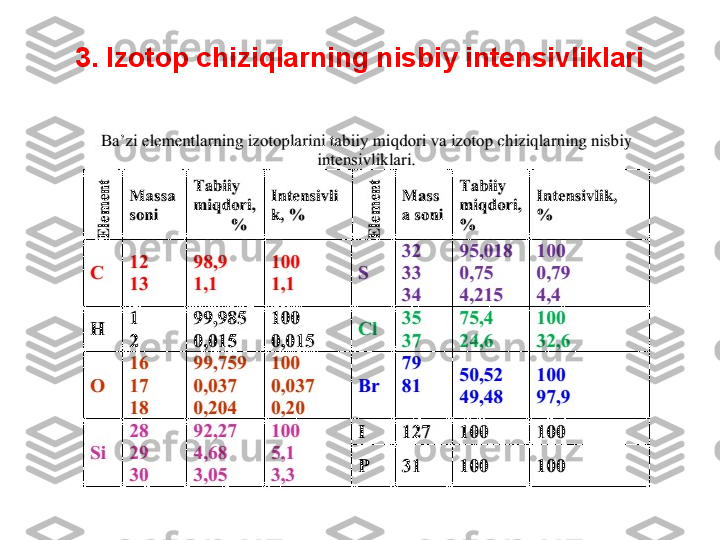
![4. Organik molekulaning tarkibidagi uglerod
atomlarining sonini topish
•
Ko‘p sonlik uglerod atomlari bir vaqtda molekulada ikkita va undan ko‘proq 13
C
atomlarning ishtirok etish ehtimolini ko‘paytiradi, bu esa o‘z navbatida [M+2],
[M+3] va hokazo izotop ionlarga tegishli signallarning intensivligini ko‘payishiga
olib kelada (4.3-jadval).
•
Ionning tarkibidagi boshqa elementning har bir atomi uchun A+1 signalning
intensivligini 0,37% ga (azot uchun), 0,04% ga (kislorod uchun), 5,1% ga (kremniy
uchun), 0,8% ga (oltingugurt uchun) hamda A+2 ning intensivligini 0,2% ga
(kislorod uchun), 3,4% ga (kremniy uchun), 4,4 ga (oltingugurt uchun), 32,5% ga
(xlor uchun), 98,0% ga (brom uchun) ko‘paytirish zarur.
•
YOki aksincha agar birikmada oltingugurt, kremniyning va azot atomlarining
borligi isbotlansa, uglerod atomlarining sonini topishdan oldin [M+1] signalning
intensivligidan, unga oltingugurtning (0,8n) , kremniy (5,1n) va azotning n
atomlari qo‘shgan ulush chiqarib tashlanadi.](/data/documents/52f2596f-5142-43c8-96ac-5f811099b859/page_25.png)




Organik moddalarning mass-spektrlari R eja : 1. Mass -s pektrning molekulyar ion sohasi. 2. Izotop signallar asosida ionning element tarkibini aniqlash. 3 . Xlor, brom, oltingugurt va kremniy tutgan birikmalarning mass-spektrlari. 4. Organik molekulaning tarkibidagi uglerod atomlarining sonini topish. 5. Azot qoidasi. 6. Xulosalar
1. Mass -s pektrning molekulyar ion sohasi • Mass-spektrlarni talqin qilishning (“o‘qish”ning) amaliy asoslari • Organik moddaning mass-spektrini olgandan keyin uni “o‘qish”ni nimadan boshlash kerak? • Birinchidan, ushbu namunaning paydo bo‘lishi haqidagi to‘liq ma’lumotlarni bilish maqsadga muvofiq bo‘ladi. Bu erda juda ko‘p ma’lumotlar muhim (ajratish va sintez qilish usuli, boshlang‘ich reagentlar va erituvchilarning tabiati, aralashmalarning mavjudligi va hokazo). • Ikkinchidan, oldin ushbu mass -spektrni kompyuter kutubxonasidagi mavjud spektrlar bilan taqqoslash kerak. Ideal holda masala shu bosqichda echimini topishi kerak. Bunday holda yangi spektrni ma’lum birikmalarning spektrlari bilan taqqoslash orqali olingan ma’lumot namunani organik birikmalarning biror aniq sinfiga tegishli ekanligini topishga ma’lum funksional guruhlarning mavjudligini aniqlashga yordam beradi. • Agar spektrlarning kutubxonasi aniq javob olishga imkon bermasa, spektrning umumiy ko‘rinishiga e’tibor berish kerak: spektr olish sharoitlarini (parametrlarini) hisobga olish, eng intensiv signallarga va ularning xarakterli guruhlariga e’tibor berish.
1. Mass -s pektrning molekulyar ion sohasi • Molekulyar ion • Spektrning molekulyar ion sohasini tahlil qilish natijasida olish mumkin bo‘lgan ma’lumotlar haqiqatan ham juda katta. Molekulyar ionning massasi M + analiz qilinayotgan birikmaning massasiga teng. Izotoplarga tegishli signallar intensivliklarining nisbati ionning taqribiy element tarkibini aniqlashga imkon beradi. • Molekulyar ionga tegishli signalning nisbiy intensivligini aniqlash uning tuzilishi, analiz qilinayotgan birikmaning u yoki bu sinfga tegishliligi haqida ma’lum xulosalar qilishga imkon beradi. Masalan, uglevodorodlar uchun birikma to‘yinmaganlik darajasining ortishi bilan to‘liq ion tokida M + signalning nisbiy intensivligi ham ortadi. • Afsuski, ko‘pchilik birikmalar elektron zarb ta’sirida molekulyar ionga tegishli signalni bermaydi. SHu munosabat bilan spektrda M + ga tegishli signalni to‘g‘ri topishni o‘rganish zarur.
1. Mass -s pektrning molekulyar ion sohasi • Signalni molekulyar ionga tegishli deb hisoblash uchun ion to‘rtta zarur, lekin, etarli bo‘lmagan shartni qanoatlantirishi kerak. • 1) Spektrda eng katta massaga ega bo‘lishi kerak; • 2) Toq elektronga ega bo‘lishi kerak; • 3) O‘zidan real neytral zarrachalarni chiqarib yuborish hisobiga, katta massalik muhim ionlarni hosil qilishga moyil bo‘lishi kerak; • 4) Namunada mavjudligi ion bo‘laklari orqali ko‘rinadigan hamma elementlarni o‘zida jo qilishi kerak. • Hatto bu shartlarning bittasi bajarilmasa ham ion molekulyar bo‘lmaydi. To‘rtta shartning hammasi bajarilganda, ion molekulyar bo‘lishi mumkin.
1. Mass -s pektrning molekulyar ion sohasi • Ushbu shartlarning har birini batafsil qaraymiz. Birinchi shartning zarurligi o‘z o‘zidan ko‘rinib turibdi, chunki butun molekulaning massasi uning ixtiyoriy bo‘laginikidan katta bo‘lishi kerak. • Iondagi elektronlar sonini uning to‘yinmaganlik darajasini hisoblab aniqlash mumkin: • (4.1) • • Bu erda, R to‘yinmaganlik darajasi (iondagi karrali bog‘lar va sikllarning soni); x , y va z ionning C x H y N z O n molekulyar (brutto-) formulasining indekslari. • To‘yinmaganlik darajasini ionning element tarkibini topgandan keyingina aniqlash mumkin. Agar ionning tarkibiga bulardan boshqa elementlar ham kirsa, x , y , z va n lar tegishli valentliklarga ega bo‘lgan atomlar soni ning yig‘indisi bo‘ladi • ( C va Si uchun 4 – x ga , N va P uchun 3 – z ga , O va S uchun 2 – n ga , H va Hal 1 – y ga qo’shiladi ). SHuni eslatish lozimki, agar sanab o‘tilgan elementlar boshqa oksidlanish darajasi bilan qatnashsa, ( 4. 1) formula noto‘g‘ri natijaga olib kelishi mumkin. 1 2 1 2 1 z y x R
