Sintetik ammiak ishlab chiqarish














Mavzu: Sintetik ammiak ishlab chiqarish
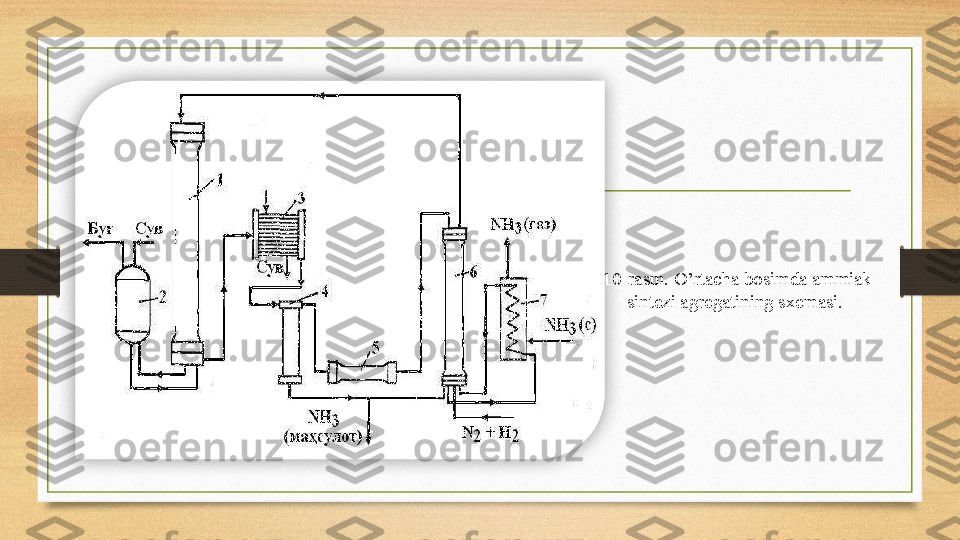
1. Ammiak va uning fizik-kimyoviy xossalari. 2. Ammiak sintez qilish. 3. Reaktor – sintez minorasi. 4. Ishlab chiqarish agregatlarining sxemasi. 5. Suyuq ammiakni saqlash va tashish. Reja:
• Ammiak va uning fizik-kimyoviy xossalari. Ammiakning fizik xossalari. Odatdagi sharoitda NH 3 rangsiz, o’ziga xos o’tkir hidli gazdir. Ammiak havodan qariyib 2 marta yengil, shuning uchun uni to’ntarilgan idishga yig’ish mumkin. Bir litr ammiakning normal sharoitdagi og’irligi 0,77 gramm keladi. Ammiak odatdagi bosimda –33,4 0 S da suyuq holga o’tadi, –77,4 0 S da qotadi. Ammiak suvda yaxshi eriydi, 20 0 S haroratda bir hajm suvda 762 hajm, 0 0 S da 176 hajm ammiak eriydi. Ammiakning suvda eriganda ko’p issiqlik chiqadi, hosil bo’lgan eritma «novshadil spirt» deb ataladi. Sotuvdagi novshadil spirt eritmasi 25% li bo’lib, solishtirma og’irligi 0,91 ga teng. • Ammiakning kimyoviy xossalari . Ammiak birikish, o’rin olish, oksidlanish reaktsiyasiga kirishadi. Suvda erigan NH 3 ning ko’p qismi NH 3 holida bo’ladi, shuning uchun uning ertmasidan ammiak hidi kelib turadi. Erigan ammiakning oz qismi suvning vodorod ionlari bilan birikib, NH 4 + ioni hosil qiladi, bir valentli bu musbat ion «ammoniy» deb ataladi va birikmalarda bir valentli metall kabi bo’ladi, suvning ON - ioni bilan birikib, NH 4 OH hosil qiladi. • NH 3 + H 2 O ⇄ NH 4 OH ⇄ NH 4 + + OH − (4.13)
• Suv nihoyatda oz dissotsilangani uchun reaktsiya chap tomonga kuchli siljigan bo’ladi. SHu sababli eritmada OH - ionlari oz va eritmada kuchsiz asos xossasi bo’ladi. • Demak, muvozanat NH 4 OH dan NH 3 ∙H 2 O tomonga siljigan, eritmada NH 4 OH kontsentratsiyasi juda oz, shu sababdan kuchsiz deb yuritiladi. Ammiak eritmasiga kuchli kislotalar ta’sir ettirilsa tuz va suv hosil bo’ladi, ya’ni ammoniy gidroksid kislota bilan neytrallanadi. • NH 3 + H + = NH 4 + • OH - + H + = H 2 O • Ammoniy gidroksidning kislotalar bilan neytrallanishi qo’yidagicha yoziladi: • NH 4 OH + HCl = NH 4 Cl + H 2 O (4.14) • 2NH 4 OH + H 2 SO 4 = (NH 4 )SO 4 + 2H 2 O (4.15) •
• Hosil bo’lgan tuzlar ammoniy tuzlari deyiladi. Ammoniy tuzlarini ammiak gaziga to’g’ridan-to’g’ri kislotalar ta’sir ettirish yuli bilan ham olish mumkin, masalan: • NH 3 + HCl = NH 4 Cl • Ammiakning laboratoriyada olinishi . Laboratoriyada NH 4 Cl bilan so’ndirilgan ohakdan iborat aralashma qizdirilib ammiak hosil qilinadi: • 2NH 4 Cl + Ca(OH) 2 = CaCl 2 + 2H 2 O + 2NH 3 (4.16) • Ammiak sintez qilish. Ammiak sintezining fizik-kimyoviy asoslari. Ammiak sintezi quyidagi reaktsiya bilan ifodalanadi: • N 2 + 3H 2 ⇄ 2NH 3 + Q • Ammiak sintezi hajm kamayishi va issiqlik ajralishi bilan boradigan qaytar jarayondir. Demak, bosimni oshirish va haroratni pasaytirish orqali reaktsiya muvozanatini ammiak sintezi tomonga siljitish mumkin. Masalan, 200 O S harorat va 10 atm bosimda azot va vodorod stexiometrik nisbatidagi aralashmasida NH 3 ning muvozanat kontsentratsiyasi 50,7% ni tashkil etadi. Xuddi shu bosimda haroratni 300 O S gacha oshirilishi ammiak kontsentratsiyasining 14,7% gacha pasayishiga olib keladi. 300 O S haroratda, ammo bosim 10 atm emas, balki 300 atm bo’lganda NH 3 kontsentratsiyasi 71,0% ni tashkil etadi.
