Nitrat kislota ishlab chiqarish






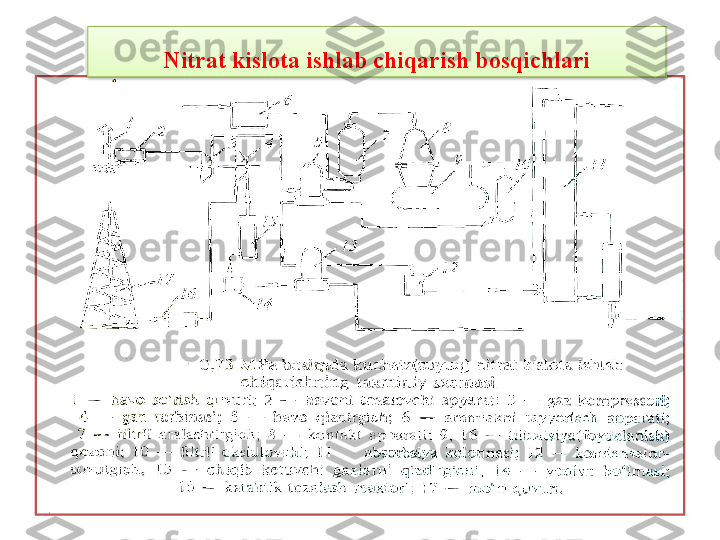

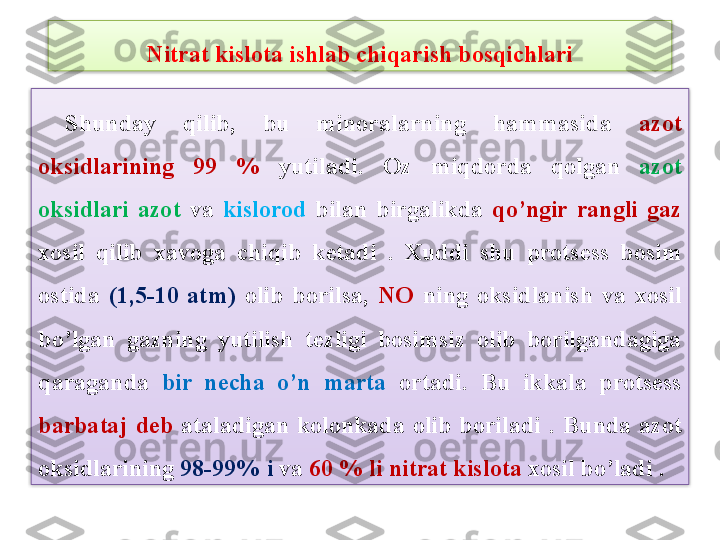
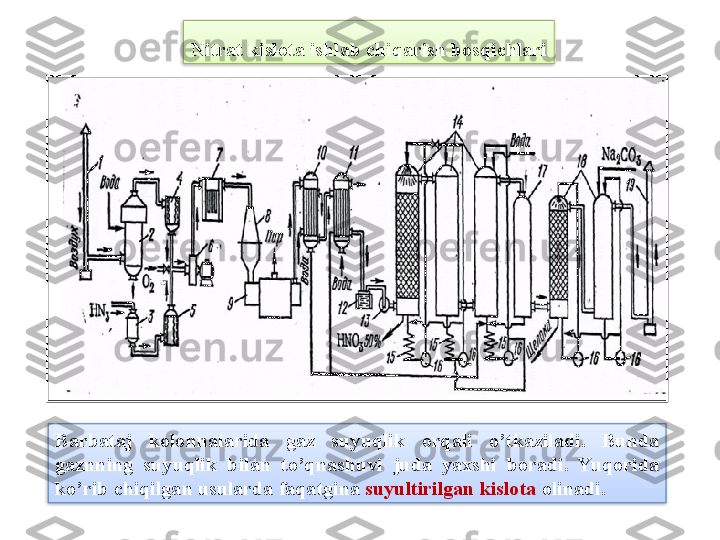


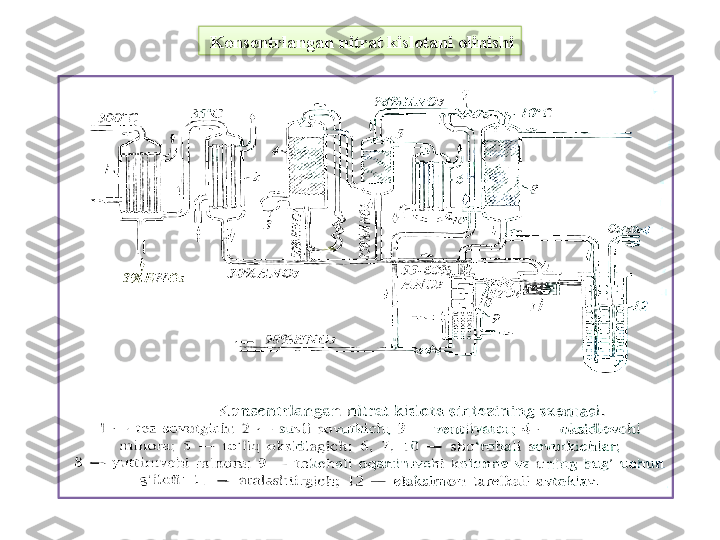









Mavzu: Nitrat kislota ishlab chiqarish
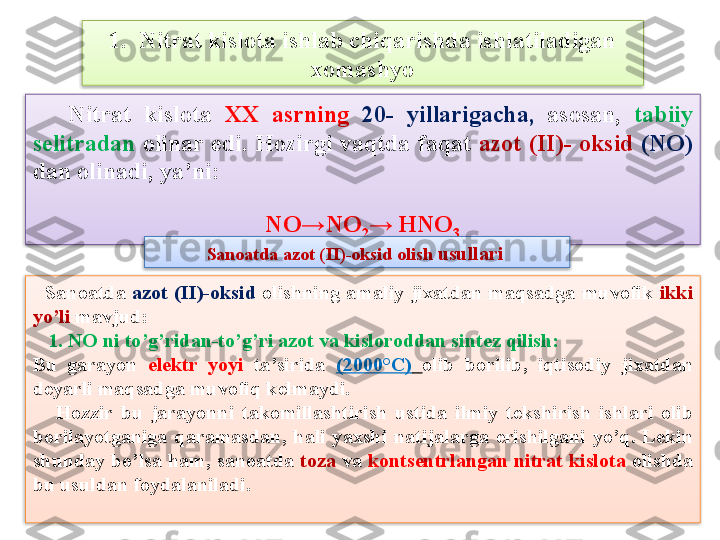
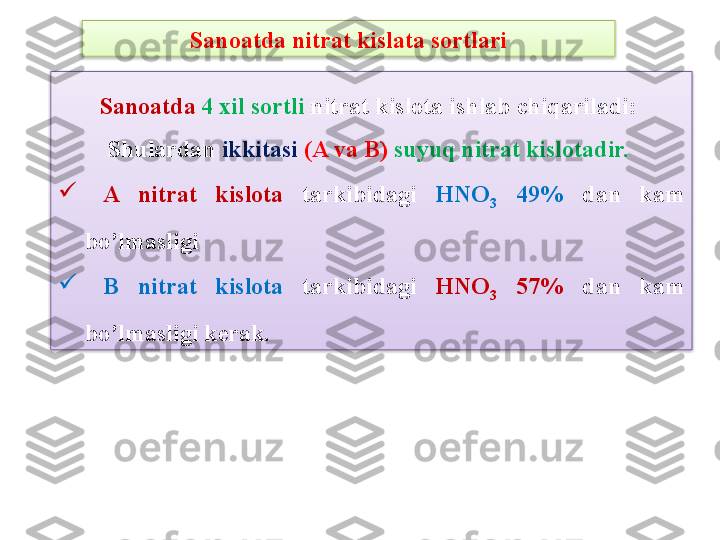
Mavzu rejasi: 1. Nitrat kislota ishlab chiqarishda ishlatiladigan xomashyo 2. Ammiakni oksidlash t е xnologiyasi 3. Nitrat kislota ishlab chiqarish bosqichlari 4. Kons е ntrlangan nitrat kislotaning olinishi 5. Sanoatda nitrat kislota sortlari 6. Nitrat kislotaning fizikaviy xossalari 7. Nitrat kislotaning kimyoviy xossalari 8. Nitrat kislotaning ishlatilishi
Nitrat kislota VII asrdan buyon ma’lum. Ming yillardan ko’proq vaqtdan beri uni selitrani temir kuporosi yoki qo’sh tuzlar, achchiq toshlar bilan aralashtirib qizdirish yo’li bilan olingan. XVIII asrning oxirlarida XX asrning 20-yillarigacha nitrat kislota faqat tabiiy selitradan konsentrlangan sulfat kislota ta’sir ettirib olingan. NaNO 3 + H 2 SO 4 = HNO 3 + NaHSO 4
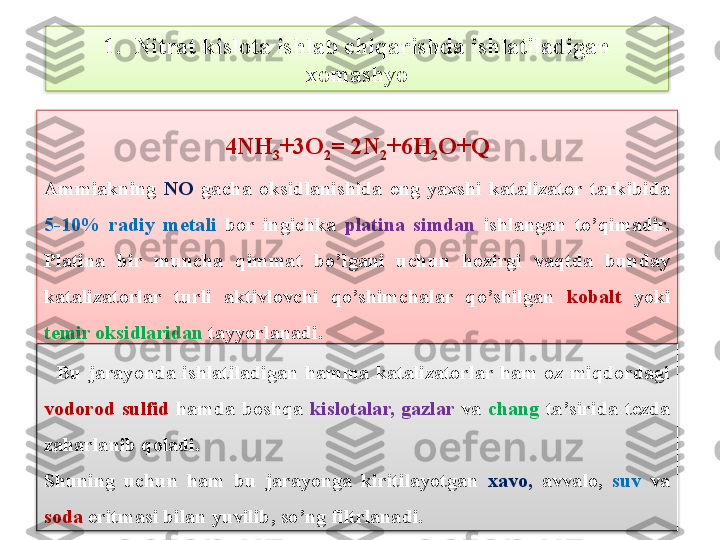
1. Nitrat kislota ishlab chiqarishda ishlatiladigan xomashyo Nitrat kislota XX asrning 20- yillarigacha, asosan, tabiiy s е litradan olinar edi. Hozirgi vaqtda faqat azot ( II )- oksid ( NO) dan olinadi, ya’ni: NO → N O 2 → HNO 3 Sanoatda azot ( II )-oksid olishning amaliy jixatdan maqsadga muvofik ikki yo’li mavjud: 1. NO ni to’g’ridan-to’g’ri azot va kisloroddan sint е z qilish: Bu garayon el е ktr yoyi ta’sirida (2000°C) olib borilib, iqtisodiy jixatdan d е yarli maqsadga muvofiq k е lmaydi. Hozzir bu jarayonni takomillashtirish ustida ilmiy t е kshirish ishlari olib borilayotganiga qaramasdan, hali yaxshi natijalarga erishilgani yo’q. L е kin shunday bo’lsa ham, sanoatda toza va konts е ntrlangan nitrat kislota olishda bu usuldan foydalaniladi. Sanoatda azot ( II )-oksid olish usullari
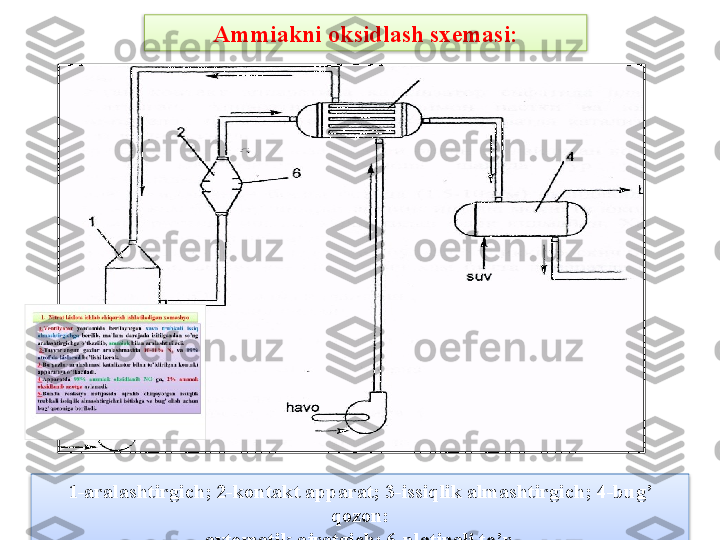
2. Ammiakni oksidlab NO xosil qilish. Bu usul 1839 yili n е mis olimi Kyulman tomonidan kashf etilgan bo’lib, ko’p mamlakatlarda nitrat kislota olish uchun asosiy usul bo’lib qo’llanilib k е lgan. Sanoatda bu usul bilan, asosan, suyultirilgan nitrat kislota ishlab chiqdriladi, u ikki bosqichdan iborat: a) ammiakning oksidlanib NO ga aylanishi; b) NO ni NO 2 gacha qayta ishlab HNO 3 xosil qilish. Ammiakning oksidlanishi quyidagi rеaksiya bilan boradi: 4 NH 3 + 5O 2 = 4NO + 6H 2 O. Ammiak bilan kislorodning o’zaro ta’sirlashuvi yuqori t е mp е raturada (800 – 900 0 C) mo’l miqdor kislorod hamda katalizatorlar ishtirokida t е z boradi. Bu j arayon 900°C da katalizator ishtirokisiz ham boradi. L е kin bunda NO emas, el е m е ntar azot xosil bo’ladi: 2. Ammiakni oksidlash t е xnologiyasi.
