Kvanto-ximik hisoblashlar orqali dimetilsulfoksid va uning eritmalarida molekulyar agregatsiyalarni o’rganish




![I-BOB . NAZARIY QISM
1.1 Suyuqliklarda yorug`likning sochilishi
Yorug`lik sochilishining elementar kvant nazariyasi fotonlarning modda
zarralari bilan to`qnashuvini va bunda foton bilan sochuvchi zarra o`rtasida impuls
va energiya almashinuvini hisobga olgan holda tuzilishi mumkin.Modda
yorug`likni sochganda yorug`lik to`lqini bir vaqtda moddaning ko ‘ plab zarralari
bilan o`zaro ta’sirda bo`ladi, shuning uchun bunday o`zaro ta`sir xarakterini
aniqlash uchun moddaning to`liq energiya spektirini bilish kerak.Umumiy holda
modda molekulalarining energiyasi elektron, tebranish va aylanish energiyalarga
ajiralishi mumkin bo`lgan energiyadir. Kondensiyalangan moddada
fluktuatsiyalarda tebranishi ro`y beradigan molekulalarning o`zaro ta`sir
energiyasini hisobga olish kerak bo`ladi. Fluktuatsiyalarning o`zini esa,kristal
panjaralarining tebranishi,ya`ni elastik to`lqinlarning moddada tarqalishi sifatida
qarash mumkin.Moddaning energiya spektridagi chastota sohalarida: 1) elastik
to`lqinlarning Debay spektriga; 2) aylanish chastotalari spektriga; 3) tebranish
chastotalari spektriga va 4) elektron spektriga tegishli sohalarni ajiratish
mumkin[1,3].
Energiya spektrining Debay sohasi - 10 10
÷
10 11
Gs chastotalarni ; aylanish
spektri sohasi -- 10 11
÷10 13
Gs chastotalarni ; tebranish spektri sohasi --10 13
÷10 14
Gs tartibdagi chastotalarni o`z ichiga oladi. Elektron spektri chastotalari 10 14
Gs
sohadan yuqorida yotadi. Sanab o`tilgan bu sohalar bir-birini qoplashi mumkin,
biroq ana shu sohalar bo`yicha ajralish tamoman qonuniydir.
Tebranish va aylanish chastotalarning o`ziga xos tomoni shuki, ularning
o`zaro o`tishida yuzaga keladigan energiya sathlari molekulalar ichidagi o`zaro
ta`sirlarga muvofiq keladi va shunga ko`ra, ayrim zarralar yoki zarralarning uncha
katta bo`lmagan guruhlarida lokallashadi. Shuning uchun, molekulalar ichidagi
tebranma va aylanma harakatlar moddada to`lqinsimon tarqalmaydi. Moddada
5](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_5.png)
![ayrim molekulalarining tebranish va aylanishi fazalari jihatidan bir-biri bilan
o`zaro bog`lanmagan. Bundan bu ko`rinishdagi harakatlar (tebranish va aylanish)
o`zaro ta`sirlashgandagi sochilgan nurga mos keluvch nurlanish kogirent
bo`lmaydi, degan xulosa chiqadi. Aksincha zichlik fluktuatsiyasi tufayli bo`ladigan
Debay elastik-issiqlik tebranishlari moddada tarqaladi va bu harakatlardagi
yorug`lik sochilishi moddaning turli hajmlaridan chiquvchi nurlanishning kogirent
bo`lishiga olib keladi. Debay to`lqinlarida bo`ladigan sochilish zichlik
fluktuatsiyalarida bo`ladigan sochilishning o`zi, ya’ni Reley sochilishi bo`lgani
uchun, Reley sochilishi yorug`likning kogerent sochilishi razryadiga tegishli
bo’ladi [2].
Yorug`lik va moddaning umumiy holdagi o`zao ta`sir energetik sxemasini
qarab chiqaylik. 1-rasmda moddani turli energiyali yorug`lik kvantlari bilan
nurlatilganda hosil bo`ladigan sath va o`tishlarning sxemasi keltirilgan. Bu yerda
W
e1 ,W
e2 ,… ikki elektron energiya sathlari qiymatlariga mos keladi. Turli energiyali
tebranish sathlari V=0,1,2,… sonlar bilan belgilangan, V - tebranish kvant soni,
tenranish sathlari ustida J = 1, 2, 3, 4, 5, … sonlar bilan nomerlangan aylanish
strukturasi ko`rsatilgan (J-aylanish kvant soni). Birinchi elektron sathning aylanish
strukturasidan pastda ΔW
D energiya polosasi bilan chegaralangan Debay
spektrining strukturasi ko`rsatilgan.
Agar moddaga tushuvchi yorug`lik kvanti 1 kesma bilan aniqlanuvchi
energiyaga ega bo`lsa, u holda moddaning molekulasida W
e1 pastgi elektron
sathida (tebranish-aylanish strukturaning qo`shimcha sathlaridan biridan, mazkur
holda, V=0, J=0 qo`shimcha sathidan) yuqori elektron sathiga, ya’ni tebranish-
aylanish strukturaning qo’shimcha sathiga (V=1, J=1) o`tish sodir bo`ladi.
Molekulaning V=1, J=1 qo`himcha sathdan V=0, J=0 qo`shimcha sathiga
nurlanishsiz o`tishidan so`ng (3-strelka ), elektron W
e1 pastki elektron sathining
tebranish - aylanish strukturasidagi biror qo`shimcha sathga o`tadi (2-strelka),
bunda fluorestsentsiya hodisasi ro`y beradi.
6](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_6.png)




![komponentlarning soni ikkidan ko’p bo’ladi. Masalan, kristallarda yorug’lik
sochilishida oltita siljigan komponent, suyuqliklarda ikkita siljigan komponent
kuzatish mumkin. Ko’rsatilgan hodisa nazariy jihatdan Mandelshtam va Brillyuen
tomonidan aytilgan, Gross tomonidan esa eksprementda qayt qilingan.
(7), (8) va (8`) fo/rmulalar sochilgan nur chastotasining siljishini yuguruvchi
gipertovush (Debay) to’lqinlarida Doppler effekti natijasi sifatida tushinishga
imkon beradi. Agar sochilish to’lqin tarqalish yo’nalishida yuz bersa, u holda
sochilgan yorug’lik chastotasi ortadi, va aksincha. Bu nazariy xulosani tajriba
tasdiqlaydi.
Moddaga tushuvchi yorug’lik kvanti 9 elektronni virtual W’ sathga
uyg’ongan holni ko’raylik (1-rasm), biroq bunda 10 aksincha o’tish ν=1
tebranuvchan qo’shimcha sathda (va shu strukturaning biror aylanish qo’shimcha
sathida) yuz beradi. Bunday holda sochilgan yorug’lik ham boshqa chastotaga ega
bo’ladi, biz ko’rayotgan konkret holda sochilgan yorug’lik
hν '= hν −hν 0i (9)
tenglamaga muvofiq kamaygan chastotaga ega bo’ladi, bunda v- tushayotgan
yorug’lik chastotasi; v’ –sochilgan yorug’lik chastotasi; v
0i – tebranuvchi chastota.
Boshqa hol, ya’ni yuqoriga 11- vertual W’’ sathga o’tish v =0 asosiy tebranish
holatidan emas, balki
υ=1 uyg’ongan holatdan sodir bo’lish holi ham bo’lish
mumkin, pastga o’tish 12 esa v =0 bo’lgan pastgi tebranuvchan qo’shimcha sathida
sodir bo’ladi. U holda sochilgan yorug’lik chastotasi
hv ''= hv +hv 0i (10)
tenglamaga muvofiq ortadi [1-2].
Debay gipertovush to’lqini bilan o’zaro ta’sirlashuvda bo’lgan sochilishidan
farqli o’laroq bunda kogerent bo’lmagan sochilish yuz beradi, chunki ayrim
11](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_11.png)



![0Qizil yo’ldoshlar
(Stokss chiziqlar) Binafsha yo’ldoshlar
(Antistokss chiziqlar)
1-rasm1.2 Yorug’likning kombinatsion sochilishi va uning tebranish
spektrlarida namoyon bo’lishi
Yorug’likning molekulyar sochilishida tushuvchi nurning to’lqin uzunligiga
sochilgan yorug’likning to’lqin uzunligi bilan mos tushadi. Lekin 1928 yilda rus
olimlari L.I. Mandelshtam, T.S. Landsberg va hind olimi Ch.V. Raman
ko’rsatdilarki [ 1 , 6 ], yorug’lik sochilishining shunday turi mavjudki, sochilgan
yorug’lik spektrida tushuvchi monoxromatik to’lqinni xarakterlovchi spektral
chiziqlardan tashqari har bir monoxromatik spektral chiziqning ikkala tomonida
joylashadigan qo’shimcha spektral chiziqlar ham hosil bo’ladi. Faraz qilaylik
suyuqlikka tushuvchi nurning chastotasi 0
bo’lsin (1-rasm) .
Qo’shimcha hosil bo’lgan yo’ldoshlar chastotasini 1
11
111
bilan
belgilaymiz. Tushuvchi nur chastotasi bilan har bir yo’ldosh chastotasi o’rtasidagi
farq yorug’lik sochuvchi modda uchun xarakterli bo’lib bu farq ana shu modda
molekulalarining xususiy xususiy tebranishlar chastotasiga tengdir. Δν 1= ν0− ν'= ± ν1i
15](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_15.png)
![Δν 2= ν0− ν''= ± ν2i } (1.1)
Δν 3= ν0− ν'''= ± ν3i
Tajriba ko’rsatdiki, bushartlar hamma vaqt ham bajarilmaydi. Kombinatsion
sochilishda kuzatiladigan yo’ldosh infraqizil nurlanishda yoki infraqizil yutilish
sohasida hamma vaqt hosil bo’lmaydi. Bunga sabab bu kombinatsion sochilish
spektrini hosil bo’lishi uchun modda molekulasining qutblanuvchanligi
o’zgarishi kerak. Infraqizil yutilish spektrlar hosil bo’lishi uchun modda
molekulasining dipol momenti o’zgarishi kerak. Shuning uchun ham infraqizil
yutilish spektrida hosil bo’ladigan ba’zi chiziqlar kombinatsion sochilish spektrida
kuzatilmaydi va aksincha [ 4,5 ].
Yorug‘likni kombinatsion sochilishining mumtoz nazariyasi.
Kombinatsion sochilish hodisasi klassik nazariya nuqtai nazaridan
quyidagicha tushuntiriladi. Ushbu hodisada yo‘ldoshlarning paydo bo‘lish
sabablari yorug‘lik to‘lqinini sochuvchi muhit molekulasi atomlarining past
chastotali tebranishlari bilan modulyatsiyalanishi orqali tushuntirish mumkin.
Molekulaning qutublanishi, umuman qaraganda uni tashkil qilgan atomlarning
joylashishiga bog‘liq. Atomlar tebranganda qutublanish
0 - o‘rtacha qiymat
atrofida shu tebranadi, buni quyidagicha izohlash mumkin:
α (t)= α0+ F (t)
Ushbu tebranishlarning chastotasi 10 12
-10 13
gs bo‘lib, elektromagnit to‘lqin
shkalasining infraqizil spektri sohasiga to‘g‘ri keladi. Boshqacha aytganda,
kattalaikni o‘zgarishi tushayotgan yorug‘likning
(¿10 15 гц ) elektr maydonning
tebranishiga nisbatan sekinroq o‘zgaradi. Shu sababga ko‘ra ham tushayotgan
yorug‘lik to‘lqinining monoxromatik maydonida molekulaning dipol momentini
o‘zgarishi
p(t)= α⋅E = [α0+ F (t)]E 0cos ωt
16](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_16.png)
![qonun bo‘yicha ro‘y beradi, ya’ni ampilitudasi modulyatsiyalangan tebranishdan
iborat bo‘ladi. Bu yerda Е= Е0cos ωt -yorug‘lik to‘lqinining o‘zgaruchan elektr
maydoni, Е
0 yorug‘lik to‘lqini elektr maydoni kuchlanganligini amplitudasi,
ω= 2πv
- tushayotgan yorug‘likning burchak chastotasi, - molekulaning
qutblanuvchanligi, faqat uning tuzilishi va xossasiga bog‘liq bo‘lgan doimiy.
Bu jarayonda sochilgan yorug‘lik maydon kuchlanganligining tebranishi
ham modulyatsiyalanadi. Bu tebranishlarning eltuvchi chastotasi tushayotgan
yorug‘lik to‘lqinining chastotasi
ω ga teng, modulyatsiya esa ωi - chastotalarda
(sochuvchi modda molekulasidagi atomlarning tebranish chastotasi) yuz beradi.
Amplitudasi modulyatsiyalangan bunday tebranishlarning spektri
ω - chastotali
eltuvchi chastota bilan bir qatorda
ω± ωi , chastotaga ega bo‘lgan kombinatsion
tebranishlar hosil bo‘ladi. Boshqa so‘z bilan aytganda sochilgan yorug‘likning
spektri shu molekula haqida axborot beradi. Bu spektrni o‘rganish va tahlil etish
orqali molekula strukturasi va tuzilishini bilishga muaffaq bo‘lamiz.
Klassik elektrodinamika qonuniga binoan,
ω= 2πv chastotada
tebranayotgan dipol intensivligi
Iv= 16 π4v4
3c2 α2E 0
2
ga teng bo‘lgan monoxromatik nur chiqaradi.
α≠ сonst
hol uchun, ya’ni sochuvchi muhit molekulasining
qutblanuvchanligi o‘zgaruvchan bo‘lsa u holda molekulaning dipol momenti ham
vaqt bo‘yicha o‘zgaradi. Umuman, molekula qutblanuvchanligi yadro tebranishini
dipol tebranishlarida ishtirok etishi sababi bilan ham o‘zgarib turishi kerak.
Elektronlar bilan yadroni o‘zaro bog‘langanligi sababli majburiy
ν chastotada
tebranayotgan elektronlar yadroning ham tebranishini yuzaga keltiradi. Biroq
yadroning massasi elektronning massasiga nisbatan nihoyatda katta (1836 marta)
bo‘lgani uchun yadroning tebranishi juda ham kuchsiz bo‘ladi. Bu esa
molekulaning qutblanishini o‘zgarishiga olib keladi. Natijada sochilgan yorug‘likni
chastotasi o‘zgaradi va siljish nokogirent bo‘lib qoladi [4].
17](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_17.png)

![natijasida fotonlar uchish yo‘nalishini o‘zgartiradi, ya’ni chetga sochiladi. Fotonlar
bilan molekulalar o‘rtasidagi to‘qnashishlar elastik bo‘lishi ham, no elastik
bo‘lmasligi ham mum/kin. To‘qnashish elastik to‘qnashish bo‘lgan holda
molekulaning energiyasi va fotonning 0v chastotasi o‘zgarmaydi, bu hol Reley
sochilishiga mos keladi (3-rasm). Releycha sochilish paytida sochilgan yorug‘lik
kvantlarining chastotasi muhitga tushayotgan yorug‘lik kvantlarining
chastotalariga mos keladi. Shuning uchun ham Releycha sochilishga elastik
sochilish ham deyiladi [4-5].
To‘qnashish elastik bo‘lmagan holda fotonning energiyasi
i hv tebranma
kvant miqdorida ortadi yoki kamayadi. Agar yorug‘lik tebranish holatida
bo‘lmagan molekula bilan o‘zaro ta’sir qilishsa, yorug‘lik molekulaga
energiyasining tegishli qismini berib,
hv '=hv 0−hv i
yoki =
0 -
и tenglamaga
muofiq ravishda kichik chastotali nurga (qizil yo‘ldosh, Stoks chizig‘iga) aylanadi,
bu yerda
0v
uyg‘otuvchi yorug‘lik chastotasi, iv molekula tebranishlarining
chastotasi.
Agar yorug‘lik tebranish holatida turgan molekulaga, ya’ni
i hv -
energiyaga ega bo‘lgan molekulaga ta’sir qilsa, u holda yorug‘lik molekuladan bu
energiyani tortib olib,
i hv hv hv 0 ' yoki iv v v 0 ' tenglamaga muvofiq
ravishda katta chastotali nurga (Binafsha yo‘ldosh, antistoks chizig‘iga) aylanadi.
Buni 3-rasmdan osongina tushinish mumkin. Yuqorida aytilganlardan kelib chiqib
kombinatsion sochilishga quydagicha ta’rif berish mumkin: Sochilgan
yorug‘likning chastotasi tushayotgan yorug‘likning chastotasi
v0 bilan
molekulalar ichida bo‘ladigan tebranishlar chastotasining
vi
kombinatsiyasidan tarkib topadi . Shuning uchun bu sochilish kombinatsion
sochilish deb ataladi. Tebranish holatida bo‘lgan molekulalar soni uyg‘otilmagan
molekulalar sonidan ancha kam bo‘ladi, shuning uchun binafsha yo‘ldoshning
intensivligi qizil yo‘ldosh intensivligidan beqiyos darajada kam bo‘lishi kerak;
19](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_19.png)




![+ -
- + + - + -
- + - + Ma’lumki, elektroneytral molekulalar bir-biriga yaqin kelganda o’zaro
tortishadi. Demak, molekulalarning bir-biriga tortib turadigan molekulalararo kuch
mavjud ekan, bu kuchlar ta’sirida gazlar suyuqlikka aylanadi. Molekulalar bir-
biriga tortilib mustahkam kristall hosil qiladi. Molekulalararo kuch Van-der-Vaals
tenglamasidan olingan a/V 2
=F
. Shu sababdan molekulalararo kuch Van-der-Vaals
kuchi deb ataladi. Uzoq vaqtgacha Van-der-Vaals kuchining tabiati ma’lum
bo’lmagan, hozirgi vaqtda esa bu kuchning tabiati ancha oydinlashtirildi. Bu kuch
ham atomlararo kuch singari elektr tabiatiga ega ekanligi aniqlandi.
Molekulalararo kuch asosan 3 xil kuchdan iborat [6] :
1. orienta t sion
2. induksion
3. dispersion
Orienta t sion kuch . Bu kuch qutblangan molekulalar orasida vujudga keladi.
Qutblangan molekulalar bir-biriga nisbatan ma’lum tartib bilan joylashadi.
Ularning qarama-qarshi ishoralari qutblari bir-biriga yaqinlashgan vaziyatda
o’rnashadi.
1-rasm
Natijada qarama-qarshi ishorali qutblar elektrostatik kuch (Kulon kuchi)
bilan bir-biriga tortiladi. Dipol orasidagi
bunday kuch oriyenta t sion kuch deb ataladi. Kizomi Van - der - Vaals kuchi
oriyenta t sion kuchdan iborat deb faraz qilgan edi. Shu sababdan bu kuch Kizomi
kuchi deb ham ataladi. Oriyenta t sion kuchning energiyasi
24](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_24.png)
![U or=−2
3
μ 1
2
μ 2
2
kT r
6 (1)
Bu yerda μ
1 , μ
2 bir-biriga ta’sir etayotgan molekulalarning tug’ma dipol
momenti.
k -Bolsman konstantasi.
r - molekulalar orasidagi masofa.
T- absalyut temperatura.
Issiqlik ta’siridagi harakat qutblangan molekulalarning tartibli joylashishiga
to’sqinlik qilganligidan orientatsion kuch temperaturaga teskari proporsional
bo’ladi. Tenglama oldidagi (-) ishorasi ta’sir energiyasi tortishish energiyasi
ekanligini ko’rsatadi [7] .
Induksion kuch. Bu kuchni Debay kashf etgan. Bir-biriga yaqin kelgan
molekulalarning biri qutblangan, biri qutblanmagan ( tug’ma dipoli bo’lmagan)
molekula deb faraz qilaylik. Bu vaqt tug’ma dipolsiz molekula tug’ma dipolli
molekula ta’sirida qutblanadi. Natijada ikkinchi molekulada induksion dipol
vujudga keladi. Shunday qilib , bu molekulalar bir-birini tortadi. Bu tortishish
kuchini induksion kuch deb ataladi. Uning energiyasi qutbli molekulaning tug’ma
dipoli μ ga va tug’ma dipoli bo’lmagan molekulaning qutblanuvchanligi α ga
proporsional bo’ladi:
U ind=−αμ
2
r
6
(2)
Despersion kuch . Tug’ma dipoli bo’lmagan molekulalar ham bir-biri bilan
tortishadi. Aks holda ular suyuqlikka aylanmasligi kerak edi. Bunday molekulalar
orasida orientatsion va induksion tortishish kuchlari bo’lishi mumkin emas.
25](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_25.png)
![Dispersion kuchning tabiati sxematik ravishda quyidagicha tushuntiriladi. Bu
kuchning vujudga kelishiga asosiy sabab, elektronlar yadro atrofida ayrim
vaqtlarda (bir onda) notekis taqsimlanishidir. Misol uchun vodorod atomini olsak,
uning yagona elektroni yadroning goh bir tomonida, goh ikkinchi tomonida
bo’lishi mumkin. Shuning uchun vodorod atomining bir onli dipol momenti nolga
teng bo’lmaydi. Agar argon atomini olsak, uning yadrosi atrofida 18 ta elektron
aylanib yuradi. Biror paytda bu elektronlarning yarmi yadroning bir tomonida,
yarmisi ikkinchi tomonda aylanib yurishi ehtimoldan uzoq. Shuning uchun
argonning bir onli dipol momenti nolga teng bo’lishi mumkin emas. Shunday qilib
argon dipol momentining qiymati va yo’nalishi har onda turlicha bo’ladi. Lekin
elektronlar uzoq vaqt mobaynida yadroning turli tomonlarida guruhlanishi
ehtimolligi o’zaro tengdir. Shunga ko’ra argonning dipol momenti nolga teng
deyiladi. Tajribada ana shu o’rtacha dipol o’lchanadi. [8]
Atom yoki molekulalarda ma’lum vaqtda vujudga keladigan dipol moment
fluktua t sion dipol moment deyiladi. Yuqorida keltirilgan misolda argonning
ma’lum vaqtda hosil bo’ladigan, ya’ni fluktuatsion dipoli atom atrofida elektr
maydonini vujudga keltiradi. Bu maydon qo`shni atomga ta’sir etib, uning
zaryadini siljitadi va natijada argon bilan bu atom orasida tortishish sodir bo`ladi.
Bu hodisani sababini quyidagicha tushuntirish to’g’riroq bo’ladi. Ta’sir qiluvchi
atom yoki molekulani garmonik ossillyator deb qarash mumkin. Bu holda atom
yoki molekuladagi elektronlarning muvozanat holati chegarasida garmonik
tebranayotgan zarrachalar deb qarash mumkin. Elektronlar bunday tebranib
turganligidan atomning har daqiqada (o’rtacha dipol momenti nolga teng bo’lsa
ham) dipol momenti nolga teng bo’lmaydi. Shuning uchun ossillyatorlar (atom
yoki molekulalar) bir-biriga tortiladi. Bunday tortishish kuchini dispersion kuch
deb ataladi. Bu kuchni kvant mexanikasi tasavvuri yordamida London kashf etgan
va quyidagi tenglama bilan hisoblab chiqargan.U dis=−3
2
I1I2
I1+I2
α 1α 2
r
6
(3)
26](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_26.png)
![Bu yerda I
1 I
2 - birinchi va ikkinchi atomning ionlanish potensiallari.I=2 E 0=hν 0
(4)
E 0
-nolinchi tebranish energiyasi (T = 0)
ν
o -nolinchi tebranish energiyasiga to’g’ri kelgan tebranish takroriyligi.
Ikkita bir xil atomdan iborat molekula uchun
U dis=−3
4
Iα
2
r
6
(5)
Shunday q ilib, tug’ma dipoli bor molekula bilan tug’ma dipoli bo’lmagan
molekula orasidagi tortishish kuchi orienta t sion, induksion, dispersion kuchlar
yig’indisiga teng:
U=U or+U ind U dis=− 1
r
6[2
3
μ 1
2
μ 2
2
kT +αμ
2
+3
4Iα
2
]
(6)
Demak, molekulalararo kuch molekulalar orasidagi masofaning 6-darajasiga
teskari proporsional ravishda kamayadi. Molekulalararo kuch kimyoviy kuchga
nisbatan anchagina kichik bo’lib, odatda bir necha kkal/mol atrofida bo’ladi.[9]
Bir-biriga ta’sir etuvchi molekulalar o’zaro juda yaqinlashganda ular orasida
itarishish kuchi paydo bo’ladi. Umuman yuqoridagi 3 xil asosiy kuchdan boshqa
kuchlar ham bor. Molekulalar o’rtasidagi itarishish energiyasi
U it taxminan
U it= m
r
12
(7) ga teng.
m - itarishish konstantasi bo’lib, musbat qiymatli miqdor.
27](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_27.png)
![Bu tenglamadan ko’rinib turibdiki, bu energiya masofaning 12-darajasi bilan
o’zgaradi, ya’ni bu energiya juda kichik masofadagina mavjud bo’ladi, masofa
kattalashishi bilan katta tezlikda kamayadi.
Molekulalar orasidagi ta’sir kuchi tortishish va itarishish kuchlari
yig’indisiga teng:
U=U tort +U it=− n
r
6+ m
r
12 (8)
Bu Lennard-Djonson tenglamasidir.
1.4-§. H-bog’lanishli komplekslarning elektro-optik parametrlarni kvanta-
ximik hisoblashlar orqali o’rganish
1970-1980 yillarda kvanto-kimyosida hisoblash usullari juda tez suratlar
bilan rivojlandi. Natijada geometrik strukturalarni, energiyalarni, dipol momentlar,
o’tishlar orasidagi va tebranishlar chastotalarini hisoblash imkoniyatlari paydo
bo’ldi.Tajriba yo’li bilan olish mumkin bo’lmagan natijalarni ham kvanto-
ximiyaviy hisoblash yo’li bilan aniqlash imkonini beradigan va juda tez
ishlaydigan kompyuterlar paydo bo’lishi bilan bu sohaga yanada qiziqish
ko’chaydi. Kvanto-kimyoviy hisoblash usullari takomillashtirilib, bugungi kunda
murakkab sistemalarning tuzilish mexanizmlari to’g’risida ma’lumot olish uchun
bu usullardan keng foydalanib kelinmoqda [12].
Kvanto- kimyoviy hisoblashlar natijasida tajribalarda spektrlarini tekshirish
orqali turlicha agregatlarning molekulyar xarakteristikalari aniqlash imkoniyatlari
paydo bo’ldi, bundan tashqari agregatlangan bog’lanishlarda molekulalarning
fazoviy tuzilishi va orientasiyasi aniqlash imkonini beradigan usullar yaratildi.
Shunday qilib, molekulalararo komplekslar modelida tajriba natijalar nazariy
hisoblashlar orqali tushuntirish bugungi kunda gaz va suyuq holatlar fizikasining
eng dolzab vazifalaridan biri bo’lib qoldi.
28](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_28.png)
![S uyuq muhitlarda, tanlab olingan obyektlar uchun, vodorod bog’lanish va
Van-der-vaals molekulalararo o’zaro ta’sirlar orqali hosil bo’ladigan molekulyar
agregatlarni o’rganishda yangi eksperimental tadqiqotlar va kvanto- kimyoviy
hisoblashlar o’tkazish yo’li bilan ularning “spektr tuzilishi va xossalari” orasidagi
bog’lanishlarni o’rnatish hamda molekulalararo o’zaro ta’sirlarni, molekulalar
agregatlanishini va ularni o’rab turgan muhitning molekulaning spektral
parametrlariga ta’sirini o’rganish juda katta amaliy ahamiyatga ega [10-11].
Amaliy masalalarni kvant- kimyoviy hisoblashlar o’tkazish orqali hal qilish
jarayonida quyidagi masalalarga e’tibor qaratish talab ksiloladi:
Tayyor dasturlar asosida o’tkaziladigan kvanto- kimyoviy hisoblashlar
usulini tanlab olish.
Molekulaning termodinamik va spektroskopik parametrlarini aniqlaydigan
zamaonaviy kvato- kimyoviy hisoblashlarning aniqlik darajasi.
Molekular tuzilishi o’rganishda va amaliyotda kvano- kimyoviy hisoblashlar
natijalaridan foydalanish darajasi.
Spektroskopik usullar bilan kvanto-kimyoviy hisoblashlar bir-birini
to`ldirgan holda o`rganilayotgan obyekt to’g’risida to`liq ma’lumot olish
imkoniyatini yaratadi.
Umumiy qilib aytganda, kvanto-kimyoviy hisoblashlar taklif qilingan
modelning o’lchangan natijalar bilan o`xshashligini ta’minlash uchun molekulyar
sistemalarda ma’lum bir yaqinlashishlar oarqali Shredinger tenglamasining
yechimini topish jarayoni deb qarash mumkin. Tajriba orqali olish mumkin
bo’lmagan, murakkab molekulyar tuzilmalarning va effektlarning xossalarini
hisoblash uchun ko’pincha noempirik hisoblashlar – «ab initio» (lotinchadan
«Boshlang’ich») qo’llaniladi. Noempirik hisoblashlar asosiy usullari Xartri –Fok –
Rutan sxemasiga asoslanadi. Xartri –Fok –Rutan sxemasidagi murrakabliklarni
kamaytirish uchun juda ko’pchilik holatlarda elektron korrelyasiya inobatga olinsa,
kvanto-kimyoviy hisoblashlarning yarimemprik usullarda esa molekulalararo
o’zaro ta’sir inobatga olinadi [14].
29](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_29.png)

![energiya. Bu tenglamaning yechimi, biror ehtimollik bilan mikroobyektning
berilgan fazoning nuqtasida bo`lishi va uning energiyasi haqida muloxaza yuritish
imkonini beradi.
ELEKTRON KORRELYASIYA - atom yoki molekulyar sitemalarda barcha
elektronlarning harakatini o’zaro bir butunligini xarakterlovchi kattalik.
Korrelyasiya esa o’z navbatida elektronlarning o’zaro elektrostatik itarishishi
(Kulonovskaya korrelyasiya) va sistemaning statik afzalliklari (pauli prinsipi)
orqali aniqlanadi.
Kvanto- kimyoviy hisoblashlarni o’tkazish vaqtida juda katta integrallarni
yechishga to’g’ri keladi, buni mazmuni shundan iboratki hisoblashlar sikllik
ravishda o’tkaziladi, ya’ni kompyuter ta’minlashi mumkin bo’lgan chegaraviy
aniqlikga ega bo’linmaguncha jarayon takrorlanaveradi [12, 13].
Noempirik hisoblash usullarining eng oddiy usuli – Xartri-Fok usuli, bu
usulda elektronlar orasidagi korrelyasion itarishish kuchlari inobatga olinmaydi,
faqatgina ularning ta’sirlashishining o’rtacha qiymati hisobga olinadi.
31](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_31.png)
![II-BOB . AMALIY QISM
2.1§. Tajriba qurilmasi va uning tavsifi
DFS-52 spektrometri lazer manbai yordamida yoritilgan suyuq, kristal va
polikristal moddalarda kombinatsion sochilish konturini olish va qayd qilish uchun
muljallangan. Shuningdek bu spektrometr molekulyar - spektraskopiya oblastida
fizika kimyoviy tekshirishlar, ya'ni suyuqliklar suv aralashmalari, kristallar,
plyonkalar tarkibi tuzulishini o'rganishga muljallangan [15].
Ishlash prinsipi. Tekshirilgan namunani monoxromatik yorug'lik bilan
nurlantirganda sochilgan yorug'likning spektrida kombinatsion sochilish chiziqlari
kuzatiladi. Bu chiziqlarning chastotasi namunaga tekshirilayotgan nur chastotasi
bilan molekulaning xususiy chastotasining kombinasiyasidan iborat bo'ladi.
Kombinatsion sochilish chizig`ining intensivligi kichik bo’lib, ularni qayd qilish
uchun yorug'likni kam sochuvchi monoxromatlardan foydalaniladi. Shuningdek
shovqin kam yetarlicha stabil bo'lgan, qayd qilishning sezgir chastotalaridan
foydalanish zarur. DFS-52 spektrometrining uyg'otuvchi manba sifatida seriyali
lazerlar ishlatiladi. Yorug'likni tekshirish uchun yorug'likni kam sochuvchi
difraksion panjarali qo`shaloq monoxromatorlardan foydalaniladi. Spektrni qayd
qilish sovitilib turiladigan fotoelektron ko`paytirgichlar yordamida amalga
oshiriladi. Hisoblash qurilmasi spektrlarning ketma-ketligi va spektral
diapozonning berilgan qismiga signallarning ketma-ket qayd qilinishi, olingan
32](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_32.png)
![natijalarning matematik qayta ishlashni va natijalarni qayd qiluvchi asbobga
chiqarishni ta'minlaydi.
DFS-52 spektrometrining tarkibi. Spektrometrning tarkibiga
almashtiriladigan difraksion panjarali qo`shaloq monoxramator, qabul qiluvchi
blok, yoritish qurilmasi, chastotalar va hisoblash qurilmasiga ega bo'lgan elektron
qayd qiluvchi qurilma ERU-53, termoelektron sovutgichning blok pitaniyasi,
alfavit raqamli displey va yozuvchi qurulma, programmani tayyorlash sistemasi
IPG-003 ga kiruvchilar, laboratoriya o'zi yozuvchi asbobi LKS-003 , ulash
kabellari va o'tkazgichlar komplekti, almashtirish va ehtiyot qismlari kiradi.[6]
Optik sxemasi . Spektrometrning optik sxemasi yoritish sistemasi, qo`shaloq
monoxramator va qabul qiluvchi qurilma elementlaridan iborat. Yoritish sistemasi
lazer nurining tekshirilayotgan namuna tekisligiga fokuslanishini ta'minlaydi.
Namunadan sochilgan nurlanishni yig'adi va uni qo`shaloq monoxromatorning
kirish tirqishiga yo'naltiradi. Qo`shaloq ko'zguli monoxromator almashtiruvchi
difraksion panjaraga ega bo'lib u uyg'otuvchidan 20 sm masofada 8-25 sm/mm
gacha teskari chiziqli dispersiyani ta'minlaydi. Qabul qilish blogining qayd qilish
maydonida monoxromator qorachig'ining tasvirini beradi. Qabul qilish bloki
taqqoslash kanalining oldiga o'rnatilgan yorug'lik o'tkazgich unga lazer
nurlanishining bir qismini uyg'otadi. DFS-52 spektrometrning optik sxemasi 3-
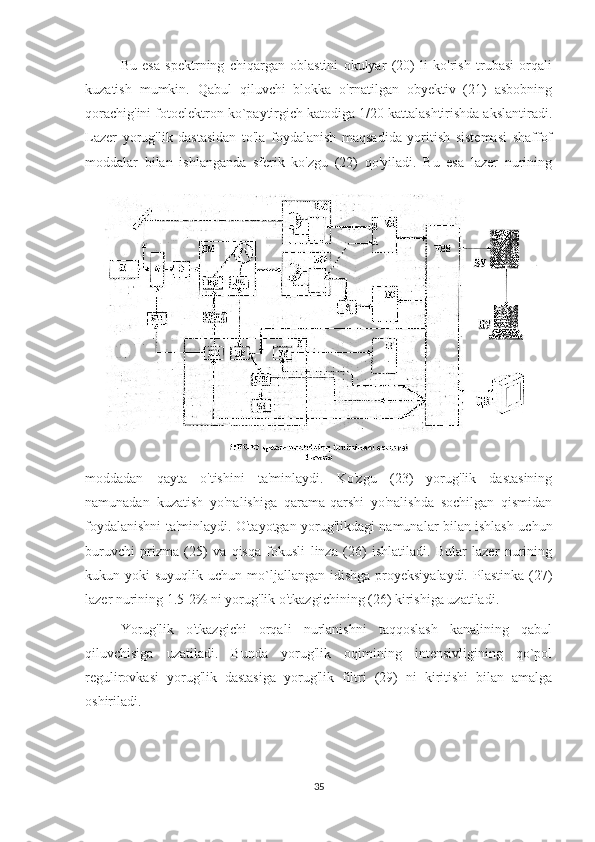
rasmda keltirilgan.
Yorug'lik manbaidan lazerning parallel nurlar dastasi (1) tor yo'lli
interferension yorug'lik filtridan, (2) krisovaya difrakmasidan, (3) qutublovchi
plastinkadan, (4) almashtiruvchi obyeklaridan biri orqali namuna (5) tekislikka
fokuslanadi. Namunadan sochilgan nurlanish sferik linza (6) lardan biri orqali
proyeksiyalovchi sistemada to'planadi va parallel dasta bo'lib obyektiv (7) dan
iborat proyeksiyalovchi sistema namunaning tasvirini qo`shaloq
monoxromatorning kirish tirqishi oldidan 2,3 yoki 3,5 marta kattalashtirib beradi.
33](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_33.png)

![2.2§. Tajriba natijalari va kvant o - kimyoviy hisoblashlar ni baholash
Noempirik hisoblashlar taklif qilingan modelning o’lchangan natijalar bilan
adekvatligini ta’minlash uchun molekulyar sistemalarda ma’lum bir
yaqinlashishlar oarqali Shredinger tenglamasining yechimini topish jarayoni deb
qarash mumkin. Tajriba orqali olish mumkin bo’lmagan, murakkab molekulyar
tuzilmalarning va effektlarning xossalarini hisoblash uchun ko’pincha noempirik
hisoblashlar – «ab initio» (lotinchadan «Boshlang’ich») qo’llaniladi.
Bugungi kunda amaliyotda noempirik hisoblashlar uchun zamonaviy
Gaussian dasturlarini qo’llab yuqori darajadagi aniqlikga erishish mumkin.
Gaussian ( gaussian ) – molekulyar modellashtirishning turli-tuman usullarini
o’zida mujassamlashtirgan molekulyar sistemalarning tuzilishi va xossalarini
hisoblashga qaratilgan kompyuter dasturi [28]. Bu dastur nobel mukofoti laureati
Djon Poplo va uning tadqiqot guruhi tomonidan yaratilgan bo’lib, bugungi kunda
ham yangilanib kelinmoqda. Dasturning Gaussian-2003 (G03) versiyasi Gaussian-
98 (G98) versiyasidan farq qiladi. Dasturning foydalanishdan eng so’nggisi
Gaussian-09 hisoblanadi.
Kvant mexanikasining fundamental qonunlariga asoslangan holda Gaussian
molekulyar sistemaning gaz va kompleks holatlarida ham assosiy, ham uyg’ongan
holatlarida energiyasi, molekulyar tuzilishi va tebranish chastotlari, hamda bir
qator molekula xossalari to’g’risida ma’lumot beradi. Bu dastur molekulani
o’rganishda bir qancha sharoitlarni, qisqa vaqt yashovchi birikmalar va o’tuvchi
tuzilmalarni, tajribalarda kuzatish mumkin bo’lmagan holatlarni hisobga olishi
bilan bugungi kunda noempirik hisoblashlarda eng ko’p qo’llanilayotgan dastur
hisoblanadi. Bundan tashqari, dastur foydalanuvchi uchun ham qulay interfeysga
va yuqori samaradorlikka egaligi bilan farq qiladi [28-29]
G98 i G03 dasturiy majmuaning asosiy imkoniyatlari quyidagilardan iborat:
Tadqiq qilinayotgan sistemaning molekulyar mexinika usullari,
yarimempirik yaqinlashishlar, chegaralangan va chegralanmagan Xartri –
Fok usuli yoradamida tuzilishini optimizasiya qilish va energiyasini
hisoblash;
36](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_36.png)
![ Korrelyatsion energiyani hisobga olish imkoniyatiga ega bo’lib, analitik
gradiyentlar yordamida g’alayonlanish nazariyasi, bog’langan klasterlar,
konfigurasion o’z’aro ta’sir va boshqalar uchun energiyani hisoblash;
Yuqori molekulyar sistemalarni modellashtirish;
Kuch doimiylarini RHF, UHF, DFT, RMP2, UMP2 va CASSCF usullar
yordamida analitik hisoblash;
Molekulaning spektral xoss a larini hisoblash;
Tadqiq qilinayotgan sistema uchun eritmaning ta’sirini hisobga olish
imkoniyati va hakozo.
Gaussian dasturiy majmuasining kamchiligi sifatida hisoblash vaqtining
kattaligi va hisoblash apparatlariga bo’lgan talabning yuqoriligini keltirish
mumkin.
Hisoblashlar natijalari tadqiq qilinayotgan molekulalar (fazodagi yadrolar
joylashishi) tuzilishi, elektron zichligi, molekula va uning tashkil etuvchilarining
umumiy energiyasi va hakozolar to’g’risida juda keng sonli ma’lumotlar
to’plangan fayl ko’rnishida bo’ladi. Shuning uchun Gaussian dasturiy
majmuasining hisoblash natijalarini tahlil qilish o’rganish uchun maxsus dasturlar
qo’llaniladi [28].
To’lqin funksiyasi xususiy vektorlarning matrisasi ko’rinishida beriladi.
Bundan tashqari, o’rganilayotgan molekulalarning boshqa fizik-ximik
xarakteristikalari ham energiyaning har yadro koordinatalari bo’yicha n-tartibli
hosila orqali aniqlangan bo’lib, jadval va matrisalar ko’rinishida beriladi. Shuning
uchun ham hisoblashlar natijalarini tahlil qilish va ulardan foydlanish juda
murrakab jarayon bo’lib, juda qiyin masala hisoblanadi. Katta massiv
ko’rinishidagi natija fayllar bilan ishlash uchun maxsus interpretator-dasturlar
ishlatiladi [28-29]. Bu dasturlar natijalarni birinchi darajada tahlil qilish va
natijalarni uch o’lchamli fazoda grafik ko’rinishida olish imkonini beradi. Bundan
tashqari, keyingi hisoblashlar uchun kirish fayllarini tayyorlash mumkin.
Xuddi shunday dasturlardan eng ko’p ishlatiladiganlaridan biri GaussView –
dasturi imkoniyatlariga qisqacha to’xtalib o’tmoqchimiz. GaussView
37](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_37.png)

![3.1 Dimetilsulfoksid va uning eritmalarida kombinatsion sochilish
spektrlarini o’rganish
Ushbu magistrlik dissertatsiyasining asosiy maqsadi yuqorida aytib
o’tilgandek, dimetilsulfoksid va uning suvdagi eritmalarida sodir bo’ladigan
molekulalararo o’zaro ta’sir kuchlarini yorug’likning kombinatsion sochilish
spektrlari hamda kvanto-ximik nazariy hisoblashlar yordamida o’rganishdan
iborat. Bu maqsadga erishish uchun avtomatlashtirilgan difraksion panjarali
DFS-52 spektrometrida tajribalar olihgan hamda 6-31G++(d,p) funksiyalar
to’plami negizida nazariy hisoblashlar o’tkazilgan.
Biz ushbu ishda molekula xossalari va ular orasidagi o’zaro tasirlarni
o’rganish uchun dimetilsulfoksid molekulasini tanlab oldik. Dimetilsulfoksid
qutbli suyuqlik bo’lib, uning dipol momenti (μ =3.94 D) ga teng [ 35-36].
Suyuqliklarda molekulalarning xossalari va bog’lanishlari to’g’risida
yetarlicha ma’lumot beradigan spektroskopik usullardan biri kombinasion sochilish
spektlarini o’rganish usulidir. Ushbu ishda toza dimetilsulfoksidning va uning suv
bilan eritmalarida olib borilgan tajriba natijalarining tahlili va noemperik
kvantoximik hisoblashlar natijalari bilan taqqoslash bo’yicha ishlar keltirilgan [37].
Molekulalararo o’zaro ta’sir kuchlarini o’rganish maqsadida dimetilsulfoksid
molekulasining suyuq holatida kombinasion sochlish spektrlari yordamida
o’rgandik. Molekula tarkibiga kiruvchi S=O tebranish molekulalararo o’zaro
ta’sirga juda sezgir bo’lib, bu sezgirlik kombinasion sochlish spektrlariida yaqqol
namayon bo’ladi.
4-rasmda dimetlisulfoksid molekulasining S=O tebranish polosasiga tegishli
kombinasion sochilish chizig’ining parallel (1), perpendikulyar (2) tashkil
etuvchilari keltirilgan.
39](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_39.png)
![4-Rasm .DMSO S=O tebranish polosasi kombinasion
sochilish chizig’ining parallel ( I
( ) va perpendikulyar I
┴ (ν)
tashkil etuvchilari.
Dimetilsulfoksid molekulasining S=O tebranish polosasining ikkala tashkil
etuvchisi ham murakkab strukturaga ega bo’lib, parallel tashkil etuvchisini 3 ta
chiziqqa ajratish mumkin (1030 sm -1 ,
1042 sm -1
va 1055 sm -1
). Perpendikulyar
tashkil etuvchisida yuqori chastotada yotuvchi ikkala chiziqlarning intensivliklari
teng bo’lib, bu chiziqlarning ustma–ust tushishi natijasida polosani keng
ko’rinishga olib keladi. Past chastota tomonda yotuvch ikkala chiziqning
depolyarizasiya koeffisentlari taxminan bir biriga teng ( p =0.3). Yuqori chastota
tomonda yotuvchi chiziqning depolyarizasiya koeffisenti ancha katta (ρ≡0,42 ).
Adabiyotlardan ma’lumki, DMSO molekulasi yetarlicha katta dipol
momentiga ega
(μ=3,94 (D)) [35]. DMSO molekulasi katta dipol momentiga ega
40](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_40.png)
![5-Rasm .Dimetilsulfoksid S=О tebranish polosasi : ( 1) I()
vauningsuv bilan aralashmasi; 2)I() DMSOmiqdori-0.7 m.u; 3) I()
DMSОmiqdori-0.1 m.u. bo’lganligi cababli agregatlar hosil qilishi mumkin, shunday fikrlar aseton va
etilasetat molekulalari uchun ham aytilgan [38-39].
DMSO ning suvdagi aralashmasida esa S=O tebranishga tegishli bo‘lgan
chiziq bilan birgalikda agregatlarga tegishli yangi chiziq paydo bo‘ladi va bu
chiziqning maksimumi suvning mikdori oshishi bilan past chastota tomonga siljib,
DMSO ning miqdori 0.1 mol ulush bo‘lganda, S=O tebranishga tegishli bo‘lgan
chizikning intensivligi keskin kamayib agregatga tegishli bo‘lgan chizikning
intensivligi oshishi bilan birga polosaning siljishi 1010 sm -1
gacha boradi (rasm 5 ).
41](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_41.png)
![Bu yangi spektral chiziqning paydo bo‘lishini, DMSO+suv aralashmasida suvning
miqdori oshib borishi bilan DMSO molekulalari bilan suv molekulalari o‘rtasida
dipol-dipol ta’sir tufayli hosil bo‘lgan agregatlar orqali tushuntirish mumkin [37].
Dimetilsulfoksidning S=O tebranishiga tegishli bo’lgan bu spektral chiziq
murakkab bo’lib, u dimetilsulfoksid molekulasining o’zaro molekulalararo ta’sir
kuchlari tufayli hosil bo’lgan turli xil agregatlarga ya’ni, dimer, trimer
agregatlariga tegishli spektral chiziqlar yig’indisidan iborat ekanligidan dalolat
beradi. Har bir agregat holatga tegishli bo’lgan spektral chiziqlarning kengligi katta
bo’lganligi hamda bu spektral chiziqlar o’zaro yaqin joylashganligi tufayli ularni
alohida -alohida ko’ra olmaymiz.
3.2. §. Dimetilsulfoksidmolekulasining molekulyar komplekslarining elektro-
optikparametrlarini kvanto-ximik hisoblashlar orqali o’rganish
Keyingi yillarda bunday spektral chiziqlarning murakkabligini aniqlagan
holda molekulalararo ta’sir kuchlar tufayli hosil bo’ladigan turli xil agregatlarni
mavjudligini yaqqol ko’rsatadigan kvanto-ximik nazariy hisoblaydigan
programmalar paydo bo’ldi. Bunday kvanto-ximikhisoblashlarning ustunliklari
juda katta bo’lib, bunday nazariy hisoblashlar yordamida bevosita tajribada topish
mumkin bo’lmagan molekulada atomlarning joylashish geometriyasini, atomlar
orasidagi bog’ uzunliklarini, atomlarda zaryad taqsimotini, bog’lanish energiyasini,
dipol momentini va boshqa bir qancha fizik kattaliklarni aniqlash mumkin.
Bunday kattaliklarni topish esa o’z navbatida tajribada olingan natijalar bilan
o’zaro bir biriga taqqoslanib mukammal ya’ni aniq hulosa qilishga olib keladi.
Shuning uchun ham biz ushbu magistrlik dissertasiyasini bajarishda tajribada
olingan natijalarni aniq va to’lig’icha tushuntirish maqsadida 6-31++(d,p)
funksiyalar to’plami negizidakvanto-ximik hisoblashlar olib borildi. Dastlab biz
42](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_42.png)





![18 H 4.554004 3.932456 0.000000
19 H 3.934161 2.710011 1.767760 0.000000
20 H 3.845315 3.183920 1.767827 1.786081 0.000000
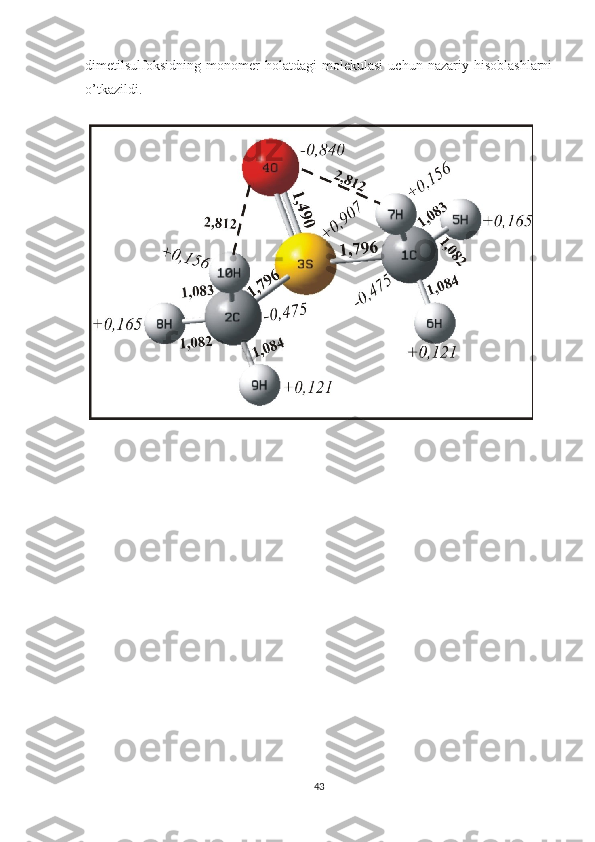
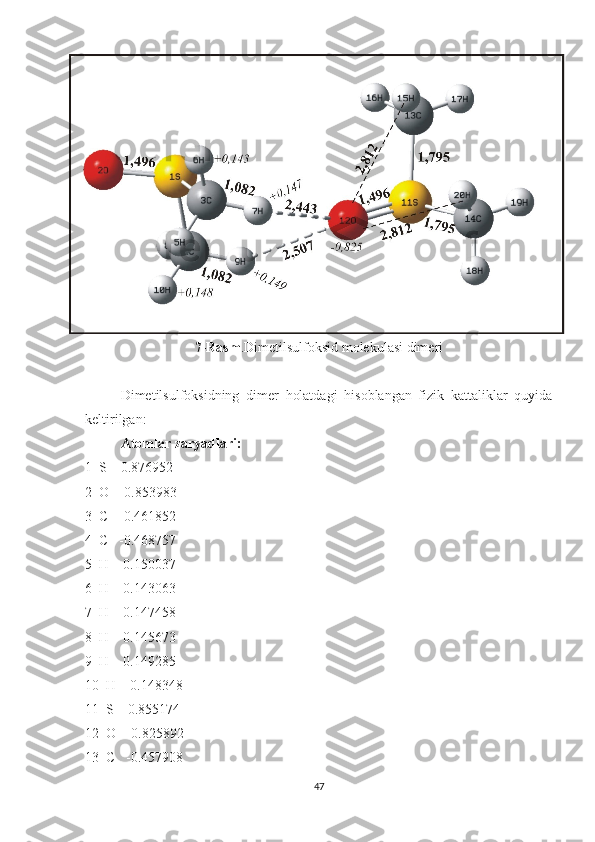
O’tkazilgan kvanto-himik nazariy hisoblashlar asosida shunday xulosaga
kelish mumkin. DMSO molekulasi turli xil agregatlar holatida (monomer, dimer,
trimer va x.k) bo’lar ekan. Bunday agregatlarning mavjudligi esa DMSO ning S=O
tebranishiga tegishli bo’lgan kombinatsion sochilish chizig’ini parallel va
perpendikulyar tashkil etuvchilarining maksimumlariga mos keluvchi
chastotalarining farq qilishiga olib kelishi bilan birgalikda DMSO ning S=O
tebranishiga tegishli spekral chiziqda assimmetriyaning hosil bo’lishiga olib
keladi, ya’ni bu spektral chiziq turli hil agregatlarga tegishli bo’lgan spektral
chiziqlar yig’indisidan iborat bo’lganligi tufayli assimmetriya hosil
bo’ladi.Monomer va dimer holatlarga tegishli spektral chiziqlar o’zaro yaqin
joylashganligi tufayli biz tajribada ularni alohida alohida ko’ra olmaymiz.
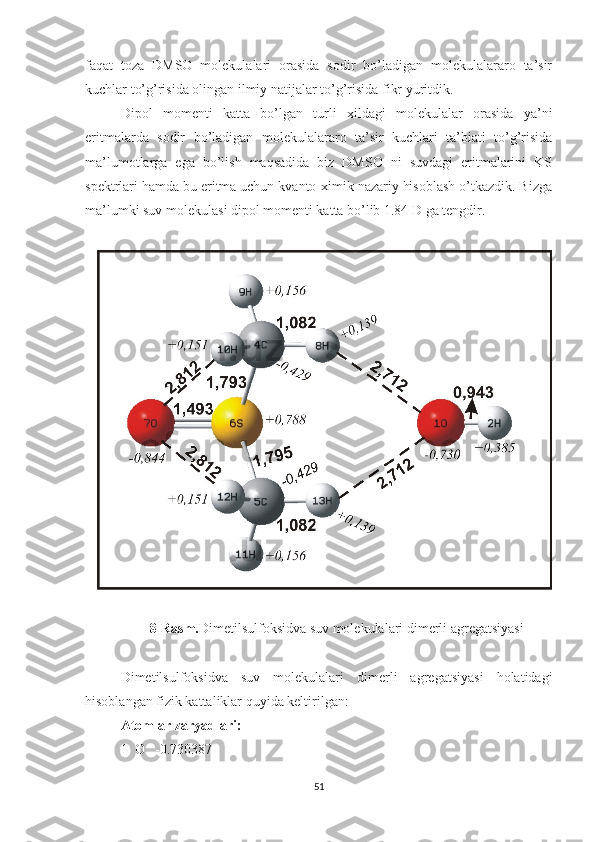
Shuni ta’kidlash lozimki, DMSO va uning eritmalarida sodir bo’ladigan
molekulalararo ta’sir kuchlarining tabiati to’g’risida ko’pgina ilmiy ishlar
bajarilgan[37,41]. Jumladan, akademik A.K.Otaxo’jayev nomidagi laboratoriya
xodimlari tomonidan ham 2000-yilning boshlarida [37] DMSO va uning eritmalari
yorug’likning kombinatsion sochilish spektrlari yordamida o’rganilgan va toza
DMSO molekulalari orasida hamda uning dipol momenti katta bo’lgan eritma
molekulalari birikib, hosil qilgan agregatlarni (dimer, trimer va hokazo) tabiatini
tushuntirishda faqatgina dipol-dipol ta’sir kuchlar orqali tushuntirilgan. Chunki biz
bilamizki DMSO molekulasi katta dipol momentiga ega bo’lib, uning dipol
momenti 4,3 D ni tashkil etadi.
Lekin keyingi yillarda laboratoriya xodimlari tomonidan hamda ushbu
magistrlik dissertatsiya ishini bajarish jarayonida olib borilgan kvanto-ximik
hisoblashlar natijalari shuni ko’rsatdiki, toza DMSO molekulalari agregatlarini
(dimer, trimer) hosil bo’lishida dipol-dipol ta’sir kuchlari bilan birgalikda
molekulalararo vodorod bog’lanishlar ham muhim rol o’ynar ekan. Biz yuqorida
50](/data/documents/22fb1452-1ba3-4b7d-876d-2e472c0dc47e/page_50.png)


Kvanto-ximik hisoblashlar orqali dimetilsulfoksid va uning eritmalarida molekulyar agregatsiyalarni o’rganish MUNDARIJA KIRISH ……………………………………………………………………. . 3 I-BOB . NAZARIY QISM ………………………………………………… 6 1.1.§. Suyuqliklarda yorug ‘ likning sochilishi ....………………..………… 6 1.2§ . Yorug ‘ likning kombinatsion sochilishi va uning tebranish spektrlarida namoyon bo’lishi………………………………………………. 16 1.3§. Molekulalararo ta ’ sir kuchlari ning tabiati …...................................... 24 1.4 §. H-bog’lanishli komplekslarning elektro-optik parametrlarni kvanto- ximik hisoblashlar orqali o ‘ rganish………………………………… 29 II-BOB . AMALIY QISM …………………………………………………. 31 2.1§. Tajriba qurilmasi va uning tavsifi……………………………………. 31 2.2§. Tajriba natijalari va kvant o -ximik hisoblashlar ni baholash ………… 37 III-BOB . OLINGAN NATIJALAR VA ULARNING TAHLILI 40 3.1§. Dimetilsulfoksid va uning eritmalarida kombinatsion sochilish spektrlarini o’rganish . ………………………… 3.2 §. Dimetilsulfoksidmolekulasining molekulyar komplekslarining elektro- optik parametrlarini kvanto-ximik hisoblashlar orqali o’rganish……… 43 40 XULOSA ………………….…… …….. …………… ………………… FOYDALANILGAN ADABIYOTLAR …………… ….. ………… 1
KIRISH Ishning dolzarbligi: Suyuqliklarning xossalari va tuzilishi ko’p yillardan buyon o’rganilib kelinmoqda. Hozirgi kunda suyuqliklar va eritmalarning fizik xossalarini o’rganishda turli usullardan foydalaniladi. Eng effektli usullardan biri yorug’likning kombinatsion sochilish (KS) usuli hisoblanadi. Keyingi o’n yil davomida olib borilgan ilmiy izlanishlar shuni ko’rsatdiki, KS spektrlari konturi- nig kengligi va formasidan ichki va molekulalararo o’zaro ta’sirlar haqida muhim ma’lumotlar olish mumkin . Hozirgi kunga qadar suyuqliklarda molekulalararo o’zaro ta’sirlarning tabiatini tushuntirish muammolari oxirigacha yechilmagan. Molekulalararo o’zaro ta’sirlarning tabiatini tushuntirib bera oladigan yagona nazariya mavjud emas. Bu muammolarni yechish orqali molekulyar fizika, molekulyar spektroskopiya, ximiya va ishlab chiqarishni rivojlantirish mumkin. Molekulalararo o ‘ zaro ta ‘ sir tabiatini o ‘ rganish zamonaviy molekulyar fizikaning asosiy muammo laridan biridir. Keyingi yillarda suyuqliklarda mo lekulalararo vodorod bog’lanish larning spektral namoyon bo’lishiga bag’ishlangan ko’p ilmiy izlanishlar olib borilmoqda. Dissertasiya ishi mavzusining bunday tanlanishi kondensirlangan muhitlar spektroskopiyasi va molekulyar fizikaning fundamental masalalarini, shuningdek, siqilgan gazlar va suyuqliklar strukturasi hamda tuzilishi bilan bog’liq masalalarni yechishga qaratilgan. Molekulalararo o’zaro ta’sirlar ichida molekulalararo vodorod bog’lanish muhim o’rin tutadi. Molekulalarning bu o’zaro ta’siri tirik organizmlar faoliyatida muhim ahamiyatga ega, shuningdek bu tadqiqotlar katta amaliy ahamiyatga ega bo’lib, suyultirilgan gazlar va suyuqliklarni ishlab chiqarishda samarali foydalanish mumkin. Molekulalararo o’zaro ta’sir molekulalararo vodorod bog’lanishda molekulalarning tebranma spektrida yaqqol namoyon bo’ladi. Bu esa muhitlar strukturasi va xossalari to’g’risidagi 2
ma’lumotlarni o’rganish imkonini beradi. Dissertasiya ishining vazifasi molekulalararo o’zaro ta’sir to’g’risida kombinatsion sochilish spektrlaridan foydalanib, qo’shimcha ma’lumotlar olishdan iborat. Bunda asosiy e’tibor kombinatsion sochilish spektrlarida molekulalararo vodorod bog’lanishning namoyon bo’lish xususiyatiga asoslangan holda molekulalararo vodorod bog’lanishni o’rganishga qaratilgan. Molekulalararo vodorod bog’lanish hosil bo’lishining spektroskopik namoyon bo’lishi hali to’lig’icha o’rganilmagan. Kombinatsion sochilish spektrlari va kvanto-kimyoviy hisoblashlar molekulyar agregatlar hosil bo’lish mexanizmlarini tushuntirishda mavjud bo’lgan muammolarni yechish uchun xizmat qiladi. Ishning maqsadi va vazifalari: dimetilsulfoksid (DMSO) va uning eritmalarida molekulalararo ta’sir kuchlarini o’rganish va olingan natijalarni kvanto-kimyoviy hisoblashlar orqali to’laroq tushuntirishdan iborat. Ushbu maqsadga erishish uchun q u yidagi vazifalar qo’yildi : Dimetilsulfoksidda molekulararo o’zaro ta’sirni o’rganish; dimetilsulfoksid molekulasida molekulyar agregatlar hosil bo’lishi uchun kvanto- kimyoviy hisoblashlar o’tkazish; dimetilsulfoksid molekulasida kombinatsion sochilish spektrlarini tahlil qilish va kvanto-ximik hisoblashlar orqali turlicha agregatlarning molekulyar xarakteristikalarini aniqlash; agregatlangan bog’lanishlarda molekulalarning fazoviy tuzilishi va oriyenta t siyasini aniqlash . Muammoning ishlab chiqilish darajasi: ilmiy maqolalar, konferensiyalarda ma’ruzalar va tezislar. Tadqiqotning ilmiy yangiligi : dimetilsulfoksid molekulasi S=O tebranish polosasi maksimumlari chastotalari mos tushmaslik hodisasi yangicha tahlil qilindi. Maksimumlari chastotalari mos kelmaslik hodisasi adabiyotlarda ko ‘ rsatilgan omillar bilan bir qatorda monomer va agregatlarga tegishli bir necha 3
bir-biriga yaqin turli depolyarizasiya koeffisientiga ega bo’lgan spektral chiziqlar tufayli yuzaga keladigan polosalarning murakkabligi bilan tushuntirildi . Tadqiqot predmeti: dimetilsulfoksid ning molekulyar strukturasi va molekulalararo o’zaro ta’sirlardan iborat. Tadqiqot obyekti : molekulalararo o’zaro ta’sirlarga juda sezgir bo’lgan dimetilsulfoksid molekulasi tanlandi. Erituvchlar sifatida molekulalararo o’zaro ta’sir energiyalarini hisobga olgan moddalar olingan.Tanlab olingan moddalar kyuvetaning materialiga ta’sir qilmaydi. Tadqiqot usuli: kombinatsion sochilish spektroskopiyasi va kvanto- kimyoviy hisoblashlar . Tadqiqot ishining ilmiy-amaliy ahamiyati: Dissertasiya mavzusi bo’yicha tadqiqotlar fundamental xarakterga ega, optika va molekulyar fizikaning muammoli masalalarini yechishga qaratilgan, ya’ni – moddaning suyuq holatida molekulalar agregatsiyasi masalalasini yechish, moddaning makroskopik xossalarini aniqlashda agregatsiyalar o’rnini aniqlash, molekulalararo vodorod bog’lanish muammolarini o’rganish uchun molekulyar spektroskopiya usullarini rivojlantirish. Bu tadqiqotlar va boshqa mualliflarning shunga o’xshash tadqiqotlari moddaning suyuq holati molekulyar nazariyasini rivojlantirishga imkoniyat yaratadi, bu o’z navbatida suyuq muhitlarni ishlab chiqarishdagi kamchiliklarni bartaraf etish uchun maqsadli ishlatishga olib keladi. Molekulyar agregatsiyalar va molekulalararo vodorod bog’lanishning tirik organizmlar hayoti va faoliyatidagi o’rnini hisobga olganda, bunday tadqiqotlar tirik organizmlar faoliyati jarayonida molekulyar agregatsiyalar molekulalararo va ichki molekulyar vodorod bog’lanish rolini chuqurroq tushunishiga olib keladi. Bu esa bu faoliyatga maqsadli ta’sir qilish imkoniyatiga olib keladi. Ishda dimetilsulfoksid molekulasining molekulyar strukturasi va molekulalararo o’zaro ta’sirlar to’g’risida yangi ma’lumotlar olindi. Ishning natijalari suyuqliklarning molekulyar nazariyasining rivojlanishiga hissa qo’shadi. Bundan tashqari talabalarga mutaxassislik fanlarini o’tishda foydalanish mumkin. 4
I-BOB . NAZARIY QISM 1.1 Suyuqliklarda yorug`likning sochilishi Yorug`lik sochilishining elementar kvant nazariyasi fotonlarning modda zarralari bilan to`qnashuvini va bunda foton bilan sochuvchi zarra o`rtasida impuls va energiya almashinuvini hisobga olgan holda tuzilishi mumkin.Modda yorug`likni sochganda yorug`lik to`lqini bir vaqtda moddaning ko ‘ plab zarralari bilan o`zaro ta’sirda bo`ladi, shuning uchun bunday o`zaro ta`sir xarakterini aniqlash uchun moddaning to`liq energiya spektirini bilish kerak.Umumiy holda modda molekulalarining energiyasi elektron, tebranish va aylanish energiyalarga ajiralishi mumkin bo`lgan energiyadir. Kondensiyalangan moddada fluktuatsiyalarda tebranishi ro`y beradigan molekulalarning o`zaro ta`sir energiyasini hisobga olish kerak bo`ladi. Fluktuatsiyalarning o`zini esa,kristal panjaralarining tebranishi,ya`ni elastik to`lqinlarning moddada tarqalishi sifatida qarash mumkin.Moddaning energiya spektridagi chastota sohalarida: 1) elastik to`lqinlarning Debay spektriga; 2) aylanish chastotalari spektriga; 3) tebranish chastotalari spektriga va 4) elektron spektriga tegishli sohalarni ajiratish mumkin[1,3]. Energiya spektrining Debay sohasi - 10 10 ÷ 10 11 Gs chastotalarni ; aylanish spektri sohasi -- 10 11 ÷10 13 Gs chastotalarni ; tebranish spektri sohasi --10 13 ÷10 14 Gs tartibdagi chastotalarni o`z ichiga oladi. Elektron spektri chastotalari 10 14 Gs sohadan yuqorida yotadi. Sanab o`tilgan bu sohalar bir-birini qoplashi mumkin, biroq ana shu sohalar bo`yicha ajralish tamoman qonuniydir. Tebranish va aylanish chastotalarning o`ziga xos tomoni shuki, ularning o`zaro o`tishida yuzaga keladigan energiya sathlari molekulalar ichidagi o`zaro ta`sirlarga muvofiq keladi va shunga ko`ra, ayrim zarralar yoki zarralarning uncha katta bo`lmagan guruhlarida lokallashadi. Shuning uchun, molekulalar ichidagi tebranma va aylanma harakatlar moddada to`lqinsimon tarqalmaydi. Moddada 5
