Monokarbon kislotalarida COOH guruhning molekulalararo o‘zaro ta’sirdagi roli va ularning kombinatsion sochilish spektrlari






![I-BOB. MOLEKULALARARO O‘ZARO TA`SIR VA YORUG`LIKNING
KOMBINATSION SOCHILISHI
1.§. М olekulalararo o‘zaro ta’sirlarning bugungi kundagi talqini
Molekulalararo o‘zaro ta’sir tabiatini o‘rganish zamonaviy molekulyar fizikaning
asosiy tushunchalaridan biridir. Moddalarning asosiy xususiyatlarini va fizik
tabiatini o‘rganishda molekulalararo ta’sir katta rol o‘ynaydi. Molekulalararo
o‘zaro ta’sirlarning tabiati va mexanizmini o‘rganish uchun turli xil optik usullar
qo‘llaniladi. Moddalarning xossalari uning qanday molekulalardan tuzilganligiga
va bu molekulalar o‘zaro qanday joylashganligiga bog‘liq. Fizika, kimyo va
biologiyadagi ko‘pgina fundamental masalalarni hal qilishda moddadagi
molekulalarning miqdorini, ularning tuzilishini va boshqa xossalarini keng
temperatura, bosim va konsentrasiya intervalida hamda turli agregat holatlarda
bilish talab etiladi. Bog‘lanishlar orasidagi qonuniyatlarni aniqlash, xarakterli va
qat’iy agregatlarni ajratish suyuqliklarning molekulyar tuzilish mexanizmlarini
o‘rganishda muhim ahamiyat kasb etadi [1].
Molеkulararo o‘zaro ta’sirning turlicha turlari mavjud bo‘lib ularni umumiy
holda 2 gruppaga bo‘lish mumkin: univеrsal va spеtsifik .
Univеrsal o‘zaro ta’sir dеyarli hamma vaqt mavjud bo‘lib unga Van-dеr-
Vals kuchlari kiradi, bu tortishish va itarish, oriеntatsiyalanish, induktsion,
dispеrsion tabiatga ega bo‘ladi.[1-3]
Univеrsal o‘zaro ta’sir ma’lum bir yunalishga ega bo‘lmaydi. Molеkulararo
o‘zaro ta’sirning enеrgiyasi o‘zaro ta’sirlashuvchi molеkulalarning fizik
xossalariga (dipol momеnt, qutblanuvchanligiga) bog‘liq bo‘ladi. Molеkulada
atomlar orasida ximiyaviy kuchlar ta’sir qiladi. Bu kuchlar elеktrostatik tabiatga
ega bo‘lib, atomlarning elеktron strukturasiga bog‘liq. Moddaning
kondеnsirlangan (suyuq yoki qattiq) holati atom va molеkulalar orasida o‘zaro
tortishish kuchlari mavjudligidan dalolat bеradi. Masalan, suyuq g е liy, argon va
hokazolar, atomlar orasidagi o‘zaro tortishish kuchlarining mavjudligiga misol
bo ‘ ladi [1].
7](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_7.png)
![Bundan tashqari atom va mol е kulalar orasida itarishish kuchlari ham yuzaga
k е ladiki, ularni ma’lum holatdan so ‘ ng hajmini kichraytirib bo‘lmaydi. Atom va
mol е kulalar orasidagi o‘zaro ta’sir kuchlari birinchi navbatda Van-d е r-Vaals
kuchlari bo ‘ lib ularning en е rgiyasi 0,1 dan 2 kkal/mol gacha bo‘lishi mumkin.
Van-d е r-Vaals kuchlari o‘z navbatida ori е ntatsion (dipol-dipol), induktsion va
disp е rtsion kuchlarga bo ‘ linadi. Dipol-dipol o‘zaro ta’sir qutbli mol е kulalar
orasida vujudga k е ladi. Bunda dipol mom е ntiga ega bo‘lgan bir mol е kula ikkinchi
dipol mom е ntiga ega bo‘lgan mol е kulaning el е ktr maydonida or е ntirlanadi. Dipol
mom е ntiga ega bo ‘ lmagan mol е kulalarda D е bay nazariyasiga ko‘ra yuqori
multipol (kvadrupol, oktupol mom е ntlar) bo‘ladi. Yoki bir mol е kulaning dipol
mom е nti ikkinchi mol е kulani el е ktr maydonini induktsiyalaydi. Natijada
induktsion o‘zaro ta’sir vujudga k е ladi. Indutsirlangan dipolning ori е ntatsiyasi
xaotik bo‘lmasdan, doimiy dipolning yo ‘ nalishi bilan aniqlanadi. Ori е ntatsion
o‘zaro ta’sir t е mp е raturaga bog‘liq bo‘lib induktsion o‘zaro ta’sir t е mp е raturaga
bog‘liq bo ‘ lmaydi.
Bu hollarda mol е kulalararo o‘zaro ta’sir en е rgiyasi ular orasida masofaning
oltinchi darajasiga t е skari proportsional bo‘ladi. Bundan tashqari in е rt gazlar
mol е kulalari orasida ham o‘zaro ta’sir mavjud. Vaholanki, ularning el е ktron buluti
sf е rik simm е trik bo ‘ lib h е ch qanday el е ktrik dipolga ega emaslar, ular orasida
induktsion eff е kt ham vujudga k е lmaydi. Atomlar yoki qutbsiz mol е kulalar
o ‘ rtasida vujudga k е ladigan o‘zaro ta’sirni disp е rsion o‘zaro ta’sir d е yish mumkin.
Sist е maning pot е ntsial en е rgiyasining kamayish miqdori disp е rsion o‘zaro ta’sir
en е rgiyasi bo ‘ ladi, vujudga k е lgan kuch disp е rsion kuch d е yiladi. Bu kuchning
kattaligi sist е maning qutblanuvchanligiga bog‘liq. London nazariyasiga ko‘ra
disp е rsion o‘zaro ta’sirning tabiati nolinchi en е rgiyaning mavjudligi bilan bog‘liq.
Bundan tashqari mol е kulalar o ‘ rtasida r е zonans o‘zaro ta’sir ham vujudga k е ladi
[2].
Mol е kulaning sp е ktral param е trlari d е ganda sp е ktral chiziqning chastotasi,
yarim k е ngligi va formasi tushuniladi. Mol е kulalar o ‘ rtasidagi Van-d е r-Vaals
o‘zaro ta’sir kuchlari mol е kulaning sp е ktral param е trlarini bir muncha o‘zgartiradi.
8](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_8.png)
![
r
r
1)
2)Sp е ktral chiziqning chastotasi Van-d е r-Vaals o‘zaro ta’sir natijasida siljiydi (ko ‘ p
hollarda past chastota tomon) va uning yarim k е ngligi ortadi. Sp е ktral chiziqning
formasi tabiatan simm е trik bo‘lishi lozim. Uning ass е mm е trik ko‘rinishga ega
bo ‘ lishiga ham asosan mol е kulalar o‘rtasidagi Van-d е r-Vaals o‘zaro ta’siri sabab
bo ‘ ladi. Atomlar orasidagi, istalgan ikkita molekula orasida ham molekulalararo
o'zaro ta’sir kuchlari deb nomlanuvchi elektr kuchlari ta’sir qiladi. Molekulalararo
o'zaro ta’sp kuchlari ko'pincha Van-der-Vaals kuchlari deb ataladi. Ular modda
agregat holatining o'zgarishini, absorbtsiya hodisasini tushintiradi va fazalar
bo'linish chegarasida yuz beruvchi jarayonlarda asosiy rol o'ynaydi.[2]
Molekulalararo kuchlar elektrostatik tabiatga ega. Ular tortishish va itarishish
kuchlaridan iborat. Itarishish har xil molekulalarning elektron qobiqlarining o'zaro
ta’siri bilan aniqlanadi, tortishish esa ularning dipol moment va
qutblanuvchanligiga bog‘liqdir. Molekulalararo kuchlar qisqa ta’sirlashuvchi
kuchlar hisoblanadi va zarrachalar orasidagi masofaning o ‘ sishi bilan tortishishga
nisbatan itarishish tez kamayadi. Endi bu kuchlar ustida to'xtalib o'tamiz. Van-der-
Vaals o'zaro ta’sirning energiyasi bir necha kilokolloriyani tashkil qiladi.
Dipol – dipol ta’sir .Agar molekulalarning o‘zgarmas dipol momenti bo‘lsa,
ularning o‘zaro ta’siri dipol – dipol ta’sirlashish deb ataladi. Eslatib o‘tamiz : Ikki
birxil va ishorasi harxil
q zaryadlar r masofada joylashgan bo‘lsa ularning dipol
momenti deb
⃗μ= q⃗r ifodaga aytiladi. Demak, molekulada dipol momenti paydo
bo‘lishi uchun, unda musbat va manfiy zaryadlarning og‘irlik markazi bir – biriga
nisbatan surilgan bo‘lishi kerak. Ana endi bir – biridan
r masofada joylashgan
ikki
μА va μВ dipolning ta’sirlashuvini topamiz. Ularning eng qulay joylashgan
ikki holatini ko‘rib chiqamiz 1-rasm.
9](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_9.png)
![1- rasm . Chap tarafdagi dipollarning oriyentatsiyasi uchun ularning ta ’ sirlashuv
energiyasi quyidagicha bo ‘ ladi :W =−
2μAμB
εr 3
(1.1)
O‘ng tarafdagisi uchun esa:
W = −
μAμB
εr 3
(1.2)
bu erda
ε - dielektrik singdiruvchanlik, minus ishorasi esa molekulalarning bir –
biriga tortishishini bildiradi:
Agar dipollardan birining ishorasini o‘zgartirsak unda molekulalar o‘zaro
itarishadi.
Makroskopik sistemalarda, masalan gaz yoki suyuqliklarda, dipollar har xil
oriyentatsiyada bo‘lishi mumkin, ular orasida ham tortishish, ham itarish kuchlari
bo‘lishi mumkin, shuning uchun o‘rta hisobda ularning o‘zaro ta’sir energiyasi
no‘lga teng bo‘lishi kerak. Lekin Bolsmanning taqsimoti qonuniga binoan
energetik nuqtai nazardan o‘zaro qulay oriyentatsiyaga ega bo‘lgan molekulalar
noqulay oriyentatsiyaga ega bo‘lganlaridan
exp (−
μAμB
εr 3kT ) marta ko‘pdir. SHu
nuqtai nazardan aniqroq qilib bajarilgan hisoblarga qaraganda o‘zgarmas
dipollarning o‘zaro ta’sir energiyasining o‘rtacha qiymati teng:
W = − 2
3
μA2μB2
εr 6
1
kT
(1.3)
Bu erda endi energiya masofaning oltinchi darajasiga teskari proporsionaldir, xudi
shunday ahvol temperaturaga nisbatan ham. Demak, temperatura oshgan sari
molekulalarning o‘rtacha kinetik energiyasi ham oshadi va bir – biriga tortishish
uchun kerak bo‘ladigan oriyentatsiya ehtimolligi kamayadi, demak tortish kuchlari
kamayadi, bu esa
W ning ham absolyut qiymatining kamayishiga olib keladi.[6-7]
Oriyentasion ta’sir. Molekulalar elektr xususiyatining asosiy
xarakteristikalari uning dipol momenti r va qutblanuvchanligi dir. Bu kattaliklar
molekulalar o‘rtasidagi o‘zaro ta’sir kuchini aniqlaydi. Bu kuchlar molekulalar
10](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_10.png)


![Agar o‘zaro ta’sir etuvchi molekulalarning energiyasi har xil bo‘lsa, uning
oriyentasion energiyasi quyidagi ko‘rinishda bo‘ladi:
U op = − 2
3
p12 p22
kTr 6 (1.19)
Energiyaning manfiy ishorasi ikkita dipolning tortishishini ko‘rsatadi [2].
Induksion ta’sir. Har bir dipol qo‘shni molekulada o‘z yo‘nalishiga mos
bo‘lgan dipolni induksiyalaydi. Induksiyalovchi molekulaning qutblanuvchanligi
qancha katta bo‘lsa, induksiyalangan dipol momenti ham shuncha katta bo‘ladi.
Endi doimiy dipol momentiga ega bo‘lgan va induksiya natijasida hosil
bo‘lgan dipol momentlari o‘rtasidagi o‘zaro tortishish energiyasini aniqlaymiz.
Bizga ma’lumki,
U op = − α E 2
2 (1.20)
Xuddi shuningdek,
U ind =− αind
E2
2 − αind
(2p/r3)2
2 =− αind
4p2
2r6 (1.21)
U ind = − α ind
2 p2
r6 (1.22)
Induksion ta’sir birinchi marta Debay tomonidan hisoblangan edi. Shuning
uchun ham ba’zan bu ta’sirga Debaycha ta’sir ham deyiladi. Induksion ta’sir,
oriyentasion ta’sirdan farqli o‘laroq, temperaturaga bog‘liq emas.
Dispersion ta’sir. Doimiy dipol momentiga ega bo‘lmagan molekulalarning
o‘zaro ta’sirini hisoblash biroz boshqacharoq.. Bunday molekulalar ham o‘zaro
tortishish xususiyatiga egadirlar, chunki bu xususiyat bo‘lmaganda temperaturani
pasaytirib, bosimni oshirib gazlarni suyuqlikka aylantirib bo‘lmas edi. Misol: havo
bir necha simmetrik molekulalar N
2 , O
2 , CO
2 , Ar larning aralashmasidan iborat.
Dipolsiz atom yoki molekulalarning o‘zaro ta’sirini faqat kvant mexanikasi asosida
tushuntirish mumkin. Londonning ko‘rsatishicha, bu ta’sir molekulaning nolinchi
energiyaga ega ekanligi bilan bog‘lik.
13](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_13.png)
![Biz atomdagi elektronni o‘z muvozanat holati atrofida garmonik tebranma
xarakat qiluvchi zarracha yoki ossillyator deb qaraymiz. Atomning dipol momenti
nolga teng. Lekin elektronning tebranishi tufayli hosil bo‘lgan ossillyator dipol
momentining oniy qiymati nolga teng emas.[4] Demak, ossillyatorlar o‘zaro ta’sir
qilishlari mumkin. Elektronlar o‘z muvozanat xolatlaridan chetga chiqqanlarida
ossillyatorlarning o‘zaro ta’sir energiyasi:
U ¿= − 2 e2х1х2
r3 . (1.23)
x
1 , x
2 lar – 1 chi va 2 chi elektronning (ossillyatordagi) muvozanat holatdan
chetlanishini xarakterlaydi. Ikkita ossillyatorning o‘zaro ta’sir energiyasi shu erkin
ossillyatorlarning potensial energiyalari va ularning o‘zaro ta’sir energiyalarining
yig‘indisidan iboratdir:
U = U 1+ U 2+ U 1= kx 12
2 + kx 22
2 − 2 e2x1x2
r3 (1.24)
Bu ossillyatorlarning harakat tenglamalari:
f= − ∂ u
∂ x
f= m ¨x ;
m ¨x= − ∂ u
∂ x
m ¨x1= − kx 1+ 2e2
r3 x2
m ¨x2= 2e2
r3 x1− kx 2 }
Normal tebranishlar chastotasi.
ω 1,2 = k ± 2 e 2
r 3 /m (1.25)
(1.7) va (1.5) formulalarga asosan potensial energiyani quyidagicha yozish
mumkin:
U = m
4 {ω1
2(x1− x2)2+ω 2
2(x1+ x2)2}= m
4 {
k+ 2е2
r3
m (x1− x2)2+
k− 2e2
r3
m (x1− x2)2}
(1.26)
14](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_14.png)




![2-rasm.Ikki molekula o'rtasidagi tortilish va itarilishga tegishli potensial
energiya grafigi.
Qutbsiz va sferik shaklga ega bo‘lgan molekulalarning o‘zaro juft ta’sirini
xarakterlovchi Lennard-Jons potensiali quyidagi ko‘rinishga ega:
U = 4 ε [(
σ
r )
12
− (
σ
r )
6
] (1.47)
Bu tenglik r>
bo‘lganda bajariladi. Agar r< bo‘lsa, U= bo‘ladi. Van-der-
Vaals doimiysi v va
o‘zaro quyidagicha bog‘langan:
в = 2
3
πN A⋅ σ 3
(1.48)
N ta atomdan tashkil topgan molekulalarda atomlar qandaydir kuch ta’sirida
ushlab turiladi. Bu kuchlar uncha katta emas va shuning uchun molekulalar
absalyut qattiq bulmasdan atomlar uzining muvozanat vaziyati atrofida kuchsiz
tebranadi [1,2,3,4]. Bir atomning uzgarishi uzaro ta’sir yordamida xamma
atomlarning, ya’ni butun sistemaning tebranishiga olib keladi. N atomli sistema
xar-xil usullarda (3N-5) xil tebranish mumkin. Fizik,pi molekulalar uchun bu son
(3N-6) gacha oshadi. Haqiqatdan ham har bir atom uchta erkinlik darajasiga ega
buladi. Bulardan uchtasi og‘irlik markazining holatini va uchtasi butun
molekulaning aylanishi bilan aniqlanadi. Ular har bitta yagona kattalik, ya’ni mos
keluvchi chastota bilan xarakterlangani uchun 3N-6 yoki 3N-5 ta tebranishning
har-xil usullari bo‘lishi kerak[1-2][6-7] .
19](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_19.png)
![Dispersion kuchlar tabiatda, ayniqsa tirik organizmda ko‘p kuzatiladi, katta
molekulalarda muhim ahamiyat kasb etadi. Masalan, oqsil moddasining
strukturasini ushlab turishda. Ma’lumki, oqsilning uchlamchi strukturasi asosan
nopolyar gruppalar o‘rtasidagi kontakt tufayli saqlanib turadi. Membranalarda lipid
molekulalarining uglevodorod zanjirlari o‘rtasidagi o‘zaro ta’sir dispersion
xarakterga ega. Jadvalda bazi bir zarrachalar o‘rtasidagi o‘zaro ta’sir xillari va
ularning masofaga bog‘liqligi keltirilgan[6].
1-jadval
O‘zaro ta’sir xili Masofaga
bog‘liqlik Misol Bog‘lanish
energiyasi kJ/mol
Kovalent
bog‘lanish Oddiy ifoda yo‘qН − Н 200 – 800
Ion – ion
е2
εr
Na +Cℓ − 40 – 400
Ion – dipol
еμ
εr 2
Na +(H 2O )
− 4 – 40
Dipol – dipol
2μ12μ22
3εr 6kТ
SO 2
SO 2 0,4 – 4
Dipol –
indutsirlangan
dipol
2μ2
εr 6
HC ℓC 6H 6 0,4 – 4
Dispersion kuchlar
3
4
Iα 2
r6
He − He 4 – 40
Vodorod
bog‘lanish Oddiy ifoda yo‘q
H2O....H2O 4 – 40
1.2-§. Molekulalararo o‘zaro ta’sirning maxsus turi: Molekulalararo vodorod
bog‘lanish
Molekulalararo o‘zaro ta’sirning tabiatda keng tarqalgan turlaridan biri vodorod
bog‘lanishdir. Bir molekula tarkibida kimyoviy bog‘langan vodorod atomi boshqa
molekulaning elektromanfiy guruhi bilan yana qo‘shimcha bog‘lanish hosil qiladi.
Bu bog‘lanishga vodorod bog‘lanish deyiladi. Vodorod atomining bir vaqtda ikkita
bog‘lanishda qatnashishi xususiyati XVIII asr oxirida ma’lum bo‘lgan.Vodorod
20](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_20.png)
![bog‘lanish tabiatda ko‘p uchraydigan va molekulalar o‘rtasida bo‘ladigan o‘zaro
ta’sirning alohida ahamiyatga ega bo‘lgan turidir. Agar dipol momentiga ega
bo‘lgan molekula (qutbli molekula) tarkibida vodorod atomi bo‘lsa (O− H yoki
N− H
fragmentli molekula) va elektromanfiy atomlar bilan ta’sirlashsa, masalan,
O
, N , F yoki Cℓ bilan, u holda vodorod bog‘lanish paydo bo‘ladi[8-10]. Bu
o‘zaro ta’sir quyidagicha belgilanadi:
A− H ⋅¿⋅B
bu yerda
A va B - elektromanfiy atomlar, punktir esa vodorod bog‘lanishini
bildiradi.
Vodorod bog‘lanish bitta molekula ichida bo‘lishi mumkin. Bunga ichki
molekulyar vodorod bog‘lanish deyiladi. Masalan, orto-xlorfenol, orto-nitrofenol
va hokazo molekulalarda ichki molekuyar vodorod bog‘lanish kuzatiladi. Vodorod
bog‘lanish bir xil yoki turli xil molekulalar orasida bo‘lishi mumkin. Bunga
molekulalararo vodorod bog‘lanish deyiladi.
Vodorod bog‘lanishni odatda A-H…B ko‘rinishda belgilanadi. A-H guruh
protonni beruvchi – donor, V guruh esa protonni qabul kiluvchi – akseptor
deyiladi. Vodorod bog‘lanishli komplekslarni bog‘lanish enregiyasiga qarab shartli
ravishda uch guruhga bo‘lish mumkin:
- Kuchsiz vodorod bog‘lanishli komplekslar, energiyasi 1-2 kkal/mol
oraliqda bo‘ladi, bunga H, N
2 , SO va hakozolarni misol qilib keltirish
mumkin);
- Tipik vodorod bog‘lanishli komplekslar, energiyasi 2-8 kkal/mol oraliqda
bo‘ladi, bularga suv, geloidovodorodlar dimeri yoki polimerlarni misol bo‘la
oladi;
- Kuchli vodorod bog‘lanishli komplekslar, energiyasi 9 30 kkal/mol
oraliqda bo‘ladi, karbon kislotalari, fosfororganik birikmalar va hokazolar bu
turdagi bog‘lanishga misol bo‘ladi.
21](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_21.png)
![Vodorod bog‘lanish moddaning har qanday agregat xolatida mavjud bo‘lib,
uning spektral parametrlarini keskin o‘zgarishiga yangi polosalarning hosil
bo‘lishiga olib keladi[8-9]. Vodorod bog‘lanish tebranish spektrida quyidagicha
namoyon bo‘ladi:
- A-H tebranishning polosasi past chastotaga tomon siljiydi. Bu siljish
bog‘lanish energiyasiga qarab o‘ta kuchsiz vodorod bog‘lanishli
komplekslarda bir necha sm -1
dan o‘ta kuchli vodorod bog‘lanishli
komplekslarda 1000 sm -1
gacha bo‘lishi mumkin;
- A-H tebranish polosasining formasi kuchli vodorod bog‘lanishli
komplekslarda tubdan o‘zgarib ketadi;
- A-H polosaning intensivligi IQ yutilish spektrida keskin ortadi;
- B guruhning spektral parametrlari o‘zgaradi.
Karbon kislotalari molekulalari suyuq holatda turli xil agregatlar hosil qiladi.
Eritmalarda komponentlarning bir xil ulushida agregatlangan birikmalarning soni
oshadi. Neytral eritmalarida turli tipdagi agregatlarining nisbiy tarkibi o‘zgaradi.
Karbon kislotalarida vodorod bog‘lanish tufayli O-H polosa 3550 sm -1
dan
2700 sm -1
gacha siljiydi. Bu polosaning yarim kengligi va intensivligi keskin
ortib ketadi. Shuningdek C=O polosa ham past chastotaga tomon 40 50 sm -1
gacha siljiydi. Yutilish spektrlarida O-H polosaning past chastota tomon siljishi esa
100 sm -1
ni tashkil qiladi. Masalan, chumoli kislotas i molekula laridagi C-H
g u ruh i vodorod atomi, molekulalararo vodorod bog‘lanish hosil qilishda faol
qatnash adi [10].
O'zaro ta’sirlashuvchi atom В ning manfiy zaryadi qancha katta bo'lsa,
o'lchami qancha kichik bo'lsa va A-H kovalent bog‘lanishda qatnashuvchi
atomlarning manfiy zaryadlaridagi farq qancha katta bo'lsa vodorod bog‘lanish
shuncha kuchli namoyon bo'ladi. Shuning uchun u ftor bilan kislorod birikmalarida
eng kuchli bo'ladi, azotda kamroq, xlor bilan oltingugurtda yana xam kamroq
bo'ladi. A-H... В o'zaro ta’sirning kuchiga qarab H bog‘lanishning energiyasi ham
o'zgaradi.
22](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_22.png)
![Masalan, ftorli birikmalarda bu bog‘lanish energiyasi 10 kkal/mol ni tashkil
qilsa, C-H...B tipdagi komplekslarda 2-3 kkalG‘mol ni tashkil qiladi. Shunday
qilib spetsifik o'zaro ta’sir bir yoki turli xil molekulalarning ikkita funktsional
guruppasini o'z ichiga oladi.
Bu gumhlardan bin A-H proton beruvchi, ikkinchisi В esa proton qabul
qiluvchi deyiladi. Odatda donor proton sifatida gidroksil guruhlari (O-H)
aminoguruhlar (N-H) bo'ladi. Aktseptor esa karbonil guruhlaridagi ftor, xlor va
hakozolar bo'lishi mumkin [10].
Agar vodorod bog‘lanish A-H va В guruhlarida bir turli va har turli ikki yoki
undan ko'proq molekulalar orasida yuz bersa, buni molekulalararo vodorod
bog‘lanish deyiladi. Vodorod bog‘lanish bir birikma molekulalan orasida ham yuz
beradi. Bunday bog‘lanishni ichki molekulyar vodorod bog‘lanish deyiladi.
Molekulalararo vodorod bog‘lanishlar turli tarkibdagi qo'shilmalaming hosil
bo'lishiga sabab bo'ladi. Vodorod bog‘lanishning eng ko'p turi ayni bir birikmaning
ikki molekulasi orasida bog‘lanishlardan iborat. Hosil bo'lgan komplekslar
demirlar deyiladi. Bundan tashqari bir vaqtning o'zida bir necha bir xil yoki har xil
molekulalar vodorod bog‘lanish orqali o'zaro bog‘lanishi mumkin. Ular trimer,
tetramer va hakozo bo'lishi mumkin. Molekulalararo vodorod bog‘lanish ko'pchilik
organik birikmalar uchun xosdir. Masalan, kislorod nitrofenolda ichki molekulyar
vodorod bog‘lanish bor. Paranitrofenolda esa molekulalararo bog‘lanish, chunki bu
birikmalar O-H guruhining vodorodi nitroguruhi kislorodidan uzoqlashadi [9-10].
Vodorod bog‘lanish ko'pgina fizik, ximik, biologik jarayonlarda muhim rol
o'ynaydi. Hamda moddaning ko'pgina xossalarini belgilaydi. Bu bog‘lanish
vodorod atomi bo'lgan deyarli hamma moddaning har qanday agregat holatida
uchraydi. Keyingi yillarda vodorod bog‘lanish haqidagi fikrlardan foydalangan
yangi sohalar vujudga kelmoqda va taraqqiy etmoqda. Masalan, adsorbtsiya
kataliz, fermentlar aktivligi va hakozo.
Vodorod bog‘lanish tirik organizimda ham namoyon bo'ladi. Inson o'zi ham
vodorod bog‘lanishli birikmalardan tashkil topgan. Tirik organizmdagi murakkab
molekulalarning tuzilishi va xossalari ko'p hollarda molekulalar ichidagi
23](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_23.png)
![bog‘lanishlarga bog‘liq bo'ladi. Bitta katta molekula ichida bunday
bog‘lanishlardan bir nechtasi bo'lishi mumkin [8-10].
Haqiyqatdan ham bu bog‘lanishlarda oqsil va nuklein kislotalar tuzilishida
o'ziga xoslikni aniqlaydi va sintetik polimerining ko'pchiligida muhim rol o'ynaydi.
Toza moddada yoki eritmada molekulalararo vodorod bog‘lanishlarning hosil
bo'lishi moddaning ko'p fizikaviy xossalarining o'zgarishiga olib keladi.
Moddalaming tuzilishini, molekulyar qo'shilmalaming hosil bo'lishiga sabab
bo'luvchi o'zaro ta’sir kuchlari to'liq aniqlaydi. Moddalar qo'shilishida ulaming
xossalari odatda kuchli o'zgaradi va qo'shilishdan oldin hosil bo'lgan moddalaming
xossalaridan ancha farq qiladi. Chunki vodorod bog‘lanish molekulalarning faqat
massasi, o'lchamlari va shakligina emas, funktsionlar guruhlarining elektron
tuzilishini ham o'zgartiradi. Boshqacha aytganda vodorod bog‘lanish tufayli
moddaning termodinamik va elektr xossalari o'zgaradi. Ko'p xollarda erish va
qaynash haroratining ko'tarilishi, bug‘ hosil bo'lish issiqligining kuzatilishi, ideal
eritma va elektr o'tkazuvchanlikning, dielekrtiklar xossalarining o'zgarishi, gaz
qonunlarida chetlanish kabi xodisalami ko'rish mumkin. Bundan tashqari
moddaning spektroskopik parametrlari ham o'zgaradi. Bu esa infraqizil yutilish va
kombinatsion sochilaish spektorida chastotalaming siljishiga va MR spektrida esa
signallarning siljishiga olib keldi [8].
Vodorod bog‘lanishning hosil bo'lishi tebranish spektrida yaqqol namoyon
bo'ladi. Vodorod bog‘lanish tufayli past chastotali uzoq infraqizil yutilish oblastida
yotuvchi molekulalarning tebranishlariga mos keluvchi yangi chiziqlar paydo
bo'ladi.
Demak, vodorod bog‘lanish molekulalararo o'zaro ta’sirlaming bir turi
bo'lib, uni bir molekulaning vodorod atomi bilan ikkinchi molekulaning xuddi shu
molekulaning manfiy zaryadli atomlari hosil qiladi. Agar ayni bir molekulaning
ichida aytilgan o'zaro ta’sir mavjud bo'lsa, bunga ichki molekulyar vodorod
bog‘lanish deyiladi.
Agar o'zaro ta’sirda turli molekulalar qatnashsa u vaqtda molekulyar
vodorod bog‘lanish hosil qiladi.
24](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_24.png)
![Vodorod bog‘lanish muammolari uning spektral namoyon bo'lish masalalari
doirasi juda keng bo'lib, ko'p ilmiy ishlarda ko'rib chiqilgan. Vodorod bog‘lanish
energiyalari keng oraliqni egallaydi. Ular elektron tebranish va aylanish
spektrlarida namoyon bo'ladi. Ularni o'rganish infraqizil yutilish hamda
kombinatsion sochilish spektri va Ua MR spektrlari yordamida olib boriladi.
Vodorod bog‘lanish sistemalari infraqizil yutilish va kombinatsion sochilish
bo'yicha to'plangan katta materiallar asosida tebranish spektriga qarab vodorod
bog‘lanishning hosil bo'lishini aniqlash imkonini beruvchi bir qator belgilari
aniqlangan. A-H...B tipdagi vodorod bog‘lanish hosil qilganda ham A2H, A-H
bog‘lanishning ham В guruhlarining chastotalari o'zgaradi. Bunda quyidagi
tebranishlar kuzatiladl
v
s ,v
t ,v
β - tebranishlar R-A-H molekulada vodorod bog‘lanish bo'lmaganda
ham mavjud bo'ladi. v
s ва v
p - tebranishlar esa vodorod bog‘lanish bo'lgandan
keyin hosil bo'ladi [8-10].
Vodorod bog‘lanishning tebranish spektrida kuzatiladigan asosiy spektrlar
belgilari quyidagilardir:
I. A-H guruhining valent tebranishi - v
s
1. Valent tebranish palasasi va uning obertonlari past chastotaga siljiydi.
Ko'plab sistemalarda bu siljish miqdorining o'nlab foizini tashkil qiladi.
2. a) Infraqizil yutilish spektrida vodorod bog‘lanish palasa integral
intensivligining ortishiga olib keladi. Uning obertonining intensivligi esa kam
o'zgaradi.
b) Kombinatsion sochilish spektrida v
s - ning intensivligining o'zgarishi
haqida ishonchli tajribalar deyarli yo'q. Nisbiy intensivligi qisman ortadi.
25](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_25.png)
![3. Temperaturaning qisman o'zgarishi v
s palasaning chastotasida va
intensivligining keskin o'zgarishiga olib keladi.
4. Turli xil erituvchilar ham v
s palasaning parametrlariga ta’sir qiladi.
II. R A-H guruhining v
d defarmatsion tebranishi.
1. v
d defarmatsion tebranish palasasi chastotasi erkin molekula chastotasiga
nisbatan yuqoriga siljiydi. Bu holda nisbiy siljish uncha katta bo'lmaydi.
2. v
d tebranish palasaning yarim kengligi va intensivligidan farqli ravishda
unchalik o'zgarmaydi.
III. Vodorod bog‘lanishning o'ziga tegishli bo'lgan yangi past
chastotali tebranishlarning paydo bo'lishi, bu uzoq infraqizil oblastida
kuzatiladi.
Vodorod bog‘lanish molekulalarning aylanma va ilgarilanma erkinlik
darajalari sonining kamayishiga olib keladi va yangi tebranma erkinlik darajasi
vujudga keladi. Valent va defarmatsion tebranish chastotasi 20-200sm -1
oblastda
yotadi.
Vodorod bog‘lanishni o'rganishda to'liq spektroskopik ma’lumotni infraqizil
yutilish hamda kombinatsion sochilish spektrlarini birgalikda qo'llagandagina olish
mumkin. Bu ikki usul tebranish spektirini o'rganishda bir-birini to'ldiradi. Tanlash
qoidasiga ko'ra, yuqori simmetriyaga ega bo'lgan molekulalarda infraqizil yutilish
spektrida kuzatiladigan kombinatsion sochilish spektrida kuzatiladigan tebranishlar
IQ yutilish spektrida kuzatilmaydi [6-11].
Bundan tashqari past chastotalardagi tebranishlarni yorug‘likni
kombinatsion sochilish usuli bilan o'rganish qulay. Umuman olganda vodorod
bog‘lanishni o'rganishning juda ko'p usullari mavjud. Masalan yorug‘likning
molekulyar sochilishi, ultraakustik usul, yadro magnit rezonans usuli va hokoza.
Lekin bu usullar vodorod bog‘lanish haqida IQ yutilish va KS usullari beradigan
to'liq ma’lumotni bera olmaydi.
Vodorod bog‘lanish tebranma spektrida A-H valent tebranish
palasasining past chastotalarga tomon siljishiga olib keladi. Qo'shni
26](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_26.png)
![molekulalaming proton donorlik va proton akseptorlik qobiliyatlariga qarab
siljishning kattaligi l0sm -1
dan 1000 sm -1
gacha o'zgaradi.
Chastota siljishi bilan asosiy holda vavlent tebranishlari chiziq
intensivligining oshishi ham vodorod bog‘larrishning muxim belgisi bo'la oladi.
Kuchsiz vodorod bog‘lanishlar bir qator sistemalarda masalan, tarkibida proton
donor sifatida xloroform tiol bo'lganda vodorod bog‘lanish mavjudligini v A-H
palasaning siljishiga qaraganda intensivlik tezroq ko'rsatadi. Haqiqatdan agar tipik
vodorod bog‘lanishlar uchun nisbiy siljish 10% dan oshmasa, v A-H palasaning
intensivligi bir necha marta oshadi.
Oddiy sharoitda valent tebranish chiziqlarining kengayishi vodorod
bog‘lanishlarning yana bir belgisi qaraladi. Ko'pincha bu kengayish bilan
baravariga proton donori chiziqlarida murakkab struktura ham paydo bo'ladi.
Adabiyotlarda vodorod bog‘lanishli kompleks chiziqlarning formasi
to'g‘risida to'rtta umumiy nazariya muxokama qilinadi.
1.O'ta dissosiatsiya.
2.Chastota modulyatsiyasi.
3.Fermi rezonansi.
4.Fluktatsion nazariya.
Barcha sistemalar uchun ham qo'llanilishi mumkin bo'lgan chiziqlarning
kengayishini to'liq tushuntiruvchi umumiy nazariyalarning bo'lishi mumkin
emasligi ravshan, chunki vodorod bog‘lanishli sistemalar juda xilma xil. Shuning
uchun ham turli xil vodorod bog‘lanishlarda ayniqsa turli agregat xolatlarda
kengayish sabablari har holda o'ylash tabiidir.
Vodorod bog‘lanishlarning deformatsion tebranishlarda ko'rinishini
muntazam tekshirishga bag‘ishlangan ishlar ko'p emas. Chunki ular keskin ajralib,
namoyon bo'lmaydi. Odatda bu tebranishlar chiziqlarida yuqori chastotali siljish va
intensivlikning ozgina o'zgarishi qayd qilinadi [9-11].
Oxirgi yillarda kuchsiz vodorod bog‘lanishli komplekslarini o'rganish uchun
matritsali izolyatsiya deb ataladigan yangi usul muvofaqqiyatli ravishda
27](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_27.png)
![qo'llanilmoqda. Bu usul vodorod bog‘lanishli modda bilan ko'p miqdor inert gaz
aralashmasini diffuziya yuz bermaydigan haroratda tez sovutishdan iborat.
1.3-§. Molekulalararo o‘zaro ta’sirlarning tebranish spektrlarda namoyon
bo‘lishi
Molekula aylanish yoki tebranish spektriga ega bo‘lishi uchun u dipol
momentiga yoki qutblanuvchanlikka ega bo‘lishi lozimligini yuqorida keltirilgan
mavzularda ko‘rib o‘tdik. Demak molekulaning elektr xossalari uning optik
xossalari bilan chambarchas bog‘liq ekan. Buning asosiy sababi qutblanuvchanlik
va dipol momenti molekulaning elektron bulutining xossasini bildiradi[2-6]. Dipol
momenti va qutblanuvchanlik molekulalar o‘rtasidagi o‘zaro ta’sir kuchlarini
belgilaydi.
Molekulalar orasidagi masofa yaqin bo‘lganda gazni suyuqlikka aylanishida
va molekulyar kristallar hosil bo‘lishida molekulalararo o‘zaro ta’sir muhim
ahamiyatga ega bo‘ladi. Molekulalararo o‘zaro ta’sir kuchlari ko‘p hollarda Van-
der-Vals kuchlari ham deyiladi, shu kuchlar tufayli moddalarning suyuq holati
vujudga keladi[1-3]. Savol tug‘iladi, nima sababdan elektrik nuqtai nazardan
neytral bo‘lgan molekulalar o‘zaro bir-biriga tortiladi. Bu savolga javob berish
uchun dastlab qutbli molekulalarni qaraymiz. Qutbli molekulalarda musbat va
manfiy zarrachalarning og‘irlik markazlari bir-biriga nisbatan siljigan va turli
molekulalardagi qarama-qarshi zaryadlar bir-birini elektrostatik (kulon) kuchlari
tufayli tortadi. Bunda molekulalar rasmdagidek ketma-ket yoki antiparallel
joylashadi.
Tebranish spektrida molekulalarning spektral parametrlari deganda, IQ
yutilish yoki kombinasion sochilish chizig‘ining chastotasi, polosaning yarim
kengligi, intensivligi tushuniladi[7]. Modda bir agregat holatdan boshqa, bir
agregat holatga o‘tganda moddani tashkil etgan molekulalarning spektral
parametrlari ma’lum miqdorda o‘zgaradi. Modda siyraklashtirilgan gaz holatida
bo‘lganda molekulani tashkil qilgan atomlarning tebranma harakatidan tashqari
molekulaning aylanma harakati ham sodir bo‘ladi. Shuning uchun IQ sohada
28](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_28.png)
![molekulalarning tebrama-aylanma spektri kuzatiladi. Molekulalarning tebranma
aylanma spektrlari ajrata olish qobiliyati yuqori bo‘lgan asboblar yordamida
yozilganda tebranma-aylanma sathlar orasida o‘tishlarga mos keluvchi chiziqlar
yaqqol ko‘rinadi.
Vodorod bog‘lanishni o'rganishda to‘liq spektroskopik ma’lumotni infraqizil
yutilish hamda kombinatsion sochilish spektrlarini birgalikda qo'llagandagina
olish mumkin. Bu ikki usul tebranish spektrini o'rganishda bir-birini to'ldiradi.
Tanlash qoidasiga ko'ga, yuqori simmetriyaga ega bo'lgan molekulalarda
infraqizil yutilish spektrida kuzatiladigan kombinatsion sochilish spektrida
kuzatiladigan tebranishlar IQ yutilish spektrida kuzatilmaydi [7-12].
Bundan tashqari past chastotalardagi tebranishlarni yorug‘likni kombinatsion
sochilish usuli bilan o'rganish qulay. Umuman olganda vodorod bog‘lanishni
o'rganishning juda ko'r usullari mavjud. Masalan, yorug‘likning molekulyar
sochilishi, ultraakustik usul, yadro magnit rezonans usuli va hokoza. Lekin bu
usullar vodorod bog‘lanish haqida IQ yutilish va KS usullari beradigan to'liq
ma’lumotni bera olmaydi. Vodorod bog‘lanish tebranma spektrida A-H valent
tebranish polosasining past chastotalarga tomon siljishiga olib keladi. Qo'shni
molekulalarning proton donorlik va proton akseptorlik qobiliyatlariga qarab
siljishning kattaligi 10 sm -1
dan 1000 sm -1
gacha o'zgaradi [12].
Chastota siljishi bilan asosiy holda valent tebranishlari chiziq
intensivligining oshishi ham vodorod bog‘lanishning maksimum belgisi bo'la
oladi.Kuchsiz vodorod bog‘lanishlar bir qator sistemalarda masalan, tarkibida
proton donor sifatida xloroform tiol bo'lganda vodorod bog‘lanish mavjudligini v
A-H polosaning siljishiga qaraganda intensivlik tezroq ko'rsatadi. Haqiqatdan
agar tipik vodorod bog‘lanishlar uchun nisbiy siljish 10% dan oshmasa, v A-H
polosaning intensivligi bir necha marta oshadi [10].
Oddiy sharoitda valent tebranish chiziqlarining kengayishi vodorod
bog‘lanishlarning yana bir belgisi qaraladi. Ko'pincha bu kengayish bilan
baravariga proton donori chiziqlarida murakkab struktura ham paydo bo'ladi.
29](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_29.png)
![Barcha sistemalar uchun ham qo'llanilishi mumkin bo'lgan chiziqlarning
kengayishini to'liq tushuntiruvchi umumiy nazariyalarning bo'lishi mumkin
emasligi ravshan, chunki vodorod bog‘lanishli sistemalar juda xilma-xil. Shuning
uchun ham turli xil vodorod bog‘lanishlarda ayniqsa turli agregat holatlarda
kengayish sabablari haqida o'ylash tabiidir.
Vodorod bog‘lanishlarning deformatsion tebranishlarda ko'rinishini
muntazam tekshirishga bag‘ishlangan ishlar ko'r emas. Chunki ular keskin ajralib,
namoyon bo'lmaydi. Odatda bu tebranishlar chiziqlarida yuqori chastotali siljish
va intensivlikning ozgina o'zgarishi qayd qilinadi.
Oxirgi yillarda kuchsiz vodorod bog‘lanishli komplekslarini o'rganish uchun
matritsali izolyatsiya deb ataladigan yangi usul muvafaqqiyatli ravishda
qo'llanilmoqda. Bu usul vodorod bog‘lanishli modda bilan ko'r miqdorda inert gaz
aralashmasini diffuziya yuz bermaydigan haroratda tez sovutishdan iborat.
Sovutilgan ideal gaz shunday qattiq matritsani hosil qiladiki, unda kondensattsiya
vaqtida mavjud bo‘lgan barcha asossiatsiyalar izolyatsiyalanadi.
Biz yuqorida ko‘rsatdikki, yorug‘likning molekulyar sochilishida tushuvchi
nurning to‘lqin uzunligiga sochilgan yorug‘likning to‘lqin uzunligi bilan mos
tushadi. Lekin 1928 yilda rus olimlari L.I. Mandelshtam, T.S. Landsberg va hind
olimi Ch.V. Raman ko‘rsatdilarki, yorug‘lik sochilishining shunday turi mavjudki
[12-16], sochilgan yorug‘lik spektrida tushuvchi monoxromatik to‘lqinni
xarakterlovchi spektral chiziqlardan tashqari har bir monoxromatik spektral
chiziqning ikkala tomonida joylashadigan qo‘shimcha spektral chiziqlar ham hosil
bo‘ladi. Faraz qilaylik suyuqlikka tushuvchi nurning chastotasi 0
bo‘lsin (3-rasm) .
Qo‘shimcha hosil bo‘lgan yo‘ldoshlar chastotasini 1
11
111
bilan belgilaymiz.
Tushuvchi nur chastotasi bilan har bir yo‘ldosh chastotasi o‘rtasidagi farq
yorug‘lik sochuvchi modda uchun xarakterli bo‘lib bu farq ana shu modda
molekulalarining xususiy tebranishlar chastotasiga tengdir.
30](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_30.png)
![3-rasm.Δν 1= ν0− ν'= ± ν1i
Δν 2= ν0− ν''= ± ν2i
} (1.49)
Δν 3= ν0− ν'''= ± ν3i
Tajriba ko‘rsatdiki, bu shartlar hamma vaqt ham bajarilmaydi. Kombinatsion
sochilishda kuzatiladigan yo‘ldosh infraqizil nurlanishda yoki infraqizil yutilish
sohasida hamma vaqt hosil bo‘lmaydi. Bunga sabab bu kombinatsion sochilish
spektrini hosil bo‘lishi uchun modda molekulasining qutblanuvchanligi
o‘zgarishi kerak. Infraqizil yutilish spektrlar hosil bo‘lishi uchun modda
molekulasining dipol momenti o‘zgarishi kerak. Shuning uchun ham infraqizil
yutilish spektrida hosil bo‘ladigan ba’zi chiziqlar kombinatsion sochilish spektrida
kuzatilmaydi va aksincha [7,12,15].
Yorug‘likning kombinatsion sochilish hodisasini soddalashtirilgan kvant
nazarisi asosida quyidagicha tushuntirish mumkin. Odatdagi sharoitda modda
molekulasining aksariyati uyg‘onmagan holatda bo‘ladi. Ana shunday holatdagi
molekulalarga
=h (1.50)
formula bilan aniqlanadigan kvant energiyaga ega bo‘lgan tushganda, bu kvant o‘z
energiyasining bir qismini molekulaga beradi va natijada chastotasi kichik va
to‘lqin uzunligi katta bo‘lgan kvantga aylanadi, ya’ni bu holda qizil yo‘ldoshlar
hosil bo‘ladi. Ikkinchi holda kvant uyg‘ongan molekula bilan uchrashadi, bu holda
molekula o‘z energiyasining bir qismini kvantga beradi. Natijada chastota va
energiyasi katta bo‘lgan va to‘lqin uzunligi kichik bo‘lgan kvant, ya’ni binafsha
31](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_31.png)
![yo‘ldoshlar hosil bo‘ladi [12-19]. Odatdagi sharoitda binafsha yo‘ldoshlar
intensivligi qizil yo‘ldoshlar intensivligidan kichik bo‘ladi. Bunga sabab shundan
iboratki moddaning uyg‘onmagan atom va molekulalar soni uyg‘ongan atom va
molekulalar sonidan ko‘p bo‘ladi.
Temperaturaning oshishi bilan binafsha yo‘ldoshlar intnsivlig tez oshadi.
Bunga sabab shundan iboratki, bu holda moddaning uyg‘ongan atom va
molekulalar soni temperatura oshishi bilan tez oshadi. Qizil yo‘ldoshlar
intensivligi temperaturaning oshishi bilan sezilarli o‘zgarmaydi yoki biroz
kamayadi.
Yorug‘likning kombinatsion sochilish mumtoz nazariyasini rus olimlari G.S.
Landsberg va L.I. Mandelshtam yaratdilar[3]. Bu nazariyaning mohiyat
quyidagidan iborat. Yorug‘likning elektr maydon kuchlanganligi (E) ta’siri ostida
molekula ichidagi elektronlar tebranib molekula kattaligi P= E ga teng bo‘lgan
dipol momentiga ega bo‘ladi. Mumtoz nuqtai nazarga asosan molekulaning
qutblanuvchanligi uni atom yadrolarining oniy vaziyati bilan aniqlanadi.
Yadrolarning o‘zi tinch turmasdan bilki tartibsiz harakatda bo‘ladi. Shu sababli
qutblanuvchanlik doimiy qolmasdan balki vaqt bo‘yicha o‘zgaradi. Buni
chastotalari atom yadrolarining tebranishi bilan aniqlanadigan garmonik
tebranishlarning ustma-ust tushishi ko‘rinishida tasavvur etish mumkin. Bu
chastotalar molekulaning xususiy infraqizil chastotasi bilan mos tushadi. Natijada
induksiyalangan dipol momentlarining (R) modulyasiyasi yuzaga keladi. Agar
tashqi elektr maydoni E vaqt bo‘yicha chastota bilan garmonik qonun bilan
o‘zgarsa u holda R dipol momentining tebranishlarida
±
inf kombinatsion
chastotalar hosil bo‘ladi. Xuddi shunday chastotalar bu dipol momentlarning
nurlanishlarida ya’ni sochilgan yorug‘liklarda ham hosil bo‘ladi [2,3,16,18].
Bu bayon etilgan mulohazani matematik usulda quyidagi ko‘rinishda
ifodalash mumkin. Agar molekuladagi yadrolar soni N ga teng bo‘lsa, u holda bu
molekulalarning erkinlik darajasi 3N ga teng bo‘ladi. Bundan uchtasi ilgarilanma
va yana uchtasi molekulaning aylanma harakatiga tegilshi bo‘ladi. Qolgan N=3N-6
erkinlik darajalari molekula yadrolarining ichki harakatiga ya’ni tebranma
32](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_32.png)
![harakatiga mos kladi. Yadrolarning ichki harakatini tavsifi uchun N 1
koordinatalar
ya’ni q
1 , q
2 , q
3 , q
4 ,… q
N kerak bo‘ladi. Yadro muvozanat holatida bo‘lganda barcha
koordinatalar nolga teng. Muvozanat holatidan ozroq chetlashganda issiqlik
harakati paytida har ibr q koordinata erkin garmonik tebranishda bo‘ladi. Bunday
tebrinish uchun
q=acos (Ω
u t+ )… (1.51)
uning infraqizil astotasi Ω ga teng bo‘ladi va xaotik ravishda o‘zgaradigan fazaga
ega bo‘ladi. Tebranishni kichikligi tufayli qutblanuvchanlik tenzori ni qatorga
yoyib q ni birinchi darajali hadlari bilan kifoyalanish mumkin, soddalik uchun ni
skalyar deb qabul qilamiz:
α= α0+∑ (
∂α
∂q)q...
(1.52)
Agar bu tenglikni e’tiborga olsak
α= α0+∑ (
∂α
∂q)a⋅cos (Ωut+δ)=α0+1
2∑ (
∂α
∂q)a⋅ei(Ωui+δ)+1
2
1
2∑ (
∂α
∂q)a⋅e−i(Ωui+δ)
(1.53)
E = E 0⋅e
iωt
....
(1.54)
Natijada molekulaning dipol momenti quyidagicha aniqlanadi.
P=α0E0
iωt +
E0
2 ∑ (
∂α
∂q)a⋅e
i[(ω+Ωu)i+δ]
+
E0
2 ∑ (
∂α
∂q)a⋅e
i[(ω−Ωu)i−δ]
...
(1.55)
Bu tenglikdan ko‘rinadiki sochilgan nurlanishda faqat tushuvchi nur
chastotasi ga ega bo‘lgan yorug‘lik emas, balki
ω±Ωu kombinasiyaga ega
bo‘lgan chastotali yorug‘lik nurlari ham hosil bo‘ladi. Alohida molekulalar
tomonidan sochiladigan to‘lqinlar o‘zaro kogerentemas, chunki yadrolarning
tebranishlarni issiqlik uyg‘onishida va bir molekuladan ikkinisisga va bir
tebranishdan ikkinchisiga o‘tishidan fazalar o‘zgarishi davriy bo‘lmaydi. Qizil va
binafsha yo‘ldoshlarning intensivligklari o‘rtasida kvant nazariyasiga asosan
quyidagicha bog‘lanish mavjud.
33](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_33.png)
![Iкизил = Iбинафша exp (
ηℏ|Ω nm|
kT ) (1.56)
Ω nm =
E n− E m
η
(1.57)
bunda E
n va E
m molekula foton bilan to‘qnashganda uni n ni sathdan m sathga
o‘tishdagi energiyalarini ifodalayi E
n > E
m bo‘lsa binafsha yo‘ldosh hosil bo‘ladi.
E
n < E
m , bo‘lsa qizil yo‘ldosh hosil bo‘ladi. bunda N
n , E
n
Iкизил
Iбинафша
=
N n
N m
(1.58)
sathdagi molekulalar soni, N
m – esa E
m sathdagi molekulalar sonidir. Optikada
spektr deb biror manbaning nurlanishini ifodalovchi monoxromatik tebranishlar
chastotalarining yig‘indisiga aytiladi. Spektr grafik usulda nurlanish
intensivligining chastota bo‘yicha taqsimlanishi ko‘rinishida ifodalanadi [12-16].
Spektr asosan uch xil bo‘ladi.
1). Yalpi yoki tutash spektr
2). Chiziqli yoki diskret spektr
3). Yo‘l-yo‘l spektr
Yalpi spektrni qattiq jismlarni qizdirganda hosil qilish mumkin. Chiziqli
spektrni gazlar yoki bug‘lar hosil qiladi. Yo‘l-yo‘l spektr suyuqliklarda hosil
bo‘ladi.
Monoxromatik nurlanish elektronni garmonik tebranishi natijasida hosil
bo‘ladi. Elektronni xususiy tebbranish chastotasi
0 va atomning dipol momenti R
0
ga teng bo‘lganda bunday nurlanish intensivligi quyidagi formula yordamida
aniqlanadi.
I= (ω 0
4/3 с3)Р 0
2 (1.59)
ya’ni bu holda nurlanish chastotasi
0 elektronning xususiy tebranish astotasiga
mos keladi[12]. Tebranish so‘nuvchi bo‘lganda uning amplitudasi vaqtning o‘tishi
bilan quyidagi eksponensial qonun bo‘yicha kamayadi.
34](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_34.png)
![E (t)= E 0e
−γ
2cos (ωt +ϕ ) (1.60)
Bunda
2q2ω02
3mc 3 va ω 2= ω 0
2− γ2
4 q - elektronning zaryadini ifodalaydi. m –
uning massasi,
0 so‘nmaydigan tebranishlar chastotasi. Umumiy holda tebranish
tenglamasini quyidagicha ifodalash mumkin.
E = E 0(t)cos [ωt − ϕ(t)] (1.61)
Agar E
0 (t) amplituda va
(t) faza chastotaga ega bo‘lgan asosiy tebranishlarga
nisbatan vaqt bo‘yicha sekin o‘zgarsa u holda bu tenglik bilan ifodalanadigan
to‘lqinlarga kvazimonoxromatik to‘lqinlar deyiladi. Yorug‘lik to‘lqinining
murakkab impulsi uni alohida tashkil etvchilarga ajratuvchi asbob – spektrograf
yoki spektrometrga tushsa, u holda bu asbob chekli kenglikka ega bo‘lgan spektral
chiziqni qayd etadi, chunki berilgan yorug‘lik to‘lqini katiy monoxromatik
bo‘lmasdan balki unga biror I( ) spektral taqsimlanish mos keladi. Bunga sabab
shundan iboratki yukoridagi formula bilan ifodalanuvchi to‘lqin davriy jarayonni
ifodalamaydi, chunki tebranish amplitudasi vaqtga bog‘liqdir. H aqiqatandan ham
xulosa qilish mumkinki, so‘nuvchi tebranish yalpi spektrni beradi. Buni isbotlash
uchun davriy bo‘lmagan funksiyani yoyilmasini Furye integralida hisobga olamiz
va bu holda integrallash barcha chastotalar bo‘yicha amalga oshiriladi [13-14].
Endi E(t) ni Furye integraliga yoyamiz
E(t)= ∫
−∞
∞
E(ω )e−iωt dω (1.62)
monoxromatik tashkil etuvchi E(
) quyidagicha aniqlanadi.
E(t)=−
1
2π ∫
−∞
∞
E(t)eiωt dt (1.63)
Agar t<0 bo‘lsa E(t)=0 bo‘ladi va (1.63) tenglikka asosan
E(t)=
1
2π ∫
−∞
∞
E(t)eiωt dt (1.64)
Bu formulaga E(t)=E
0 e -
t/2
ni qiymatni qo‘yib quyidagi ifodani hosil qilamiz
35](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_35.png)


![I= I0
(γ/2)2
(γ/2)2+ x2 (1.78)
Bunda x – kontur markazidan boshlab hisoblanadigan masofa. Atomlar bir-biri
bilan to‘g‘nashganda tebranishlar yutilish tufayli so‘nadi. Tebranishni yutuvcha
har bir atomni ulushi spektral chiziq konturiningbarcha qismlarida bir xil bo‘lsa,
bunday kengayishga bir jinsli kengayish deyiladi. Bunday kengayishga tabiiy va
loorenscha kengayishni misol qilib ko‘rsatish mumkin [12-17]. Bir jinsli
kengayishda har bir atomga mos keladigan nurlanish chizig‘ining shakli bilan
o‘zaro mos tushadi. Agar bu shart bajarilmasa kengayish bir jinsli bo‘lmaydi.
1.4-§. Vodorod bog‘lanishli komplekslarning elektro-optik parametrlarni
noempirik hisoblash
Bugungi kunda zamonaviy noempirik hisoblash usullari molekulalarning
geometrik va elektron tuzilishi, tebranish chastotalarini va spektroskopik
xarakteristikalarini aniqlash imkonini beradi. Shu munosabat bilan hisoblash
usullari juda tez suratlar bilan rivojlanmoqda. Bu usullar yordamida
molekulalarning geometrik strukturalari, energiyalari, dipol momenti, o‘tishlar
orasidagi va tebranishlar chastotalarini hisoblash imkoniyatlari paydo bo‘ldi.
Tajriba yo‘li bilan olish mumkin bo‘lmagan natijalarni ham hisoblash yo‘li bilan
aniqlash imkonini beradigan va juda tez ishlaydigan kompyuterlar paydo bo‘lishi
bilan bu sohaga yanada qiziqish kuchaydi[21]. Hisoblash usullari
takomillashtirilib, bugungi kunda murakkab sistemalarning tuzilish mexanizmlari
to‘g‘risida ma’lumot olishda bu usullardan keng foydalanib kelinmoqda.
Noempirik hisoblashlar natijasida tajribalarda olingan natijalarni tekshirish
orqali turli xil molekulalarning xarakteristikalarini aniqlash imkoniyatlari paydo
bo‘ldi, bundan tashqari agregatlangan bog‘lanishlarda molekulalarning fazoviy
tuzilishi va oriyentasiyasini aniqlash imkonini beradigan usullar yaratildi. Shunday
qilib, turli molekulyar brikmalarni nazariy hisoblashlar orqali tushuntirish bugungi
kunda gaz va suyuq holatlar fizikasining eng dolzab vazifalaridan biri bo‘lib qoldi.
38](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_38.png)
![Amaliy masalalarni hisoblashlar o‘tkazish orqali hal qilish jarayonida
quyidagi masalalarga e’tibor qaratish talab etiladi:
Tayyor dasturlar asosida o‘tkaziladigan noempirik hisoblashlar usulini
tanlab olish. Molekulaning termodinamik va spektroskopik parametrlarini
aniqlaydigan zamaonaviy noempirik hisoblashlarning aniqlik darajasi. Elektron
tuzilishini o‘rganishda va amaliyotda noempirik hisoblashlar natijalaridan
foydalanish darajasi.
Umumiy qilib aytganda, noempirik hisoblashlar taklif qilingan modelning
o‘lchangan natijalar bilan adekvatligini ta’minlash uchun molekulyar sistemalarda
ma’lum bir yaqinlashishlar orqali Shredinger tenglamasining yechimini topish
jarayoni deb qarash mumkin[22-23]. Tajriba orqali olish mumkin bo‘lmagan,
murakkab molekulyar tuzilmalarning va effektlarning xossalarini hisoblash uchun
ko‘pincha noempirik hisoblashlar – «ab initio» (lotinchadan «Boshlang‘ich»)
qo‘llaniladi. Noempirik hisoblashlar asosiy usullari Xartri-Fok-Rutan sxemasiga
asoslanadi. Xartri-Fok-Rutan sxemasidagi murrakabliklarni kamaytirish uchun
juda ko‘pchilik holatlarda elektron korrelyasiya inobatga olinadi[21].
Zarracha holatini tariflashda, zarrachaning har bir vaqtda fazodagi (x, y, z)
koordinatalarini aniq qiymati va impulsning uqlar buyicha tashkil etuvchilari (R
x ,
R
y , R
z ) ning aniq qiymatlarini aniqlash tamoyilidan kelib chiqadi. Shu bilan uning
harakat traektoriyasini ifodalovchi chiziqni kursatishi mumkin bo‘ladi.
Real zarrachalar – mikroobektlar (elektron, atom, molekulalar) ularning
maxsus tabiatiga ko‘ra va fizikada ularga mos keluvchi obektlarni mavjud emasligi
tufayli, tariflash mumkin emas. Mikroobyektlarning koordinata va impulslarni bir
vaqta o‘lchash paytida ularning qiymatlarida xatoliklar (aniqmasliklar) ro‘y beradi.
Xatoliklar bir vaqtda istalgan kichik bo‘lishi mumkin emas, va koordinata
qanchalik kichik xatolik bilan o‘lchansa, shunchalik katta xatolik bilan impuls
o‘lchangan bo‘ladi. Noempirik hisoblashlarni o‘tkazish vaqtida juda katta
integrallarni yechishga to‘g‘ri keladi. Hisoblashlar sikllik ravishda o‘tkaziladi,
ya’ni kompyuter ta’minlashi mumkin bo‘lgan chegaraviy aniqlikga ega
bo‘limaguncha jarayon takrorlanaveradi.
39](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_39.png)
![Suyuq muhitlarda vodorod bog‘lanish va Van - der - vaals molekulalararo
o‘zaro ta’sirlar orqali hosil bo‘ladigan mol e kulyar agr e gatlarni o‘rganishda,
hisoblashlar o‘tkazish yo‘li bilan ularning “ sp e ktri , tuzilishi va xossalari ” orasidagi
bog‘lanishlarni o‘rnatish hamda molekulalararo o‘zaro ta’sirlarni , molekulalar
agr e gatlanishini va ularni o‘rab turgan muhitning molekulaning sp e ktral
param e trlariga ta’sirini o‘rganish juda katta amaliy ahamiyatga ega .
Noempirik hisoblashlar orqali aniqlangan natijalardan spektroskpik usul
bilan olingan natijalar bilan taqqoslashda, o‘rganilgan moddalardan amaliyotda
foydalanish jarayonlarida keng qo‘llaniladi. Bundan tashqari suyqliklarning
dinamik-tuzilish xarakteristikalarini aniqlashda, komplekslar hosil bo‘lish
jarayonini o‘rganishda amaliyotda o‘z tadbiqini topadi.
1970-1980 yillarda hisoblash usullari juda tez suratlar bilan rivojlandi.
Natijada geometrik strukturalarni, energiyalarni, dipol momentlar, o‘tishlar
orasidagi va tebranishlar chastotalarini hisoblash imkoniyatlari paydo bo‘ldi.
Tajriba yo‘li bilan olish mumkin bo‘lmagan natijalarni ham hisoblash yo‘li bilan
aniqlash imkonini beradigan va juda tez ishlaydigan kompyuterlar paydo bo‘lishi
bilan bu sohaga yanada qiziqish kuchaydi[22]. Hisoblash usullari
takomillashtirilib, bugungi kunda murakkab sistemalarning tuzilish mexanizmlari
to‘g‘risida ma’lumot olish uchun bu usullardan keng foydalanib kelinmoqda.
Noempirik hisoblashlar natijasida tajribalarda olingan spektrlarni tekshirish
orqali turlicha agregatlarning molekulyar xarakteristikalari aniqlash imkoniyatlari
paydo bo‘ldi, bundan tashqari agregatlangan bog‘lanishlarda molekulalarning
fazoviy tuzilishi va oriyentatsiyasi aniqlash imkonini beradigan usullar yaratildi.
Shunday qilib, molekulalararo komplekslar modelida tajriba natijalari nazariy
hisoblashlar orqali tushuntirish bugungi kunda gaz va suyuq holatlar fizikasining
eng dolzarb vazifalaridan biri bo‘lib qoldi.
Suyuq muhitlarda, tanlab olingan ob' e ktlar uchun, vodorod bog‘lanish va
Van-der-vaals mol e kulalararo o‘zaro ta’sirlar orqali hosil bo‘ladigan mol e kulyar
agr e gatlarni o‘rganishda yangi eksp e rim e ntal tadqiqotlar va kvanto-ximik
hisoblashlar o‘tkazish yo‘li bilan ularning “sp e ktri, tuzilishi va xossalari”
40](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_40.png)
![orasidagi bog‘lanishlarni o‘rnatish hamda mol e kulalararo o‘zaro ta’sirlarni,
molekulalar agr e gatlanishini va ularni o‘rab turgan muhitning molekulaning
sp e ktral param e trlariga ta’sirini o‘rganish juda katta amaliy ahamiyatga ega.
Amaliy masalalarni noempirik hisoblashlar o‘tkazish orqali hal qilish jarayonida
quyidagi masalalarga e'tibor qaratish talab etiladi:
Tayyor dasturlar asosida o‘tkaziladigan noempirik hisoblashlar usulini
tanlab olish. Molekulaning termodinamik va spektroskopik parametrlarini
aniqlaydigan zamaonaviy noempirik hisoblashlarning aniqlik darajasi.
Molyekuliyar tuzilishini o‘rganishda va amaliyotda hisoblashlar natijalaridan
foydalanish darajasi.
Noempirik hisoblashlar bilan spektroskopik usullar bir-birini to‘ldirgan
holda o‘rganilayotgan ob'yekt to‘g‘risida to‘liq ma’lumot olish imkoniyatini
yaratadi. Umumiy qilib aytganda, noempirik hisoblashlar taklif qilingan modelning
o‘lchangan natijalar bilan adekvatligini ta’minlash uchun molekulyar sistemalarda
ma’lum bir yaqinlashishlar orqali Shredinger tenglamasining yechimini topish
jarayoni deb qarash mumkin.
Noempirik hisoblashlarning kelib chiqish tarixiga bir nazar tashlasak, bu
sohada o‘tgan asrning o‘rtalarida rivojlanish bosqichiga o‘tganligini guvohi
bo‘lamiz. Bu soha atom va molekula tuzilishi to‘g‘risidagi fundamental bilmlar
Plankning nurlanishning kvantlanishi haqidagi g‘oyasidan keyin bu sohada yangi
bosqich paydo bo‘ldi. Atom va molekulalar tuzilishi to‘g‘risidagi muammolar
kvant mexanikasida De-Broyl, Shredinger, Diran va boshqalarning ishlaridan
keyin juda tez rivojlandi. Kvant mexanikasi yadro-elektron sistemalar tuzilishini
aniqlash va ular xossalarini hisoblash usullarini yaratilishiga asos bo‘ldi.
Molekulalarda elektron va yadrolar harakatini ajratish Born va Oppengeymer
(1927) va boshqalarning ishlarida asoslab berildi.
Tajriba orqali olish mumkin bo‘lmagan, murakkab molekulyar
tuzilmalarning va effektlarning xossalarini hisoblash uchun ko‘pincha noempirik
hisoblashlar – «ab initio» (lotinchadan «Boshlang‘ich») qo‘llaniladi[24].
41](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_41.png)
![Noempirik usul - tajriba natijalaridan foydalanmagan holda atom va
molekulalarning energetik sathlari va to‘lqin funksiyasini aniqlashga imkon
beruvchi Shredinger tenglamasini biror yaqinlashishda yechish usullari orqali
amalga oshiriladi. Bu usullar yordamida berilgan elektronlar soniga asoslanib,
sistemaning kvant-mexanik holati aniqlanadi[24-26]. Molekuladagi hisoblashlar
adiabatik yaqinlashishda amalga oshiriladi, ya’ni energiya va to‘lqin funksiyasini
aniqlash masalalari yadrolarning fazodagi belgilangan holati bo‘yicha alohida-
alohida yechiladi. Bu usullar turli xil masalalar uchun turlicha shaklga ega bo‘lishi
mumkin. Misol uchun, molekulada teng og‘irlikdagi yadro konfigurasiyalari uchun
dipol momenti, elektron uyg‘onish energiyasi yoki elektronlar zichligini hisoblash
uchun bitta elektron masalani yechish kifoya qiladi. Molekuladagi yadrolarning
teng og‘irlikdagi konfigurasiyasini aniqlash uchun esa, sirt potensial
erengiyasining minimumini topish kerak bo‘ladi, bu esa har bir nuqta bo‘yicha turli
xil yadro konfigurasiyalari uchun elektron masalani bir necha marta yechishni
talab qiladi. Nisbatan to‘liq hisoblashlar quyidagi ketma-ketlik bo‘yicha amalga
oshriladi. Tadqiq qilinayotgan obyektning elektron holati aniqlanadi va har bir
holat yoki holatlar sistemasi hisoblashlar bazisini hosil qiluvchi orbitallar beriladi.
Elektron energiyasi va to‘lqin funksiyasi hisoblanadigan molekula yadrolarning
geometrik konfigurasiyalari to‘plami ajratib olinadi. Masalan NCl molekulasining
dissosiasiya energiyasini topish uchun eng kamida teng og‘irlikdagi atom yadrosi
va yetarlicha katta bo‘lgan ikkita masofa uchun elektron masalani yechsh kerak.
Hisoblashlar jarayonida, misol uchun teng og‘irlikdagi izomerlar yoki o‘tishlar
holatlarini qidirishda, yadrolarning geometrik konfigurasiyalari to‘plami o‘zgarishi
mumkin. Har bir yadro konfigurasiyalari uchun quyidagi umumiy ko‘rinishdagi
molekulyar integrallar hisoblanadi:∫ ϕa(1)A
~
(1)ϕb(1)dτ 1
qisqacha ko‘rinishda ⟨ϕa|A
~
|ϕb⟩
Bu yerda,
A - bir elektronli operator bo‘lib, bu integrallar har bir elektron
holat energiyasini baholash va molekulyar orbitallarni topish imkonini beradi.
Bundan keyin, variasion usullar yordamida elektronlar harakatining
42](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_42.png)
![muvofiqlashtirilganligi – elektron korrelyasiyani hisobga olgan holda ma’lumotlar
aniqlashtiriladi. Buning uchun esa, valent bog‘lanishlar usuli ishlatiladi. Olingan
ko‘p elektronli to‘lqin funksiyasi molekula xossalarini, misol uchun dipol yoki
kvadrupol momentlari, qutblanganligini va boshqalarni hisoblash imkonini beradi
[22].
Ushbu keltirilgan hisoblashlar amalga oshirilgandan keyin molekulalarning
har bir elektron holati uchun yadrolarning teng og‘irlikdagi geometrik
konfigurasiyalari topiladi. Bu holatlar uchun tenglamlar yechimlari to‘g‘risidagi
nazariya keyingi paragrafda batafsil keltirilgan.
Bugungi kunda noempirik hisoblash usullari molekula tuzilishi va o‘zaro
joylashishi hamda ularning elektromagnit nurlanish bilan o‘zaro ta’sirlashishini
yetarli darajada o‘rganish imkonini beradi. Kichik molekulalar uchun noempirik
hisoblashlar aniq natijalar berib, ayrim hollarda tajriba natijalaridan ham
ustunlikka ega bo‘ladi. Hisoblash qurilmalari – kompyuterlarning rivojlanishi
sababli yetarlicha murakkab sistemalar, misol uchun kislotali birikmalarning ham
xossalarini hisoblash imkonini yaratdi. Bu birikmalarda olingan spektroskopik
tajriba natijalarini tasdiqlash va suyuq holatlarda agregatlarning hosil bo‘lish
mexanizmlarini izohlashda katta qulayliklar tug‘dirmoqda [23].
Noempirik hisoblashlar natijasini spektroskopik usullar yordamidagi
tadqiqotlar natijalari bilan solishtirish orqali o‘rganilayotgan sistemaning tabiati va
o‘ziga xos tomonlarini yetarli darajada tushuntirish mumkin bo‘ladi. Hisoblashlar
jarayonida o‘rganilayotgan sistema modellashtiriladi va real tajribalarda olingan
natijalarga asosan hisoblashlar amalga oshriladi.
Taklif qilingan modelning o‘lchangan tajriba natijalariga mosligiga erishish
uchun aniqlangan yaqinlashish doirasida molekulyar sistema uchun Shredinger
tenglamasini yechish orqali amalga oshiriladi.
Shredingerning elektron tenglamasi yechimini fizik-matematik qonunlarga
asoslangan Xartri-Fok yoki boshqa bir elektron korrelyasiyani hisobga oluvchi
usullar yordamida olish mumkin. Buning uchun esa fundamental fizik doimiylar va
atom yadrolarining soni va tarkibini bilish talab qilinadi. Birinchi navbatda, Born-
43](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_43.png)
![Oppengeymer yaqinlashishini qo‘llab, yadrolar koordinatalari ko‘rinishida
molekula tuzilishi beriladi, shundan keyin, molekulyar orbitallar yaqinlashishi
tanlanadi va atom orbitallari tasvirlovchi analitik funksiya tanlanadi. Bu
funksiyaga «bazis funksiya» yoki oddiy qilib «bazis» deyiladi. Shu bilan tashqi
ma’lumotlar chegaralanadi va zarur integrallarni hisoblash orqali o‘zaro
moslashgan hisoblashlar amalga oshiriladi.
Zarur hollarda molekulaning simmetriyasi inobatga olinadi. Molekulyar
orbitallarning bunday hisoblash usuli noempirik yoki ab initio deb ataladi [23].
Hisoblashlarning murakkablik darajasi turlicha bo‘lishi mumkin:
hisoblashlarda to‘liqliq darajasini oshirish uchun uyg‘ongan elektron
konfigurasiyalarini qo‘llash mumkin yoki bo‘lmasa Xartri-Fok usuli bilan
cheklanish ham mumkin. Noempirik hisoblashlarda qo‘llaniladigan bazis
funksiyalar soni ham turli xil bo‘lishi mumkin. Barcha hisoblashlarning maqsadi
qo‘llanilayotgan kompyuter darajasi orqali aniqlanadi [22-23]. Noempirik
hisoblashlar bugungi kunda turli xil bazis qatorlariga ega bo‘lgan Xartri-Fok
sxemasiga asoslanadi. Molekulyar sistemaning xossalarini aniqlash bazis qatori va
korrelyasion effektlarga monoton bog‘liq bo‘ladi [25-26].
Misol uchun, noempirik hisoblashlar o‘tkazish mumkin bo‘lgan GAUSSIAN
[24] dasturida turli xil atom orbitalari-bazislar to‘plamini tanlash imkoniyati
mavjud. Noempirik hisoblashlar o‘tkazish uchun mo‘ljallangan barcha dasturlarda
gauss tipidagi orbitallarga ega bazislar to‘plami qo‘llaniladi. Har bir atom orbitali
elektron zichligi taqsimlangan bir nechta gauss funksiyalari deb tasavvur qilinadi.
Shunday qilib, noempirik hisoblashlarning asosiy maqsadi molekula tuzilishi
va energiyasini bashorat qilishdan iboratdir. Hisoblash usulini tanlash
qo‘yidagilarni aniqlashga qaratilgan bo‘ladi:
teng og‘irlikdagi geometrik tuzilish;
to‘liq elektron energiya;
potensial sirtdagi lokal minimumga to‘g‘ri keluvchi garmonik chastotalar
to‘plami.
44](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_44.png)
![Ushbu keltirilgan natijalarni hisoblash quyidagi ketma-ketlikda amalga
oshiriladi: birinchi bo‘lib, boshlang‘ich geometrik tuzilish bitta determinantli
Xartri-Fok usuli bilan 6-31G* (HF/6-31G*) bazislar to‘plamida amalga oshiriladi.
Zaryadlar, dipol moment hisoblanadi va oxirgi qadamda garmonik chastotlar va
umumiy energiya hisoblanadi. Chastotlar 6-31G*(Xartri-Fok strukturasi) [6] orqali
hisoblanib, nazariyaga asosan tajriba natijalari bilan mos kelishini ta’minlash
maqsadida 0.8929 faktorga ko‘paytiriladi[24].
1926- yild a M . Bornning (1882-1970) ko‘rsatishich a to‘lqin qonuniyat bil a n
ehtimollik o‘zg a rm a sd a n , b a lki ehtimollikning a mplitud a si o‘zg a r a di .
Ehtimollikning a mplitud a si f a zoning koordin a t a l a ri v a v a qtg a bog‘liq bo‘lg a n ( x ,
y , z , t ) to‘lqin funktsiya orq a li ifod a l a n a di . Ehtimollik a mplitud a si m a vhum
bo‘lishi mumkin . Shuning uchun ehtimollik , uning modulining kv a dr a tig a
proportsion a l [22].
W ( x , y , z , t ) 2 (1.79)
Dem a k , De - Broyl to‘lqini a mplitud a sining kv a dr a ti f a zoning a yni nuqt a sid a
mikroz a rr a ni q a yd qilish ehtimolligini ifod a l a ydi . Shund a y qilib ,
mikroz a rr a ch a ning hol a tini to‘lqin funktsiya bil a n ifod a l a sh st a tistik yoki
boshq a ch a a ytg a nd a ehtimollik x a r a kterig a eg a. To‘lqin funktsiya qiym a tining
kv a dr a ti z a rr a ch a ni t v a qt momentid a f a zoning koordin a t a l a ri x v a x + dx , y v a
y + dy , z v a z + dz soh a sid a topilish ehtimolligini ko‘rsat a di [22]. Kv a nt
mex a nik a sid a z a rr a ch a ning hol a ti butunl a y yangich a, ya’ni z a rr a ch a ning h a m
to‘lqin , h a m korpuskulyar xususiyatini o‘zid a muj a ss a ml a shtirg a n to‘lqin funktsiya
orq a li ifod a l a n a di . Z a rr a ch a ni h a jmning dv bo‘l a kch a sid a bo‘lish ehtimolligi
dW =
2 dV (1.80)
ko‘rinishd a ifod a l a n a di . Bund a - funktsiya qiym a tining kv a dr a ti
2
=
dW
dV (1.81)
ehtimollik zichligini bildir a di . Bu y erd a shuni n a z a rd a tutish ker a ki , -
funktsiyaning o‘zi fizik m a nog a eg a bo‘lm a sd a n , uning qiym a tining kv a dr a ti fizik
45](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_45.png)


![II. BOB. TADQIQOT OB’EKTINI TANLASH VA NOEMPIRIK
HISOBLASH USULLARI
2.1-§. Tadqiqot obyektini tanlash va ularni tadqiqot o‘tkazishga tayyorlash
Kislotalarda molekulalararo ta`sirni o‘rganish karbon kislotalarini,
model sistema sifatida qaralib, aloqa qonuniyatini paydo bo‘lishi va
xarakterli tarizda kuchli assotsiyatlarda suyuq holatda fazoda
suyuqliklar molekulasini aniqlashda muxum ahamiyatga ega. Bu
muammo disirtatsdiyada bir qancha kislotalar misolida echilib,
karbonli kislotalar ideal sistema sifatida ko‘rib chiqildi. Oxirgi vaqtlarda
adabiyotlarda ushbu tadqiqot sohasida muhum ahamiyatga ega
bo‘lgan ishlar taqdim qilingan. Suyuq holatdagi moddalar ustida
o‘tkazilgan tadqiqot ishlari har xil, yani biologiya sohasida meditsina
sohasida bular qatorida zamonaviy molekulyar spektroskopiya
sohasida o‘rganish uchun imkoniyat yaratdi. Kislotalarni o‘rganish
tadqiqotlari molekulalarning o‘zaro ta`siri va moddalarning
strukturasini turli kondensatsiya xolatidagi xususiyatlarini o‘zida
mujassamlashtirgan. Kiskotalarning statik ahamiyati dielektirik
singdiruvchanligi bilan harakterlanadi. Molekulalarning kuchli spetsfik
o‘zaro ta`siri molekula ustda murakkab sruktura toza kislotalarda va
kislota qorishmalarida, uni suyuq suv bilan aralashtiriladi.
Kislatolar juda sodda model sistema bo‘lib, biologik
makromolikulalarning o‘rganishi uchun o‘rganiladi. Suyuq kislotalarda
molikulalararo o‘zaro ta`siri [10] adabiyotda keltirilgan. Bu
dissertatsiya ishida biz karbon kislotalarining xususiyati va
48](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_48.png)

![5-rasm. a) chumoli, b) sirka, va c) propion kislotalarining kimyoviy
sturukturasi va formulasi.
Chumoli kislota HCOOH — o‘tkir hidli, rangsiz suyuqlik, 101 °C da qaynaydi.
Suvda istalgan miqdorda eriydi. Terini kuydiradi. U chumoli bezlaridan ajralib
chuqadigan suyuqlik tarkibida, shuningdek ba’zi o‘simliklarda (masalan, qichitqi
o‘t barglarida) bo‘ladi.
Kimyoviy xossalari. Kimyoviy xossalari jihatidan chumoli kislota barcha karbon
kislotalar orasida eng reaksiyaga kirishuvchisi hisoblanadi. Bung sabab shuki,
uning karboksil gruppasi uglevodorod radikali bilan emas, balki vodorod bilan
bog‘langan.
Ishlatilishi . Chumoli kislota kimyo sanoatida organik moddalar sintez qilishda
qaytaruvchi sifatida, shuningdek oksalat kislota olish uchun: oziq-ovqat sanoatiga
— dezinfeksiyalovchi va konservalovchi vosita sifatida; to‘qimachilik sanoatida —
gazlamalarni bo‘yashda, tibbiyotda — revmatizm (bod) kasalligida teriga surtib
ishqalash uchun keng ko‘lamda ishlatiladi.
Sirka kislota odatdagi temperaturada — o‘ziga xos o‘tkir hidli rangsiz suyuqlik. U
+16,6 °C dan past tem peraturada muzga o‘xshash kristallar holida qotadi, shu
sababli muz sirka kislota deyiladi. Sirka kislota suvda istalgan miqdorda eriydi,
uning suvdagi 3 — 9% li eritmasi sirka deyiladi va ovqatga qo‘shish uchun
ishlatiladi. 70 — 80% li sirka kislota sirka essensiyasi deyiladi[28-29].
O‘rganilgan moddalarni fizikaviy va kimyoviy xossalari.
2-jadval
№ Moddaning
nomi Kimyoviy
tuzulishi М N T
0
С
( D )
1 Sirka kislota
60,05 1,37 118,1 6,15 1,74
50](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_50.png)
![2 Chumoli kislota
46,03 1,37 100,7 57,0 1,41
2.2 §. Tajriba qurilmasi, noempirik hisoblashlar dasturlari va
ularning tavsifi
Spektrlar difraktsion panjarali DFS-52 spektrometrida qayd qilingan.
Yorug lik manbai sifatida LGN-503 (λ=488 nm) argon lazeridan foydalanilgan.ʼ
Polosalarning yarim kengligi va maksimumlarni nisbiy aniqlash xatoliklari ( 0.3
sm -1
) keltirilgan. IQ va KS yutilish spektrlarini bir qismi Thermo Nicolet 6700
FTIR/FT-Raman spektrometrida qayd qilingan. Uyg otuvchi yorug lik
ʼ ʼ
manbaining to lqin uzunligi λ=514 nm, λ=488 nm, diapazonlari 525÷4500 sm
ʼ -1
,
detektori MCT-A (LN2 sovutish tizimi) va 375÷4500 sm -1
, detektori DTGS TEC
(RT). Spekrometrlar suyuq, kristall va polikristal moddalarda kombinatsion
sochilish konturini olish va qayd qilish uchun muljallangan. Shuningdek bu
spektrometr molekulyar - spektraskopiya oblastida fizika ximiyaviy tekshirishlar,
ya’ni suyuqliklar suv aralashmalari, kristallar, plyonkalar tarkibi tuzulishini
o‘rganishga muljallangan [31-32].
Ishlash prinsipi. Tekshirilgan namunani monoxromatik yorug‘lik bilan
nurlantirganda sochilgan yorug‘likning spektrida kombinatsion sochilish chiziqlari
kuzatiladi. Bu chiziqlarning chastotasi namunaga tekshirilayotgan nur chastotasi
bilan molekulaning xususiy chastotasining kombinasiyasidan iborat bo‘ladi.
Kombinatsion sochilish chizigining intensivligi kichik bo‘lib, ularni qayd qilish
uchun yorug‘likni kam sochuvchi monoxromatlardan foydalaniladi. Shuningdek
shovqin kam yetarlicha stabil bo‘lgan, qayd qilishning sezgir chastotalaridan
foydalanish zarur [32]. DFS-52 spektrometrining uyg‘otuvchi manba sifatida
seriyali lazerlar ishlatildi. Yorug‘likni tekshirish uchun yorug‘likni kam sochuvchi
difraksion panjarali qushaloq monoxromatorlardan foydalaniladi. Spektrni qayd
qilish sovitilib turiladigan fotoelektron kupaytirgichlar yordamida amalga
oshiriladi. Hisoblash qurilmasi spektrlarning ketma-ketligi va spektral
diapozonning berilgan qismiga signallarning ketma-ket qayd qilinishi, olingan
51](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_51.png)
![natijalarning matematik qayta ishlashni va natijalarni qayd qiluvchi asbobga
chiqarishni ta’minlaydi.
DFS-52 spektrometrining tarkibi. Spektrometrning tarkibiga
almashtiriladigan difraksion panjarali qushaloq monoxramator, qabul qiluvchi
blok, yoritish qurilmasi, chastotalar va hisoblash qurilmasiga ega bo‘lgan elektron
qayd qiluvchi qurilma ERU-53, termoelektron sovutgichning blok pitaniyasi,
alfavit raqamli displey va yozuvchi qurulma, programmani tayyorlash sistemasi
IPG-003 ga kiruvchilar, laboratoriya o‘zi yozuvchi asbobi LKS-003, ulash
kabellari va o‘tkazgichlar komplekti, almashtirish va ehtiyot qismlari kiradi [32].
Optik sxemasi. Spektrometrning optik sxemasi yoritish sistemasi, qushaloq
monoxromator va qabul qiluvchi qurulma elementlaridan iborat. Yoritish sistemasi
lazer nurining tekshirilayotgan namuna tekisligiga fokuslanishini ta’minlaydi.
Namunadan sochilgan nurlanishni yig‘adi va uni qushaloq monoxromatorning
kirish tirqishiga yo‘naltiradi. Qushaloq ko‘zguli monoxromator almashtiruvchi
difraksion panjaraga ega bo‘lib u uyg‘otuvchidan 20 sm masofada 8-25 sm/mm
gacha teskari chiziqli dispersiyani ta’minlaydi. Qabul qilish blogining qayd qilish
maydonida monoxromator qorachig‘ining tasvirini beradi. Qabul qilish bloki
taqqoslash kanalining oldiga o‘rnatilgan yorug‘lik o‘tkazgich unga lazer
nurlanishining bir qismini o‘yg‘otadi. DFS-52 spektrometrning optik sxemasi 12 -
rasmda keltirilgan.
Yorug‘lik manbaidan lazerning parallel nurlar dastasi (1) tor yo‘lli
interferension yorug‘lik filtridan, (2) krisovaya difrakmasidan, (3) qutublovchi
plastinkadan, (4) almashtiruvchi obyeklaridan biri orqali namuna (5) tekislikka
fokuslanadi. Namunadan sochilgan nurlanish sferik linza (6) lardan biri orqali
proyeksiyalovchi sistemada to‘planadi va parallel dasta bo‘lib obyektiv (7) dan
iborat proyeksiyalovchi sistema namunaning tasvirini qushaloq monoxromatorning
kirish tirqishi oldidan 2,3 yoki 3,5 marta kattalashtirib beradi.
52](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_52.png)

![foydalanishni ta’minlaydi. O‘tayotgan yorug‘likdagi namunalar bilan ishlash
uchun buruvchi prizma (25) va qisqa fokusli linza (26) ishlatiladi. Bular lazer
nurining kukun yoki suyuqlik uchun muljallangan idishga proyeksiyalaydi.
Plastinka (27) lazer nurining 1.5-2% ni yorug‘liko‘tkazgichining (26) kirishiga
uzatiladi [32].
7 -rasm. DFS-52 spektrometrining funktsional sxemasi.
Yorug‘lik o‘tkazgichi orqali nurlanishni taqqoslash kanalining qabul
qiluvchisiga uzatiladi. Bunda yorug‘lik oqimining intensivligining qupol
regulirovkasi yorug‘lik dastasiga yorug‘lik filtri (29) ni kiritishi bilan amalga
oshiriladi. 7 -rasmda esa DFS-52 spektrometrning funksional sxemasi keltirilgan.
Tajriba orqali olish mumkin bo‘lmagan, murakkab molekulyar
tuzilmalarning va effektlarning xossalarini hisoblash uchun ko‘pincha noempirik
hisoblashlar – «abi- nitio» (lotinchadan «Boshlang‘ich») qo‘llaniladi [30-32] .
Bugungi kunda amaliyotda noempirik hisoblashlar uchun zamonaviy
Gaussian dasturlarini qo‘llab yuqori darajadagi aniqlikga erishish mumkin.
Gaussian ( gaussian ) – molekulyar modellashtirishning turli-tuman usullarini
o‘zida mujassamlashtirgan molekulyar sistemalarning tuzilishi va xossalarini
hisoblashga qaratilgan kompyuter dasturi[24].
54](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_54.png)

![ tadqiq qilinayotgan sistemaning molekulyar mexinika usullari, yarimempirik
yaqinlashishlar, chegaralangan va chegralanmaga Xartri–Fok usuli
yoradamida tuzilishini optimizasiya qilish va energiyasini hisoblash;
korrelyasionnoy energiyani hisobga olish imkoniyatiga ega bo‘lib, analitik
gradiyentlar yordamida g‘alayonlanish nazariyasi, bog‘langan klasterlar,
konfigurasion o‘zaro ta’sir va boshqalar uchun enegiyani hisoblash;
yuqori molekulyar sistemalarni modellashtirish;
kuch doimiylarini RHF, UHF, DFT, RMP2, UMP2 va CASSCF usullar
yordamida analitik hisoblash;
molekulaning spektral xosslarini hisoblash;
tadqiq qilinayotgan sistema uchun eritmaning ta’sirini hisobga olish
imkoniyati va h.k.
Gaussian dasturiy majmuasining kamchiligi sifatida hisoblash vaqtining
kattaligi va hisoblash aparatlariga bo‘lgan talabning yuqoriligini keltirish
mumkin[22].
Hisoblashlar natijalari tadqiq qilinayotgan molekulalar(fazodagi yadrolar
joylashishi) tuzilishi, elektron zichligi, molekula va uning tashkil etuvchilarining
umumiy energiyasi va hakozolar to‘g‘risida juda keng sonli ma’lumotlar
to‘plangan fayl ko‘rnishida bo‘ladi. Shuning uchun Gaussian dasturiy
majmuasining hisoblash natijalarini tahlil qilish o‘rganish uchun maxsus dasturlar
qo‘llaniladi.
To‘lqin funksiyasi xususiy vektorlarning matrisasi ko‘rinishida beriladi.
Bundan tashqari, o‘rganilayotgan molekulalarning boshqa fizik-kimyoviy
xarakteristikalari ham energiyaning har yadro koordinatalari bo‘yicha n-tartibli
hosila orqali aniqlangan bo‘lib, jadval va matrisalar ko‘rinishida beriladi.
Shuning uchun ham hisoblashlar natijalarini tahlil qilish va ulardan
foydlanish juda murrakab jarayon bo‘lib, juda qiyin masala hisoblanadi. Katta
massiv ko‘rinishidagi natija fayllar bilan ishlash uchun maxsus interpretator-
dasturlar ishlatiladi. Bu dasturlar natijalarni birinchi darajada tahlil qilish va
56](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_56.png)
![natijalarni uch o‘lchamli fazoda grafik ko‘rinishida olish imkonini beradi. Bundan
tashqari, keyingi hisoblashlar uchun kirish fayllarini tayyorlash mumkin[24].
Xuddi shunday dasturlardan eng ko‘p ishlatiladiganlaridan biri Gauss View
dasturi imkoniyatlariga qisqacha to‘xtalib o‘tmoqchimiz. GaussView
(http://www.gaussian.com/) dasturi Gaussian dasturiy majmuasi yordamida amalga
oshirilgan kvanto-kimyoviy hisoblash natijalarini interpretasiya qiladi.
Bu dasturning imkoniyatlaridan biri hisoblanayotgan brikmaning
boshlang‘ich geometriyasini ineraktiv rejimda tayyorlash imkoniyatini berib, kirish
faylini (Gauss Job File) hosil qilish va hisoblashlarni kuzatib borish imkoniyatini
beradi.
Dasturning ishchi oynalari quyidagi rasmlarda keltirilgan:
57](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_57.png)
![2.3-§. Tajriba natijalari va noempirik hisoblashlar ni baholash
Noempirik hisoblashlar tajriba olingan natijalarni to‘g‘riligini taqqoslash
bilan birga, ularni tahlil qilishni osonlashtiradi. Turlicha hisoblash usullariga
asoslangan noempirik hisoblashlar uchun ishlatiladigan dasturlar bugungi kunda
ko‘plab yaratilmoqda. Bizning ishimizda qullanilgan hisoblashlar Gaussian 98W
dasturi yordamida Xartri-Fok usulida amalga oshirildi. Xloroform molekulasining
monomer va dimer molekulsining optimizasiyalangan ko‘rinishlari uchun
noempirik hisoblashlar Xartri-Fok usulida 6-31G(d) Gauss funksiyalari yordamida
amalga oshirildi. Energiyalari bo‘yicha optimizasiya tekshirilayotgan obyekt uchun
butun ichki koordinatalar bo‘yicha amalga oshirildi. Normal tebranishlar
chastotalari umumiy energiyadan ikkinchi darajali hosila olish yordamida
hisoblandi[24].
Endi qisqacha, noempirik hisoblashlarning xatoliklariga to‘xtalib o‘tsak,
hisoblash natijalarini tajriba natijalari bilan taqqoslash jarayonida xatoliklar va
yuqorida aytib o‘tganimizdek turli xil ko‘paytuvchilarni bilish muhim ahamiyatga
ega. Barcha noempirik hisoblashlarda xatoliklar qisqa bazis to‘plamlarini
qo‘llaganda oshib ketishi mumkin. Noempirik hisoblashlarda Xartri-Fok usulida
58](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_58.png)
![organik molekulalar uchun DZP yoki 6-311G++: dan kichik bo‘lmagan bazislar
to‘plamida natijalarda quyidagi xatoliklar uchraydi:
- bog‘lanish uzunliklari 0,01 - 0,02 A gacha aniqlikda hisoblanadi.;
- valent burchaklar ~ 1 % gacha aniqlikda;
- energiyalar 2 kkal/mol gacha aniqlikda hisoblanadi.
- elektron zichlik - 10%;
- konformasion o‘tishlar (aylanish) energiyasi - < 2 kkal/mol;
- tebranish chastotlari 10-12 % ga yuqori hisoblanadi. 0,89 ± 0,01
ko‘paytuvchi orqali tajriba bilan mos keltirish mumkin [24-26].
59](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_59.png)
![III-BOB . TAJRIBA VA NOEMPERIK HISOBLASHLAR NATIJALARI
TAHLILI
3.1 §. Chumoli va sirka kislotalaridagi molekulyar agregatsiyalarning hosil
bo‘lishida vodorod bog‘lanishning o‘rni va uni kombinatsion sochilish
spekrlarida namoyon bo‘lishini o‘rganish
Karbon kislotalari molekulalari suyuq holatda turli xil agregatlar hosil qiladi.
Eritmalarda komponentlarning bir xil ulushida agregatlangan birikmalarning soni
oshadi. Neytral eritmalarida turli tipdagi agregatlarining nisbiy tarkibi o‘zgaradi.
Karbon kislotalarida vodorod bog‘lanish tufayli O H polosa 3750 sm -1
dan
2700 sm -1
gacha siljiydi. Bu polosaning yarim kengligi va intensivligi keskin
ortib ketadi. Shuningdek C=O polosa ham past chastotaga tomon 40-50 sm -1
gacha siljiydi. Yutilish spektrlarida O H polosaning past chastota tomon siljishi esa
100 sm -1
ni tashkil qiladi. Kombinatsion sochilish spektrida O H tebranish
polasasing past chastota tomonga siljishi ~500sm -1
gacha bo‘lishi mumkin.
Chumoli kislotas i molekula laridagi O H g u ruh i vodorod atomi, molekulalararo
vodorod bog‘lanish hosil qilishda faol qatnash adi [35-36] .
Suyuq chumoli kislotasida yopiq dimerlar, zanjirli agregatlar va e rkin C=O
bog‘lanishga e ga bo‘lgan agregatsiyalardan tashqari, uch molekulali agregatlar
ham bo‘lishi mumkin ligi ko‘rasatildi . Bu agregatlarda vodorod bog‘lanishlar C H
va O- H g u ruh larda vodorod atomlari tomonidan amalga oshiriladi. C H guruhning
vodorod atomi qatnashadigan agregatlar hosil bo‘lishi kombinatsion sochilish
spektrlarida C=O ,O H va C H bog‘lanishlar tebranish spektrlarida yaqqol
namoyon bo‘ladi.
Ushbu ishdan maqsad kombinatsion sochilish spektrlarini solishtrish orqali
monokarbon kislotalarda karboksil guruhining molekulararo ta’siridagi o‘rnini
aniqlashdan iborat. Karbon kislotalari molekulalari proton donor guruhi va ikkita
proton akseptor markaziga ega bo‘lib, suyuq holatda vodorod bog‘lanishlar orqali
turli agregatsiyalar hosil qilishi mumkin ekan (5-rasm).
O‘tkazilgan tajriba natijalariga to‘xtalib o‘tamiz. 7-rasmda chumoli
kislotasining kombinasion sochilish spektrlaridagi C=O tebranish spektral chizig’i
60](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_60.png)

![7-rasm. Chumoli kislotasining kombinatsion sochilish spektrlaridagi С = О
tebranish polosasi: 1, 2- toza suyuqlikda (mos ravishda parallel- I|| ( ) va
perpendikulyar - I
( ) tashkil etuvchilari); 3 – chumoli kislotasi va inert erituvchi
СС l
4 ; 4 – chumoli kislotasi va geksan bilan eritmalari
Chumoli kislotasini geksanda eritganimizda esa (4-hol) spektral
chizig’imizning maksimumi 1658 sm -1
ga teng bo‘lib, yuqori chastota tomondan
yangi spektral chiziq hosil bo‘lganligini kuzatdik [38]. Demak, chumoli kislotasini
geksanda eritganimizda bir-biriga yaqin turgan spektral chiziqlari alohida
ko‘rishimiz mumkin ekan. Bu esa haqiqatan ham chumoli kislotasi molekulalari
o‘zaro molekulalararo vodorod bog’lanish hosil qilishini va yuqori chastota
tomonda hosil bo‘lgan 1690 sm -1
spektral chiziq agregatlarga tegishli degan
xulosani aytishimiz mumkin.
O‘tkazilgan tajriba natijalaridan xulosa qilib aytadigan bo‘lsak, toza chumoli
kislotasi molekulalari o‘zaro kuchli molekulalararo vodorod bog’lanish hosil qilar
ekan, parallel va perpendikulyar tashkil etuvchilarining maksimumi o‘zaro mos
tushmas ekan va bu maksimumlar orasidagi farq 50 sm -1
ni tashkil etar ekan.
Chumoli kislotasini CCl
4 eritganimizda molekulalararo vodorod bog’lanish hosil
621658 1682
1732
1690
1655200
1650 1700
1750400
1600](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_62.png)
![tufayli hosil bo‘lgan agregatlarni buzar ekan va buning natijasida spektral
chizig’imiz sodda ko‘rinishga kelib, past chastotaga siljir ekan. Shuningdek,
chumoli kislotasini geksanda eritganimizda bir-biriga yaqin turgan spektral
chiziqlari alohida alohida ko‘rish imkoni hosil bo‘lar ekan.
Tajribani davom ettirib, chumoli kislotasining kombinasion sochilish
spektrlaridagi C –H tebranish polosasini o‘rgandik. 10-rasmda toza chumoli
kislotasining kombinasion sochilish spektrlaridagi 2960 sm -1
spektral chizig’ining
parallel tashkil etuvchisi keltilgan (1-holda), spektral chizig’imizning yarim
kengligi 48 sm -1
ga teng. 2-holda esa chumoli kislotasining kombinasion sochilish
spektrlaridagi 2960 sm -1
spektral chizig’ining perpendikulyar tashkil etuvchisi
keltilgan bo‘lib, uning yarim kengligi ham 48 sm -1
ga teng. Rasmdan ko‘rinib
turibdiki, parallel va perpendikulyar tashkil etuvchilari polosasi shakli bir xil va
yarim kengliklarida ham farq yo‘q [56]. Demak, bu oriyentatsion korelatsiya vaqti
kattaligidan molekulaning oriyentatsion harakati parallel tashkil etuvchisi
polasasining kengayishiga juda kam hissa qo`shishdan dalolat beradi.
Tajribani davom ettirib, chumoli kislotasini protonodonor xusususiyatiga
ega bo‘lgan suvda eritdik (2-hol). Bu holda spektral chizig’imizning yarim
kengligi va shakl jihatdan o‘zgarmaganligini, lekin spektral chiziq maksimumi
2951 sm -1
past chastota tomonga siljiganligini kuzatishimiz mumkin. Chumoli
kislotasini inert erituvchi CCl
4 da eritganimizda esa (4-hol) spektral chzig’imizning
yarim kengligi keskin kamayib, 21 sm -1
ga teng bo‘lib qoldi. Demak, chumoli
kislotasining C–H guruhi toza chumoli kislotasida ham suv bilan eritmasida ham
molekulalararo vodorod bog’lanishda qatnashadi va spektral chiziqning anomal
kengayishiga olib keladi.
63](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_63.png)





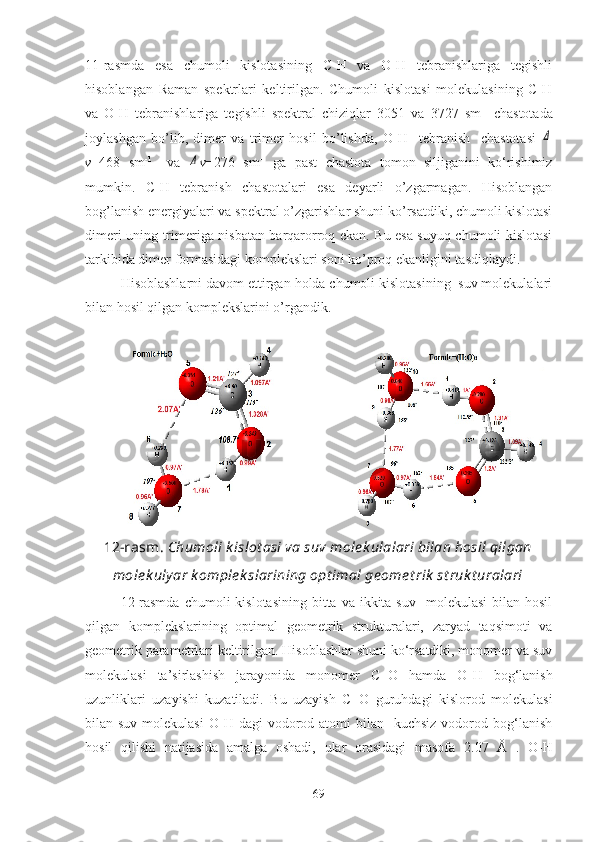
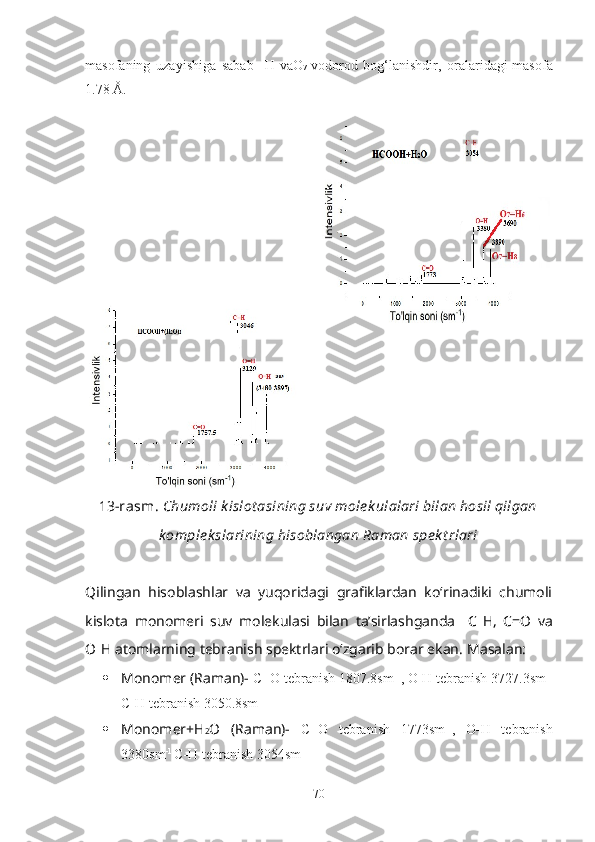
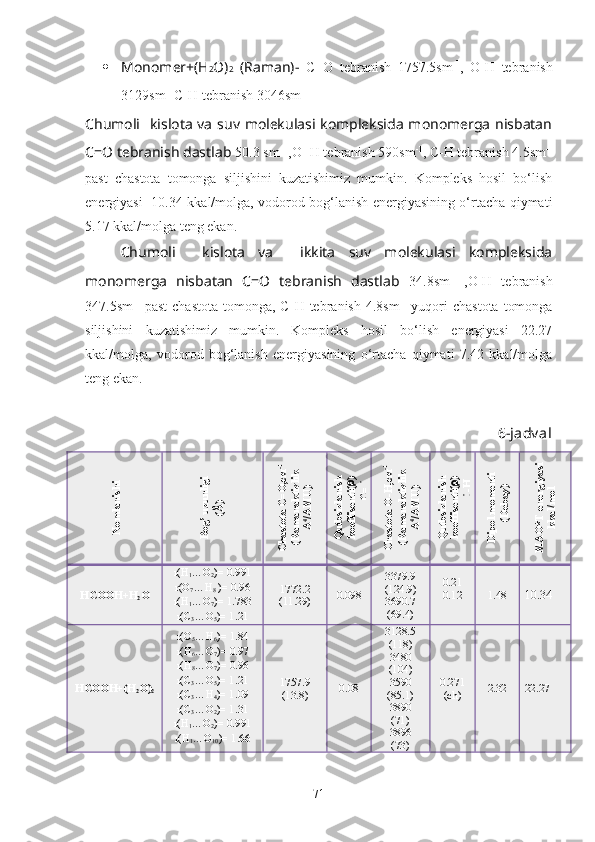

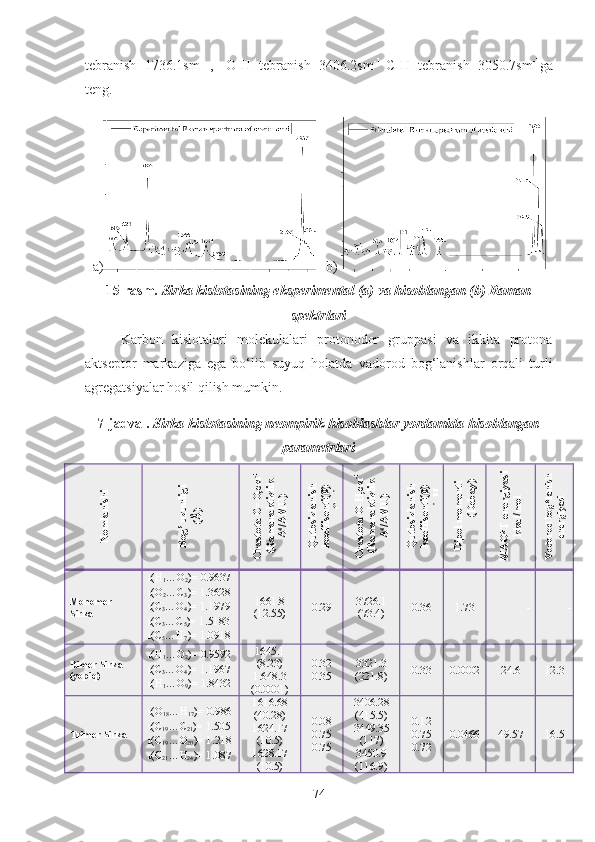
![Molekulalararo o‘zaro ta’sirlarni o‘rganishda quyi molekulali karbon kislotalarini
spektrel taxlili yaxshi natija beradi. Karbon kislotalarni kombinatsiyon sochilish
spektrlari orqali o‘rganilganda har-xil assotsiatlar bilan bog‘langan C=O
tebranishga tegishli palasani past chastota tomonda yotuvchi chizig‘i (nisbatan
intensivroq) boshqa ikkita chiziqqa nisbatan intensivligi kattaroq bo‘lishiga
qaramasdan qolgan ikkita chizig‘ini ham kuzatish mumkin.
3.2-§. Noempirik hisoblashlar va tajriba natijalarini taqqoslash
Karbon kislotalari mol е kulalari suyuq holatda turli xil agr е gatlar hosil
qilar ekan. Eritmalarda kompon е ntlarning bir xil ulushida agr е gatlangan
brikmalarning soni oshadi. N е ytral eritmalarida turli tipdagi agr е gatlarining nisbiy
tarkibi o`zgarishi k е rak.
Adabiyotlardagi ma'lumotlar va bizning laboratoriyada olib borilgan
tajribalar shuni ko`rsatadiki, toza suyuq holatdagi sirka kislotasida C=O t е branish
polosasiga t е gishli kombinatsion sochilish sp е ktrlarining (I
|| ( ν )) tashkil etuvchisi
murakkab ekan [40-41].
Ushbu polosaning ch е garasida y е tarlicha k е nglikga ega bo`lgan chastotalari
1671 sm -1
, 1728 sm -1
va 1762 sm -1
ga t е ng bo‘lgan uchta chiziqni ajratish mumkin
(14-rasm). Int е nsivligi nisbatan past bo‘lgan 1728 sm -1
keng chiziq intisivligi
kattaroq bo`lgan 1671 см -1
chiziqning fonida yotadi.
Polosaning p е rp е ndikulyar tashkil etuvchisida aniq ajratilgan chiziqlar
int е nsivliklar bo`yicha taqsimoti umuman boshqachadir. Bu ikkala chiziq ham
C=O t е branish polosasiga t е gishli ekanligiga qaramasdan ularning d е polyarizatsiya
koeffitsi е ntlari turlicha ekanligi ham shu rasmdan ko`rinib turibdi.
Polosaning murakkabligi, adabiyotlarda [42] ko`rsatilishicha, suyuqlikda turli xil
agr е gatlarning yopiq dim е rlar (past chastota tomondagi chiziq), zanjir agr е gatlar
(yuqori chastota tomondagi chiziq) mavjudligi sababli d е b tushuntirilgan.
75](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_75.png)

![qolmoqda. Sirka kislotasining eritmada miqdori 0,2 molyar ulushda bo`lganda,
zanjirli polim е r mol е kulalar va sirka kislotasining erkin C=O t е branishiga ega
mol е kulalari bo`lmaydi va o`z navbatida C=O t е branishga t е gishli bu polosalar
sp е ktrda kuzatilmaydi yoki int е nsivliklari kuchli tarzda kamayib k е tadi d е gan
fikrga k е lamiz.
Sirka kislotasining protonoakts е ptor xususiyatiga ega Bo`lgan modda,
ats е tonitril bilan eritmalarida tamoman t е skari jarayon kuzatiladi (9-rasm). Bu
eritmaning kuchli aralashmasida protonoakts е ptor guruhlarga nisbatan
protonodonor guruhlarning kamligi sababli C=O t е branish sp е ktridagi
O`zgarishning sababi erkin C=O bog`lanishli mol е kulalarning ortganligi bo`lishi
mumkin.
Boshqa moddadagi aralashmalarga (CF
3 COOH – ats е tonitril) nisbatan [23], sirka
kislotasining eritmada molyar ulushi eng kam bo`lgan (0,05 m.u.) qolda ham bu uchta
polosa saqlanganligi kuzatildi. Faqatgina yuqori chastota tomondagi polosaning nisbiy
int е nsivligi oshganligini kuzatishimiz mumkin. Boshqacha qilib aytganimizda, sirka
kislotasining ats е tonitril bilan aralashmalarida uch xil tipdagi agr е gatlar (yopiq dim е rlar,
zanjirli agr е gatlar va erkin C=O bog`lanishli mol е kulalar) saqlanib qolar ekan. Bu tajariba
natijalari ham yuqoridagi fikrimizni tasdiqlaydi.
77](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_77.png)






![neutron diffraction. II: Isotopic substitution for DCOO[H/D]. Chemical
Physics, 306(1-3), 241–251. doi:10.1016/j.chemphys.2004.07.036
50. Yan, C., Cheng, G., Wang, K., Liu, T., Jin, Y., Yang, H., & Zhang, Q.
(2019). Exploring the reactive chemistry of FOX-7: synthesis of cyclic
triazinane-based energetic materials featuring the FOX-7 backbone. New
Journal of Chemistry, 43(26), 10429–10433. doi:10.1039/c9nj01932d
51. Жумабаев А., Худойбердиев Б., Хушвактов Х., Абсанов А. // Журн. ДАН
РУз. 2008, № 4, C . 36-39
84](/data/documents/549783b0-12bd-4416-93c8-997552bcd50a/page_84.png)
Monokarbon kislotalarida COOH guruhning molekulalararo o‘zaro ta’sirdagi roli va ularning kombinatsion sochilish spektrlari MUNDARIJA Kirish ………………….……………..………….……………………............. 3 I. BOB. MOLEKULALARARO O‘ZARO TA’SIR TURLARI VA YORUG‘LIKNING KOMBINATSIYON SOCHILISHI 1.1-§. М olekulalararo o‘zaro ta’sirlarning bugungi kundagi talqini… . .... ..... ...... 8 1.2-§. Molekulalararo o‘zaro ta’sirning maxsus turi: Molekulalararo vodorod bog‘lanish …………………………………………………….……………. 1.3-§. Molekulalararo o‘zaro ta’sirlarning tebranish spektrlarda namoyon bo‘lishi…………………………………………………..……………..……… 21 1.4-§. Vodorod bog‘lanishli komplekslarning elektro-optik parametrlarni noempirik hisoblash…………………………............................................. 28 II. BOB. TADQIQOT OBYEKTINI TANLASH VA NOEMPIRIK HISOBLASH USULLARI 38 2.1-§. Tadqiqot obyektini tanlash va ularni tadqiqot o ‘ tkazishga tayyorlash……………....................................................................................... 48 2.2-§. Kombinatsion sochilish spertrlarini qayd qilish t ajriba qurilmasining tuzilishi va ishlash prinsipi ……………………………………. 50 2.3.§. Tajriba natijalari va noempirik hisoblashlar ni baholash ..……………... 57 III-BOB . TAJRIBA VA NOEMPIRIK HISOBLASHLAR NATIJALARI TAHLILI 3.1-§. Chumoli va Sirka kislotalarda molekulyar agregatlarni tuzilishi, bog‘lanish energiyalari, spektral namoyon bo‘lishini noempirik hisoblash yordamida o‘rganish …..……………………………………………………… 59 3.2-§. Noempirik hisoblashlar va tajriba natijalarini taqqoslash………............ Xulosalar………………….…………..……………………..………………… 74 77 1
Foydalanilgan adabiyotlar………….…………………..……………………… 79 KIRISH Ishning dolzarbligi: Hozirgi kunda molekulalararo o‘zaro ta’sir tabiatini o‘rganish zamonaviy molekulyar fizikaning asosiy vazifalaridan biridir. Moddalarning asosiy xususiyatlarini va fizik tabiatini o‘rganishda molekulalararo ta’sir katta rol o‘ynaydi. Moddalarning xossalari uning qanday molekulalardan tuzilganligiga va bu molekulalar o‘zaro qanday joylashganligiga bog‘liq. Fizika, kimyo va biologiyadagi ko‘pgina fundamental masalalarni hal qilishda moddadagi molekulalarning miqdorini, ularning tuzilishini va boshqa xossalarini keng temperatura, bosim va konsentrasiya intervalida hamda turli agregat holatlarda bo‘lish talab etiladi. Barcha fanlar yutug‘ini ishlab chiqarishga tadbiq etish bugungi kunning dolzarb muammolaridan biri bo‘lib hisoblanadi. Lazerlar texnikasini jadal ravishda rivojlanishi sanoat texnologiyasi , tibbiyot sohasida va xalq xo‘jaligining boshqa sohalarida ulkan muvaffaqiyatlarga olib keldi. Bundan tashqari ilm-fanning rivojlanishida lazerlarni elektron hisoblash mashinalari bilan birgalikda qo‘llanilishi juda tez amalga oshadigan jarayonlarni tadqiq etish va ulardan amalda foydalanish imkoniyatlari mavjudligini ko‘rsatib berdi. Hozirgi kunda moddaning suyuq holati nazariyasini rivojlantirish-fanning fundam е ntal masalalaridan biridir. Toza suyuqliklar va ularning eritmalarini amaliyotda qo‘llanilishi tufayli, ularning xossalarini chuqur o‘rganish zaruriyati paydo bo‘ladi. Tabiat to‘g`risidagi bilimlarimizni yanada boyitishda, suyuq muhitlar to‘g‘risidagi nazariyada bir qancha y е chilishi lozim bo‘lgan muammoli masalalar paydo bo‘lmoqda. Shuning uchun suyuqliklarning mol е kulyar tuzilishi, fizik-kimyoviy xossalari bilan bog`liq bo‘lgan savollarni kompl е ks o‘rganish masalasi bugungi kunda xam zarur va dolzarbligicha qolmoqda. Bu borada erishilgan yutuqlarni ishlab chiqarish bilan keng bog `lash bugungi kunning dolzarb muammolaridan biri bo‘lib hisoblanadi . 2
Oxirgi yillarda suyuqliklarning statistik nazariyasini yaratishda bir qancha yutuqlarga erishi l ganligiga qaramasdan, ko‘plab qiyinchiliklarga duch kеlinmoqda. Suyuqliklarning amaliyotda kеng qo‘llanilishi va ularning kimyo, biologiya va fizikaning bir qancha sohalarida ishlatilishi sababli suyuq, muhitning tuzilishi va xossalarini bilishga bo‘lgan talab kuchayib bormoqda, buning natijasida esa suyuqqliklar nazariyasini yanada rivojlantirish talab qilinmoqda. Shuning uchun ham suyuqliklarning molekulalararo o‘zaro tasirning tabiati va mexanizmini o‘rganish uchun turli optik usullar orasida eng effektivlirog‘i yorug‘likning kombinatsion sochilish spektrlarini o‘rganish usulidir. Optik jihatdan bir jinslilikning sharti muhitning turli qismlarining sindirish ko‘rsatkichlarining bir xil qiymatga ega bo‘lishini bildiradi. Bunday muhitning butun hajmda sindirish ko‘rsatkichi doimiy bo‘lganda yorug‘likning sinish hodisalari yuz bermaydi degan xulosa kelib chiqadi. Kombinatsion sochilish spektrlari yordamida molekulalararo o‘zaro ta’sirlar to‘g‘risida ma’lumot olish uchun turli xil usullardan foydalanish buyicha ko‘p yillardan buyon izlanishlar olib borilmoqda va bu sohada bir qancha ishlar qilingan. Bu soha bilan shug‘ullanuvchi ko‘pchilik tadqiqotchilar bu molekulalarda kuzatiladigan turli effektlarning yuzaga kelishini har xil o‘zaro ta’sirlar orqali tushuntirishgan. Dissеrtatsiya ishida olib borilgan ilmiy tadqiqotlar natijalari suyuq muhitlar to‘g`risidagi tasuvvurlar i mizni yanada kеngaytirishi, bugungi kunda jadal rivojlanayotgan biotеxnologiyalar sohasiga va molеkulyar spеktroskopiyaning rivojlanishiga xissa qo‘shishiga asoslanib dissеrtatsiya ishi mavzusining dolzarbligini alohida ta’kidlash lozim. Tadqiqot obyekti : Yuqorida keltirilgan fikrlarga asoslangan holda biz ushbu magistrlik desserta t siyasida monokarbon kislota xossalari va molekula l ari orasidagi o‘zaro ta’sirlarni o‘rganish uchun quyimolekulyar karbon (chumoli, sirka) kislotalari molekulasini tanlab oldik. Karbon kislotalari va ularning turli erituvchilar bilan ertimalarida olib borilgan tajriba natijalarining tahlili va noempirik hisoblashlar natijalari bilan taqqoslash bo‘yicha natijalar tahlili keltirildi. 3
Tadqiqot maqsadi bazi karbon kislotalar (chumoli va sirka) da vodorod bog‘lanishli molekulyar agregatlarning shakllanish mexanizmlarini va molekulalararo o‘zaro ta’sirlarning umumiy qonuniyatlarini aniqlash hamda bu molekulyar agregatlarning tenranish spektrida nomoyon bo‘lishini tadqiq qilish. Ushbu maqsadga erishish uchun quyidagi vazifalar y е childi : 1. Monokarbon kislotalarda molekulalararo o‘zaro tasirda radikallarning (R) ahamyati 2. Monokarbon kislotala molekulalari orasidagi qonuniyatlarni aniqlash, xarakterli va qat’iy agregatlarni ajratish ularning molekulyar tuzilish mexanizmlarini o‘rganish; 3. Monokarbon kislotalarida kombinasion sochilish spektrlarini tahlil qilish va noempirik hisoblashlar orqali turlicha agregatlarning molekulyar xarakteristikalarini aniqlash; 4. Agregatlangan bog‘lanishlarda molekulalarning fazoviy tuzilishi va oriyentasiyasini aniqlash. 5. Tajribada olingan natijalarni noempirik hisoblashlar bilan taqqoslash va yangi ma’lumotlar olish. Diss е rtatsiya ishida oldimizga qo‘yilgan vazifalarni е chish uchun karbon kislotalaridan (chumoli, sirka) va erituvchi sifatida mol е kulalararo o‘zaro ta’sirga juda s е zgir bo‘lgan moddalar tanlab olindi. Tadqiqot usuli: yorug‘likning kombinasion sochilish spektroskopiyasi , no empirik hisoblashlar. Amaliy ahamiyati: Kombinasion sochilish spektrlarini o‘rganish shu moddaning tarkibida qanday ximiyaviy elementlar borligini emas, balki elementlarni atomlari qanday qilib molekulaga gruppalanishini ham bildiradi. Bu usul sanoatda, masalan, aviasiyada benzin sifatini tekshirishda va ximiyaviy erituvchilar va boshqalarni tarkibini an'iqlashda keng qullaniladi. Bundan tashqari suyqliklarning dinamik-tuzilish xarakteristikalarini aniqlashda, komplekslar hosil bulish jarayonini o‘rganishda amaliyotda o‘z tadbiqini topadi. 4
Ishning ilmiy yangiligi: Ushbu disertatsiya ishida karbon kislotalari (chumoli, sirka, kislotalari misolida) bog‘lanishlar i orasidagi qonuniyatlar, xarakterli va qat’iy agregatlarni ajratish suyuqliklarning molekulyar tuzilish mexanizmlari to‘g‘risida natijalar olindi. Karbon kislotalar (chumoli va sirka kislotalari) da molekulyar agregatlar hosil bo‘lishi uchun noemprik hisoblashlar o‘tkazi ldi. Chumoli, sirka, propion kislotalari kombinasion sochilish spektrlarini tahlil qilish va noemperik hisoblashlar orqali turlicha agregatlarning molekulyar xarakteristikalari va agregatlangan bog‘lanishlarda molekulalarning fazoviy tuzilishi va oriyentasiyasi aniqlandi. DISSERTASIYANING ASOSIY MAZMUNI Dissertasiya ishi tarkiban kirish, uchta bob, xulosa va foydalanilgan adabiyotlar ro‘yxatidan iborat. Dissertasiya 83 bet matn, 16 ta rasm, 7 ta jadval va 51 nomdagi foydalanilgan adabiyotlar ro‘yxatidan iborat. Kirish qismida ishning umumiy tavsifi berilgan va molekulalararo o‘zaro ta’sirlarni o‘rganishga taaluqli tadqiqotlardan foudalangan holda, muammoning qo‘yilishi shakllantirilgan (tarifi berilgan), ishning maqsad vazifalari, amaliy ahamiyati va ilmiy yangiligi keltirilgan. Birinchi bobda. Molekulalararo o‘zaro ta’sirlarning bugungi kundagi tasnifi, yorug‘likning sochilishiga doir ma’lumotlar, molkulalararo o‘zaro ta’sirlarning maxsus turi bo‘lgan vodorod bog‘lanish va uning kombinasion sochilish spektrlarida namoyon bo‘lishiga doir nazariy ma’lumotlar batafsil keltirilgan. Ikkinchi bobda. Dissertasiya ishida o‘rganilgan ob’ektlarni tanlab olish va ularning xossalari to‘g‘risida ma’lumot berilgan. Hozirgi zamon sanoatida karbon kislotalarning qo‘llanilishi buyicha ma’lumotlar keltirildi. Shu bobda tajriba qurilmalari DFS-52 va Thermo Nicolet 6700 FTIR/FT-Raman spektrometlarida qayd qilingan. Uyg‘otuvchi yorug‘lik manbai lazer bo‘lib, yoritilgan suyuq, kristal va polikristal moddalarda kombinasion sochilish konturini olish va qayd qilish 5
