Suvsiz eritmalar va ularda boradigan kimyoviy reaksiyalar hamda ularning borish sharoitlari.
















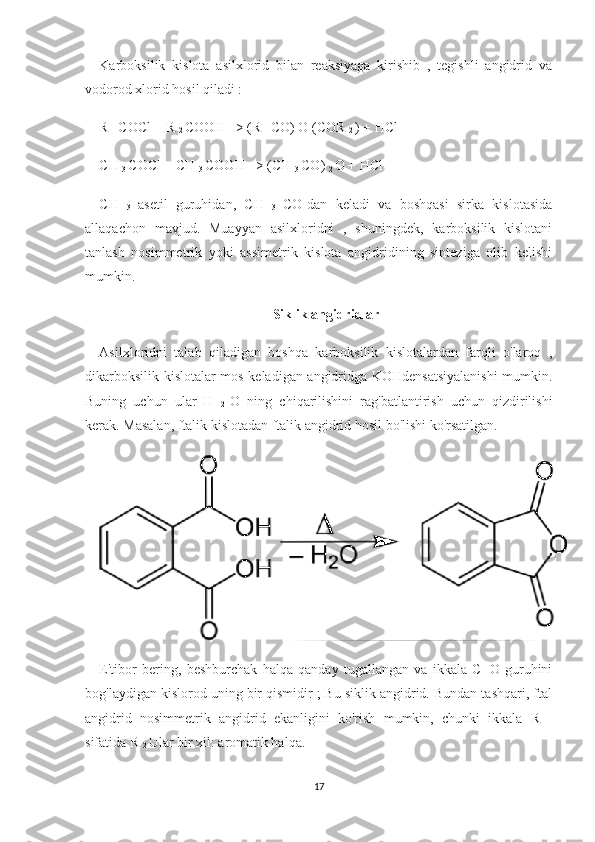



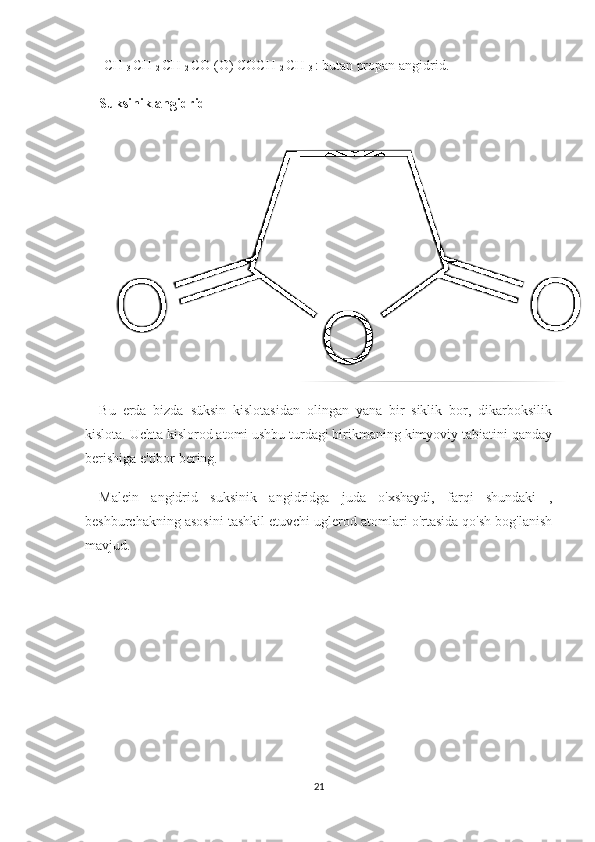
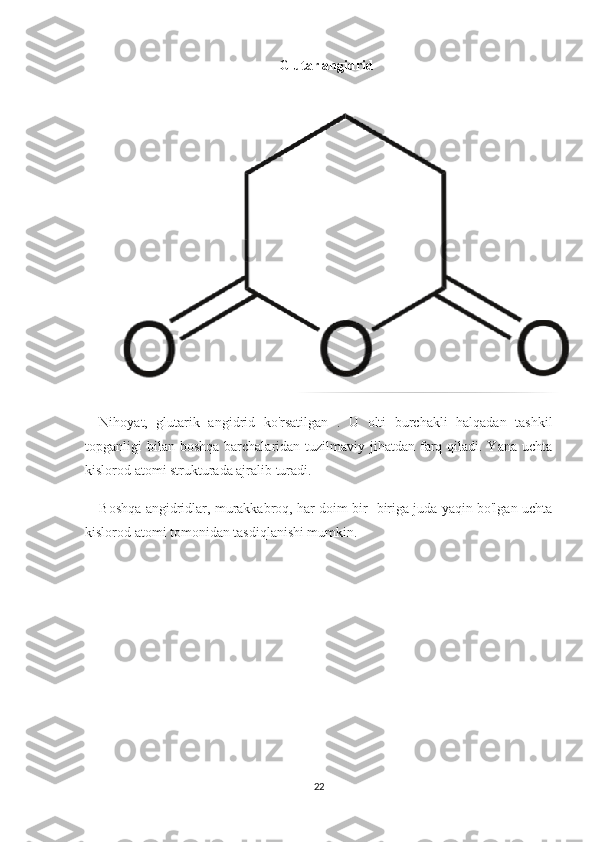


Suvsiz eritmalar va ularda boradigan kimyoviy reaksiyalar hamda ularning borish sharoitlari. Reja: I bob Kirish II bob.Asosiy qism.Suvsiz eritmalar va ularni tayyorlash. 2.1. Uchuvchan suvsiz eritmalar (etanol, xloroform, benzin) haqida tushuncha. 2.2. Uchuvchan bo‘lmagan erituvchilar (yog’lar va moylar, glitserin) haqida tushuncha. III bob Angidridlarning xossalari va ularning xosil bo’lishi. 3.1Angidridlarning xossalari 3.2.Angidridlar qanday hosil bo'ladi Xulosa Foydalanilgan adabiyotlar 1
Kirish Oddiy atmosfera sharoitida suv suyuq holatni saqlab qoladi, shu bilan birga qolgan vodorod birikmalari shunga o'xshash rejadagi gazlar gazdir. Ushbu hodisa molekulalar va suv atomlari qo'shilishining maxsus xususiyatlari va ular orasidagi aloqalarning maxsus xususiyatlari bilan izohlanadi. Kislorod atomlari deyarli 105 daraja burchakni tashkil etadigan vodorod atomlariga biriktirilgan va ushbu KOHfiguratsiya har doim saqlanadi. Kislorod va vodorod atomlarining elektrekomida katta farq orqali elektron bulutlar kislorod tomon siljiydi. Shuning uchun suv molekulasi faol dipol deb hisoblanadi, unda vodorod partiyasi ijobiy zaryadga ega va kislorod salbiy. Natijada, suv molekulasi muloqotni shakllantiradi, bu juda qiyin va yuqori energiya xarajatlarini talab qiladi. Suv deyarli siqila olmaydi. Shunday qilib, atmosfera bosimining bir barga ko'payishi bilan, bitta barda suv faqat 0,00005 qismida, uning boshlang'ich hajmidan boshlab 0.00005 qismida siqilgan. Muz va suvning tuzilishi juda o'xshash. Muzda ham, suvda ham molekulalar biron ma'noda yashashga harakat qilmoqdalar - ular tuzilishni tashkil etishni xohlashadi, ammo termal harakatning oldini oladi. Suv qattiq holatga tushganda, molekulalarning issiqlik aylanishi endi tarkibiy shakllanishga xalaqit bermaydi, shundan so'ng ular orasidagi bo'shliq ko'tariladi, shuning uchun zichligi. Ayni paytda suv juda anomal modda ekanligi haqida aytilgan. Suvning qattiq yig'indisi muz, suyuqlik suvning suyuq suvi yuzasida suzishi mumkin. Bug'lanish sodir bo'lganda, aksincha, barcha ulanish darhol portlashi mumkin. Ushbu obligatsiyalarning nomuvofiqligi juda katta energiyani talab qiladi, bu barcha moddalar orasida eng katta suv sig'imini aks ettiradi. 1 darajali litali suvni isitish uchun 4 kj energiya sarflash kerak. Ushbu mulk tufayli suv ko'pincha sovutish uchun ishlatiladi. 2
II bob.Asosiy qism.Suvsiz eritmalar va ularni tayyorlash. 2.1.Uchuvchan suvsiz eritmalar (etanol, xloroform, benzin) haqida tushuncha. Kimyo texnologiyasida suvsiz eritmalar suvli eritmalardan tashqari spirtli, glitserinli, moyli, siliKOHli va hokazo eritmalar uchraydi. Ko‘pincha ular sirtga qo‘llash uchun ishlatiladi. Suvsiz eritmalar 2 guruhga bo‘linadi: 1. Uchuvchan (etanol, xloroform, efir, benzin, skipidar) eritmalar. 2. Uchuvchan bo‘lmagan eritmalar: o‘simlik moylari, vazelin moyi (suyuq parafin), glitserin.Uchuvchan erituvchilar bilan eritma tayyorlaganda qizdirish, filtrlash, suzish kabi texnologik bosqichlardan voz kechish lozim, chunki bunda erituvchining uchib ketish ehtimoli bo‘ladi. Efir, benzin, etanol yong‘indan xavflidir. Bu eritmalarni to‘g‘ridan-to‘g‘ri bemorga beriladigan, og‘zi zich yopiladigan shisha idishlarda tayyorlanadi. Suvli eritmalardan farqli o‘laroq suvsiz eritma tayyorlashda avvalidishga eritiladigan modda, so‘ngra erituvchi solinadi. Idish quruq bo‘lishi shart. Bu eritmalarni filtrlash zarur bo‘lgan taqdirda voronka ustiga shisha plastinka yopib turib filtr lash kerak. Agar etanolning KOHsentratsiyasi ko‘rsatilmagan bo‘lsa, 90% li etanol ishlatiladi (hajm foizda).Bundan quyidagilar mustasno:5—10% li yod eritmasi (X DF), 1—2% li yod eritmasi, 1,5% li vodorod peroksid eritmasi, 1% li sitral eritmasi — 96% li etanolda; 1—2% salisil kislotasi va 0,5%; 1—3%; 5% li borat kislotasi eritmalari —70% li etanolda; 1—2% li brilliant yashili va 1% li metilen ko‘ki eritmalari — 60% li etanolda tayyorlanadi (O‘z RSSV ning 2002-yil 29-dekabrdagi 582-sonli buyrug‘i). Etanol eritmalari og‘irlik — hajm usulida tayyorlanadi. Rr: Acidi borici 0,3Sp. aethylici 70% — 10 mlM.D.S. Sirtga ishlatish uchun.Quruq flaKOHga 0,3 g borat kislotasi, 10 ml 70% li etanol solib eritiladi (og‘zi tez berkitiladi). Erishni tezlashtirish uchun idishni iliq suvga (40—50°C) solib isitish mumkin.Ba’zan 70% li etanol olish uchun 95% li etanolni suyultirish lozim bo‘ladi. Bunda quyidagiformuladan foydalanish mumkin:X = V Ѕ BAMasalan, 50 ml 70 %li etanol eritmasini tayyorlash kerak.X =50 Ѕ 70= 36,8 ml.95Silindrga 36,8 ml 95% li etanol solib hajmi 50 ml ga yetguncha tozalangan suv qo‘shiladi. O‘lchov silindri 3
bo‘lmagan hollarda XI DF ning 3—4 alkogolometrik jadvalidan foydalanish mumkin.Moyli, glitserinli eritmalar og‘irlik usulida tayyorlanadi. Erishni tezlashtirish uchun eritma suv hammomida qizdiriladi. Eritma to‘g‘ridan-to‘g‘ri bemorga beriladigan idishning o‘zida tayyorlanadi, ya’ni filtrlanmaydi.Rr: Mentholi 0,2Ol. Vaselini 20,0M.D.S. Sirtga ishlatish uchun. Quruq flaKOHga 0,2 gmentol solib texnik tarozida muvozanatga keltiriladi va ustiga20 gvazelin moyi solinadi. Og‘zi berkitilgan idishdagi aralashmanisuv hammomida 70—80°C gacha qizdiriladi. Bunda mentol to‘liq eriydi.Rr: Natrii tetraboratis 20,0Glycerini 80,0M.D.S. Og‘izning shilliq pardalarini artish uchun. Quruq flaKOHga20 g natriy tetraborat solib texnik tarozida muvozanatga keltiriladi va ustiga 80 g glitserin solinadi. Idishning og‘zi berkitilib,natriy tetraborat erib ketguncha suv hammomida qizdiriladi. Т egishli yorliq yopishtiriladi. Suvsiz eritmalar sifatini baholash. Suvsiz eritmalar sifatini baholashda avval ularning hujjatlari (retsept, pasport), yorlig‘i, rangi, hidi, mexanik zarrachalarning bor-yo‘qligi tekshiriladi. Glitserinli va moyli eritmalarning umumiy og‘irligi, spirtli eritmalarning esa hajmi tekshiriladi. 2.2. Uchuvchan bo‘lmagan erituvchilar (yog’lar va moylar, glitserin) haqida tushuncha. Etil spirti (vino spirti, etanol), C 2 H 5 OH — bir atomli alifatik spirtlarning muhim vakili. Mol.m. 46,069. Rangsiz, o tkir ta mli, spirtlargaʻ ʼ xos hidli suyuqlik. Suyuqlanish temperaturasi — 114,5°, qaynash temperaturasi 78,39°, zichligi 789,27° kg/m3(20°da). Suv bilan cheksiz aralashadi va tarkibida 95,57% spirt, 4,43% suv bo lgan azeotrop aralashma hosil qiladi. Absolyut sof ʻ spirt olishda 2 usuldan foydalaniladi. 1usulda suvli spirtga ozroq benzol qo shiladi ʻ va hosil bo lgan aralashma fraksiyalab haydaladi. Bunda avval suv, spirt va benzol ʻ aralashmasi, keyin spirtning benzol bilan aralashmasi va nihoyat, oxirida sof spirt haydaladi. 2 usulda 96% li spirtni kaltsiy (P)oksid yoki qizdirilgan mis (P)sulfat bilan isitiladi. Bunda suvning asosiy massasi chiqib ketadi, spirt tarkibida ushlanib qolgan 0,2— 0,3% suvni spirtga metall holdagi kaltsiy yoki magniy qo shib ʻ haydash yo li bilan ajratiladi.Etil spirti sanoatda tarkibida qand (shakar) bo lgan ʻ ʻ moddalardan enzimlar va achitqilar ta sirida quyidagi reaksiya orqali olinadi: ʼ 4
C 6 H 12 O 6 =2C 2 H 5 OH+2CO 2 Xom ashyo sifatida glyukoza yoki uzum sharbatidan foydalanilganda tarkibida 8 dan 16% gacha Etil spirti bo lgan uzum vinosi hosilʻ bo ladi. Ko pincha polisaxaridlar (kraxmal yoki sellyuloza) xom ashyo sifatida ʻ ʻ qo llanadi. Etil spirtini umumiy formulasi (C ʻ 6 H 10 O 5 ) bo lgan polisaxaridlardan ʻ ham olish mumkin. Bunda ular to la gidrolizga uchratilib glyukozaga, so ngra ʻ ʻ spirtga aylantiriladi. Kraxmalli xom ashyolar sifatida boshokli o simliklar — ʻ bug doy, arpa, sholi, jo xoridan, shuningdek, kartoshkadan foydalaniladi.Etil spirti ʻ ʻ sanoatda bir necha yo llar bilan sintez qilinadi. Yog och gidrolizatini achitish yo li ʻ ʻ ʻ bilan gidroliz spirt i olinadi. Uning tarkibida 2% gacha zaharli modda — metil spirti (metanol) bo ladi. Sulfat kislota ishtirokida etilenni gidratatsiya qilish ʻ reaksiyasidan ham Etil spirti olishda keng foydalaniladi.Ba zi mamlakatlarda Etil ʼ spirti atsetilendan olinadi. Bu usulda Kucherov reaksiyasi asosida atsetilen avval sirka aldegidga o tkaziladi, keyin uni gidrogenlab Etil spirtiga aylantiriladi. ʻ Mazkur reaksiya mis yoki palladiy katalizatori ishtirokida yuqori trada olib boriladi:ns=ns+n2o> sn3sno > sn3sn2onE.s. dunyoda eng ko p sintez qilinadigan ʻ va qo llanadigan mahsulotlardan biri hisoblanadi.Ishlab chiqarilgan Etil spirtining ʻ asosiy qismi divinil olishda, etil efir, xloroform, xloral, o ta sof etilen, etilatsetat, ʻ murakkab efirlar va erituvchilar ishlab chiqarishda qo llanadi. Etil spirti tibbiyotda, ʻ farmatsevtikada, atirupa sanoatida, bo yoqchiliqda, antiseptik vositalar ʻ tayyorlashda ishlatiladi. Etil spirti — muhim antifrizlardan biri. Undan oziq-ovqat sanoatida, turli spirtli ichimliklar va dorivor damlamalar tayyorlashda ham foydalaniladi. E. narkotik modda. Uzoq vaqt iste mol qilinsa, nerv, me daichak, ʼ ʼ yuraktomir sistemalari, jigar qattiq zararlanadi. Xloroform. 19-asrda xloroform eritmasi kokain va geroinga teng qilingan modda dori vositasi xisoblangan edi. Xloroform eritmasi dorixonalarda bronxit va yo’talni davolash va oldini olish uchun sotilar edi. Shifokorlar bu eritmani astma kasali bor bemorlarga tavsiya qilishar edi. O’sha davrda xloroform eritmasi anesteziya sohasida ham qo’llanilar edi. 21 asrga kelib bu modda ichga qo’llashga man etildi. Bundan savol kelib chiqadi nima uchun? Nima o’zgardi? Что 5
