Kimyoviy bоg`lаnish hаqidа

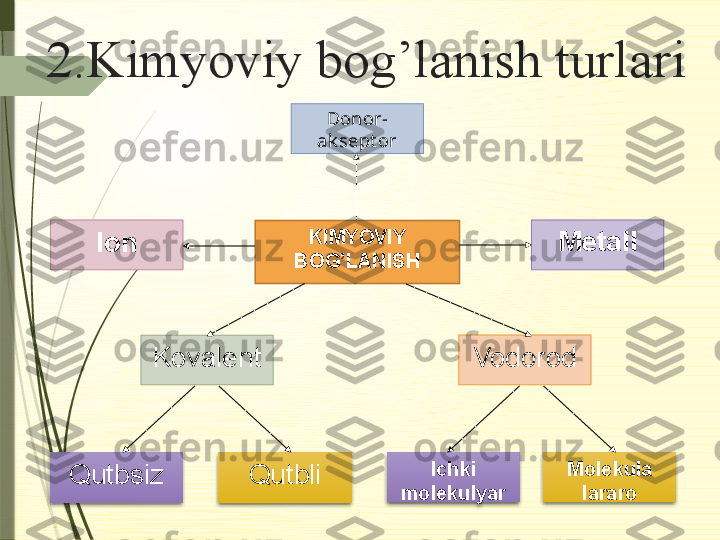










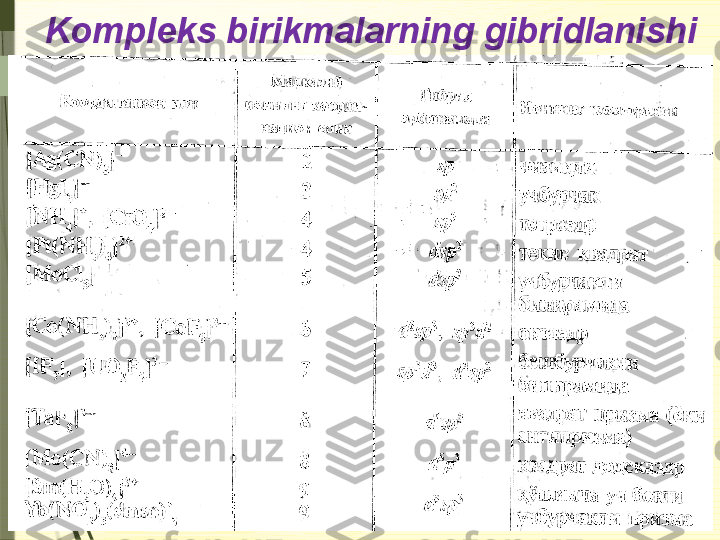
![Gibridlanish
Gibrid-
lani sh Fazov iy
t uzili shi Burchagi Misollar
sp Chiziql i 180 0
BeGal
2 , BaGal
2 , CO
2 , aset ilen (C
2 H
2 ), al k in, all en
(CH
2 =C=CH
2 ), C
k a rbin , CS
2 , N
2 , MgH
2 , CO, KrF
2 …
sp 2
Teng t omonli
uchburchak 120 0
BGal
3 , A lGal
3 , SO
2 , SO
3 , C
gra fi t (gek sanal), alk en,
benzol, st irol, H
3 PO
3 , H
2 SO
3 , HN O
3 , HNO
2 , KrOF
2 ,
X eOF
2 , COF
2 , O
2 , O
3 , H
2 CO
3 , al degid v a k et on,
HCOOH, CO
3 2–
, SO
3 2–
, BO
3 2–
…
sp 3
Tet raedr
y ok i t ri gonal
pirami da 109 0
, 28’
CH
4 , SiO
2 , Na
2 SO
4 , galogenl arning hosi l qilgan
k isl ot alari v a ularning t uzlari, NH
3 , N H
4 +
, H
3 PO
4 ,
alk an, sik loalk an, P
4 , HMnO
4 , H
2 MnO
4 , KrO
2 F
2 , C
olmos ,
H
2 O, H
3 O +
, F
2 O, P
4 O
10 , POCl
3 , CCl
4 …
sp 3
d Uchburchak l
i bi piram ida 120 o
v a
90 o PGal
5 , SbGal
5 , SF
4 , ClF
3 , X eF
2 ,
sp 3
d 2
Ok t aedr –––
SF
6 , SCl
6 , Ba
2 [X eO
6 ], K4[FeCN
6 ], K
3 [FeCN
6 ],
[Cr(N H
3 )
6 ]Cl
3 , [Cu(H
2 O)
6 ]Cl
2 …](/data/documents/a7822717-4be1-4ffd-a479-055cc634e16f/page_18.png)
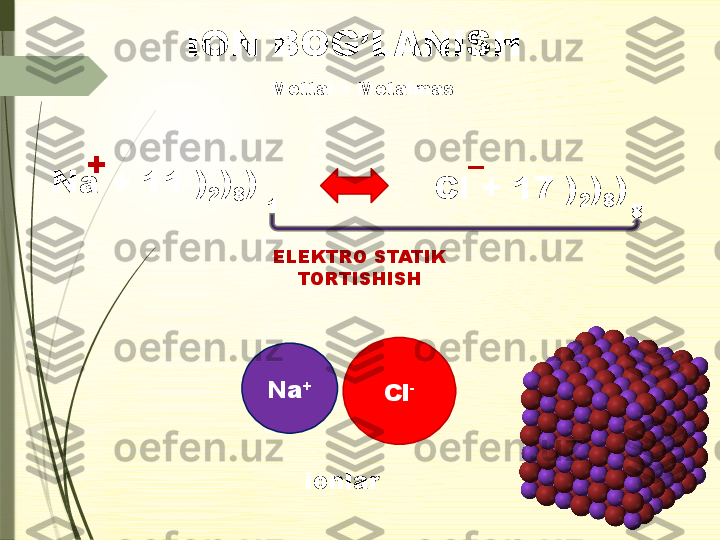
Kimyoviy elementlarning tashqi qobig’idagi elektronlar o’rtasida vujudga kelgan bog’lanish kimyoviy bog’lanish deyiladi. K imyoviy b о g`l а nish h а qid а t ushunch а.
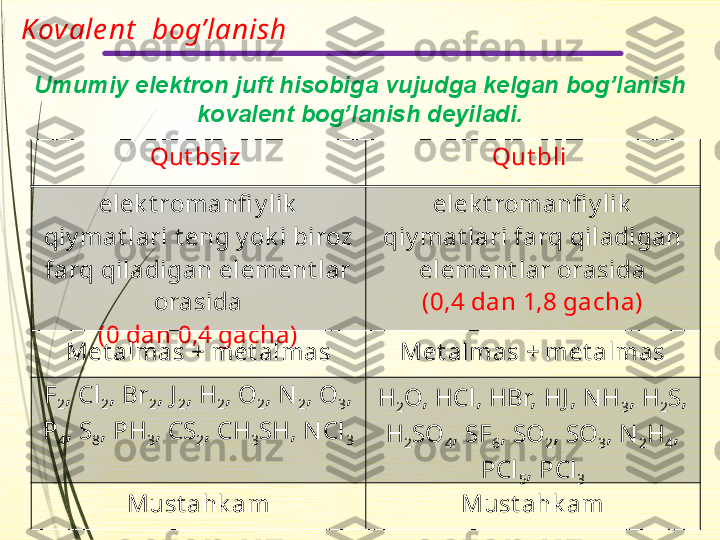
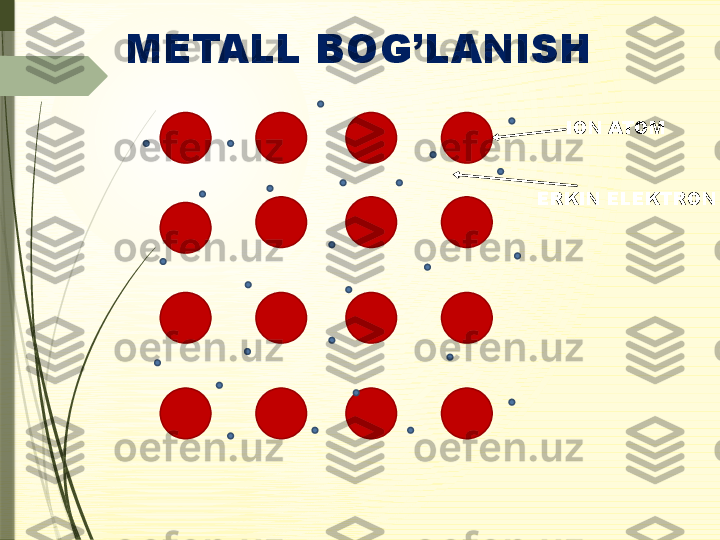
Donor- ak sept or Molekula lararoIon Kovalent KIMYOVIY BOG’LANISH Ichki molekulyarQutbsiz Qutbli Vodorod Metall2.Kimyoviy bog’lanish turlari
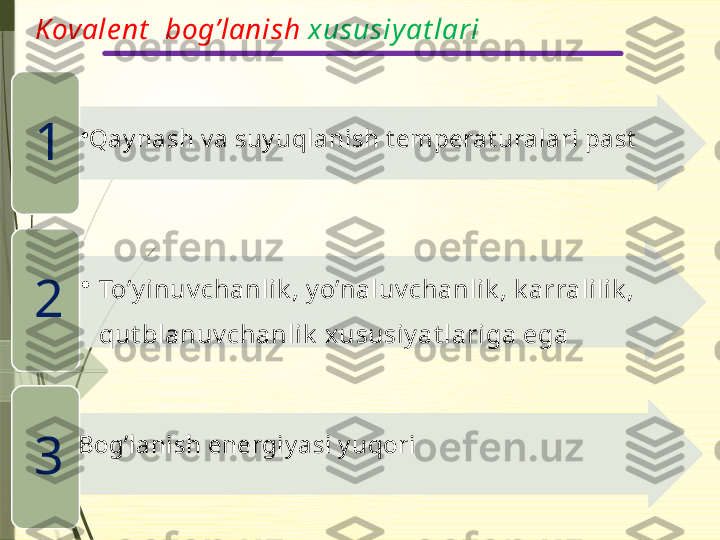
Kovale nt bog’lanish Umumiy elektron juft hisobiga vujudga kelgan bog’lanish kovalent bog’lanish deyiladi. Qut bsiz Qut bli elek t romanfi y lik qiy mat lari t eng y ok i biroz farq qiladigan element lar orasida (0 dan 0,4 gacha) elek t romanfi y lik qiy mat lari farq qiladigan element lar orasida (0,4 dan 1,8 gacha) Met almas + met almas Met almas + met almas F 2 , Cl 2 , Br 2 , J 2 , H 2 , O 2 , N 2 , O 3 , P 4 , S 8 , PH 3 , CS 2 , CH 3 SH, N Cl 3 H 2 O, HCl, HBr, HJ , N H 3 , H 2 S, H 2 SO 4 , SF 6 , SO 2 , SO 3 , N 2 H 4 , PCl 5 , PCl 3 Must ahk am Must ahk am
Kovale nt bog’lanish xususiyat lari • Qay nash v a suy uqlanish t emperat uralari past 1 • To’y inuv chanlik , y o’naluv chanlik , k arralilik , qut blanuv chanlik xususiy at lariga ega2 Bog’lanish energiy asi y uqori 3
Bog’ning to’yinuvchanligi – atomlarning cheklangan miqdordagi bog’lar hosil qilish xususiyati. Element atomlarining valent pog’onasidagi hamma elektronlari bog’ hosil qilishda qatnashgandan so’ng element o’zining to’yinuvchanlik xususiyatini namoyon etgan bo’ladi. тетраэдрик пирамидал бурчаклиBog’larning yo’naluvchanligi – bog’larni fazoning ma’lum yo’nalishida joylashganligi.
