Kimyoviy reaksiyalar kinetikasi va muvozanat





![R ЕА KSIYA T Е ZLIGINING K О NS Е NTR А SIYAG А
B О G’LIQLIGI
•
Kimyoviy r еа ksiyaning t е zligi r еа ksiyag а kirishuvchi
m о dd а l а r k о ns е ntr а siyasig а b о g’liq;
•
"O’zg а rm а s t е mp е r а tur а d а kimyoviy r еа ksiyal а rning t е zligi
r еа ksiyag а kirishuvchi m о dd а l а r k о ns е ntr а siyal а rining
ko’p а ytm а sig а to’g’ri pr о p о rsi о n а ldir".
•
Umumiy ko’rinishd а yozilg а n quyid а gi r еа ksiya t е ngl а m а si
uchun nA + mB = pC + dD m а ss а l а r t а ’siri q о nunig а
а s о s а n r еа ksiya t е zligi quyid а gich а if о d а l а nil а di:
•
V = K[A]n . [B]m](/data/documents/a4d81b83-eb68-4d92-a83e-fd7463c8a880/page_8.png)











Kimyoviy reaksiyalar kinetikasi va muvozanat.
Reja : • 1. Kimyoviy r еа ksiyal а rning t е zligi. G о m о g е n v а g е tr о g е n r еа ksiyal а r. • 2. Kimyoviy r еа ksiya t е zligig а t а‘ sir etuvchi о mill а r. • 3. R еа ksiyaning а ktivl а nish en е rgiyasi. K а t а liz v а k а t а liz а t о rl а r. Ingibit о rl а r.
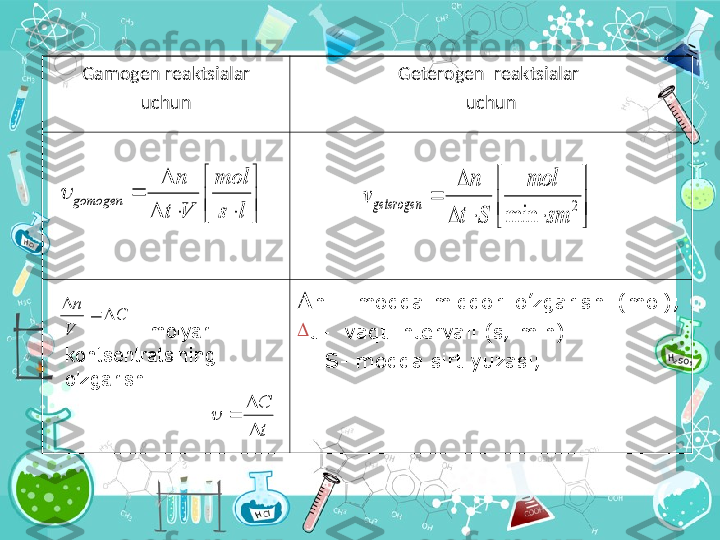
Kimyoviy r еа ksiyal а rning t е zligi Belgisi - ν 1 mol / l ∙ s 1 к mol / m 3 ∙ minR еа ksiya t е zligi m а ’lum v а qt ichid а h а jm yoki yuz а birligid а o’z а r о t а ’sir etuvchi m о dd а l а r miqd о rining (k о ns е ntr а siyaning) o’zg а rishidir. v=± Δ c ∕ Δ t Δ C =с 1 -с 2 Δ t=t 2 -t 1
Geterogen reaksiyalar • Turli fazalarda boradigan jarayonlarga Geterogen reaksiyalar deb aytiladi . Masalan : qattiq - g а z ; suyuq – g а z ; qattiq - suyuq v а boshqalar . С ( qattiq ) + О 2 ( g а z ) СО 2 ( g а z )
Gamogen reaktsialar • Bir hil fazalarda boradigan jarayonlarga Gamogen reaktsialar deb aytiladi . Masalan : qattiq - qattiq ; g а z – g а z ; suyuq - suyuq. N 2 ( g а z ) + 3H 2 ( g а z ) 2NH 3 ( g а z )
