Alifatik qator uglevodorodlarning galogenli hosilalari


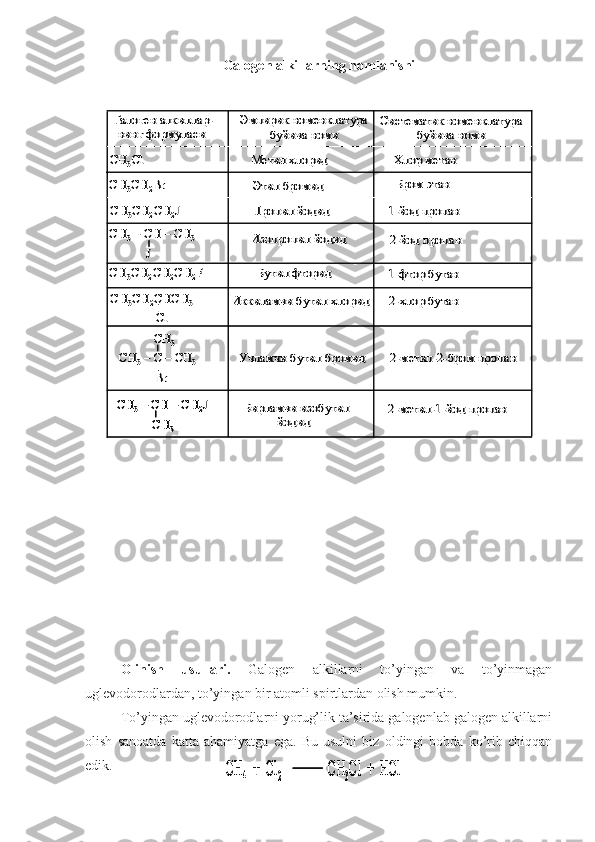


![Galogen alkillarning gidrolizlanish jarayonining tezligi galogen alkilning
tuzilishiga, galogen atomining tabiatiga, erituvchining tabiatiga va qator omillarga
bog’liq bo’lib, turli yo’nalishda sodir bo’lishi mumkin. Birlamchi galogen
alkillarning gidrolizlanishi ikkinchi tartibli nukleofil almashinish mexanizmi
bo’yicha sodir bo’ladi. Buni metil bromid misolida ko’rib chiqadigan bo’lsak:
Bunda reaksiyaning tezligi gidroskil ionlari, galogen ionlar va galogen
alkilning konsentratsiyasiga bog’liq bo’ladi, ya’ni
Uchlamchi galogen alkillarning gidrolizlanish jarayoni birlamchi tartibli
nukleofil almashinish (S
N1 ) mexanizmi bo’yicha ikki bosqichda sodir bo’ladi.
Jarayonning birinchi bosqichi galogen alkilning qaytar dissotsialanishi hisoblanadi.
Dissotsialanish monomolekulyar jarayon bo’lib, juda sekin boradi. Buning
natijasida karboniy ioni (CH
3 )
3 C +
hosil bo’ladi. Hosil bo’lgan karboniy ioni
erituvchi molekulasi bilan juda tez ta’sirlashadi:
Bunda jarayonning tezligi eng sekin boradigan bosqichning tezligi bilan
o’lchanadi va faqat galogenli alkilning konsentratsiyasiga bog’liq bo’ladi; ya’niHO – + C –Br HO C Br HO –C –H + Br –
H
H H H H
H
H
H
+ + - -
HO – + C –Br HO C Br HO –C –H + Br –
H
H H H H
H
H
H
+ + - -
= K[OH –] [CH 3Br]
(CH 3)3C –Br (CH 3)C + + Br – (CH 3)3C –Br (CH 3)C + + Br –
= K [(CH 3)3CBr]
..
:O:H ..
..
H
(CH 3 )C + + OH – (CH
3 ) 3C -OH
(CH
3 )C + + (CH
3 ) 3C:O:H .. + (CH
3 ) 3C:OH + H +
H
+ + Br – HBr
..
:O:H ..
..
H
(CH3 )C + + OH – (CH
3 ) 3C -OH
(CH
3 )C + + (CH
3 ) 3C:O:H .. + (CH
3 ) 3C:OH + H +
H
+ + Br – HBr
:O:H ..
..
H
:O:H ..
..
H
(CH3 )C + + OH – (CH
3 ) 3C -OH
(CH
3 )C + + (CH
3 ) 3C:O:H .. + (CH
3 ) 3C:OH + H +
H
+ + Br – HBr
(CH3 )C + + OH – (CH
3 ) 3C -OH (CH3 )C + + OH – (CH
3 ) 3C -OH
(CH
3 )C + + (CH
3 ) 3C:O:H .. + (CH
3 ) 3C:OH + H +
H
+ + Br – HBr
(CH3 )C + + (CH
3 ) 3C:O:H .. + (CH
3 ) 3C:OH + H + (CH
3 )C + + (CH
3 )C + + (CH
3 ) 3C:O:H .. + (CH
3 ) 3C:OH + H +
H
+ + Br – HBr H+ + Br – HBr](/data/documents/4155be4a-65be-4b76-809c-bd9375cb5fb3/page_6.png)

![2. Galogenalkillarning qaytarilishi. Galogenalkillarning katalitik
gidrogenlaganda yoki ularga vodorod yodid bilan ta’sir etilganda to’yingan
uglevodorodlargacha qaytariladilar:
3. Tegishli sharoit yaratilgan taqdirda (erituvchi, harorat va boshqalar)
galogen alkillardagi bir galogen atomini boshqa galogen atomi bilan almashtirish
mumkin:
B unda dastlabki galogen alkil hamda ularga ta’sir etayotgan tuzlar va
jarayon natijasida hosil bo’layotgan moddalarning eruvchanligi hisobga olinadi.
4. Galogen alkillarga alkogolyatlar bilan t’sir etilganda oddiy efirlar hosil
bo’ladi:
Bunda qo’shimcha mahsulot sifatida to’yinmagan uglevodorodlar hosil
bo’ladi.
5. Galogenalkillarning organik kislotalar tuzlari bilan qo’shib qizdirilganda
murakkab efirlar hosil bo’ladi:
6. Galogen alkillar ammiak va uning hosilalari bilan o’zaro ta’sir etib,
aminobirikmalarni hosil qiladilar: R –J R –H + HJ
R –J + HJ R –H + J 2
[H] R –J R –H + HJ
R –J + HJ R –H + J 2
R –J R –H + HJ R –J R –H + HJ
R –J + HJ R –H + J 2
[H]
R –Cl + NaJ R –J + NaCl
R –J + AgCl R –Cl + AgJ
R –Cl + NaJ R –J + NaCl
R –J + AgCl R –Cl + AgJ
C2H5J + NaOC 2H5 C2H5OC 2H5 + NaJ C2H5J + NaOC 2H5 C2H5OC 2H5 + NaJ
C2H5J + Ag –O –C –CH 3 C2H5 –O –C + AgJ
O
О
СН 3
C2H5J + Ag –O –C –CH 3 C2H5 –O –C + AgJ C2H5J + Ag –O –C –CH 3 C2H5 –O –C + AgJ
O
О
СН 3
CH
3 J + NH
3 ( CH
3 NH
3 ) +
J CH
3 NH
2 + NH
4 JNH
3
CH
3 J + NH
3 ( CH
3 NH
3 ) +
J CH
3 NH
2 + NH
4 JNH
3](/data/documents/4155be4a-65be-4b76-809c-bd9375cb5fb3/page_8.png)






![2.Galogeni yon zanjirada joylashgan aromatik galogenli hosilalarni olish uchun
galogenalkanlarni olishdagi barcha usullardan foydalanish mumkin, masalan:
Bulardan tashqari aromatik galogenli birikmalarni olishda xlormetillash
reaksiyasidan keng foydalaniladi:
Bu reaksiyaning mexanizmini quyidagicha tasavvur etish mumkin:
Fizik xossalari. Benzol va uning gomologlarining galogenli hosilalari suyuq
yoki qattiq moddalar bo’lib, ftorli hosilalar past, yodli hosilalar esa yuqori
haroratda qaynaydilar.
Masalan:
C
6 H
5 F – 85 0
C; C
6 H
5 Cl – 132 0
C
C
6 H
5 Br – 156 0
C; C
6 H
5 J – 188 0
C
Ularning zichliklari 1 dan yuqori. Suvda erimaydilar. Ko’p organik
erituvchilarda yaxshi eriydilar.[C 6H5N2]BF 4 C6H5F + N 2+ BF 3 [C 6H5N2]BF 4 C6H5F + N 2+ BF 3
C6H5CH 2OH + PCl 5 C6H5CH 2Cl + POCl 3 + HCl
C6H5CH=CH 2 + HBr C6H5CH –CH 3
Br
C6H5CH 2OH + PCl 5 C6H5CH 2Cl + POCl 3 + HCl
C6H5CH=CH 2 + HBr C6H5CH –CH 3
Br
C6H6+ CH 2O + HCl C6H5CH 2Cl + H 2O
ZnCl 2 C6H6+ CH 2O + HCl C6H5CH 2Cl + H 2O C6H6+ CH 2O + HCl C6H5CH 2Cl + H 2O
ZnCl 2
CH 2O + ZnCl 2 CH 2+–OZn Cl–
+ CH 2+–OZn Cl– + CH 2+–OZn Cl
H HCl
-ZnCl 2
-H2O
CH 2Cl
CH 2O + ZnCl 2 CH 2+–OZn Cl– CH 2O + ZnCl 2 CH 2+–OZn Cl–
+ CH 2+–OZn Cl– + CH 2+–OZn Cl
H HCl
-ZnCl 2
-H2O
CH 2Cl
+ CH 2+–OZn Cl– + CH 2+–OZn Cl
H
+ CH 2+–OZn Cl– + CH 2+–OZn Cl
H HCl
-ZnCl 2
-H2O
CH 2Cl](/data/documents/4155be4a-65be-4b76-809c-bd9375cb5fb3/page_17.png)
![Kimyoviy hususiyatlari. Galogenarillar galogenalkanlardan farqli ularoq,
nukleofil reagentlar bilan deyarli reaksiyalarga kirishmaydilar. Ular ishqor,
kumush tuzlari, sianidlar, ammiak va boshqalar bilan oddiy sharoitda reaksiyaga
kirishmaydilar.
Xlor va brombenzol o’yuvchi ishqorlar bilan 300 0
C da, ammiak bilan mis
yoki ularning tuzlari ishtirokida 180-200 0
C dagina reaksiyaga kirisha oladilar. Ular
bu hususiyatlari bilan galogeni qo’shbog’ning yonida joylashgan yog’ qator
galogenli hosilalarni eslatadilar. Bu galogen arillarni oraliq karbanoli hosil
bo’lishligining qiyinchiligi tufaylidir. Halqada joylashgan galogen atomi halqa
bilan o’ta mustaxkam bog’ hosil qiladi.
Aromatik halqadagi galogenni nukleofil almashinish reaksiyalariga
kirishishi yog’ qator galogenli birikmalarnikidan farq qiladi va bosqichli boradi.
Bu juda ko’p tajribalar yordamida isbotlangan. Kuchli nukleofil reagentlar
yordamida galogenarillardan galogenvodorodlar ajralib chiqib, reaksiyaga
kirishuvchanlik qobiliyati juda yuqori bo’lgan degidrobenzol hosil bo’ladi.
Degidrobenzol so’ng reaksiya zonasidagi nukleofil agent, masalan, suv yoki
ammiak bilan juda tez reaksiyaga kirishadi va oxirgi mahsulotni hosil qiladi,
masalan:
Yuqoridagi reaksiyaning mexanizmi shu bilan isbotlanadiki,
almashinayotgan guruh hamma vaqt ham galogen o’rniga birikmaydi. Masalan, p-
xlortoluol gidrolizlanganda p- va m-krezollarning teng miqdordagi aralashmasi
hosil bo’ladi:Br
-HBr
HOH
NH 3
O+H
N+H3
–
–
OH
NH 2
Br
-HBr
HOH
NH 3
O+H
N+H3
–
–
OH
NH 2
CH 3
Cl
NaOH [H 2O]
340 0C
CH 3
H2O
CH 3
OH
+
CH 3
HO
+ NaCl
50 % 50 %
CH 3
Cl
NaOH [H 2O]
340 0C
CH 3
H2O
CH 3
OH
+
CH 3
HO
+ NaCl
50 % 50 %](/data/documents/4155be4a-65be-4b76-809c-bd9375cb5fb3/page_18.png)



Alifatik qator uglevodorodlarning galogenli hosilalari Reja : 1. To’yingan uglevodorodlarning galogenli hosilalari (galogenalkanlar) 2. Fizik va kimyoviy xossalari 3. Ayrim vakillari 4. Digalogenli hosilalar 5. Poligalogenli hosilalar 6. To’yinmagan uglevodorodlarning galogenli hosilalari 7. Aromatik uglevodorodlarning galogenli hosilalari
To’yingan uglevodorodlarning bir galogenli hosilalarini galogen alkillar deb ataladi va quyidagi umumiy formula bilan ifodalanadi C n H 2n+1 X. Bu yerda X = -F; -Cl; -J; -Br bo’lishi mumkin. Galogen atomining qanday uglerod atomi bilan bog’langanligiga qarab ular birlamchi, ikkilamchi va uchlamchi galoid alkillarga bo’linadilar: - birlamchi; -ikkilamchi; -uchlamchi. Izomeriyasi va nomlanishi. Emperik nomenklatura bo’yicha galogen alkillarning nomini molekuladagi uglerod radikali nomiga galogen nomini qo’shib hosil qilinadi. Sistematik nomenklatura bo’yicha esa galogenning uglerod uzun zanjiridagi joyini raqamlar bilan ko’rsatilib, to’yingan uglevodorodning nomi o’qiladi. Galogen alkillarning izomeriyasi ularning uchinchi vakilidan boshlanadi. Ular izomerlarining soni tegishli to’yingan uglevodorodlarnikiga nisbatan ko’p.R –CH 2–Cl R –CH –R’ R –C –R’ R’’ J Br R –CH 2–Cl R –CH –R’ R –C –R’ R’’ J Br
Galogen alkillarning nomlanishi Olinish usullari. Galogen alkillarni to’yingan va to’yinmagan uglevodorodlardan, to’yingan bir atomli spirtlardan olish mumkin. To’yingan uglevodorodlarni yorug’lik ta’sirida galogenlab galogen alkillarni olish sanoatda katta ahamiyatga ega. Bu usulni biz oldingi bobda ko’rib chiqqan edik.Галоген алкиллар - нинг формуласи Эмпирик номенклатура буйича номи Систематик номенклатура буйича номи СН 3Сl Метил хлорид Хлор метан СН 3СН 2Br CH 3CH 2CH 2J CH 3–CH –CH 3 J CH 3CH 2CH 2CH 2F CH 3CH 2CHCH 3 Cl CH 3–C –CH 3 Br CH 3 CH 3–CH –CH 2J CH 3 Этил бромид Пропил йодид Изопропил йодид Бутил фторид Иккиламчи бутил хлорид Учламчи бутил бромид Бирламчи изобутил йодид Бром этан 1-йод пропан 2-йод пропан 1-фтор бутан 2-хлор бутан 2-метил -2-бром пропан 2-метил -1-йод пропан Галоген алкиллар - нинг формуласи Эмпирик номенклатура буйича номи Систематик номенклатура буйича номи СН 3Сl Метил хлорид Хлор метан СН 3СН 2Br CH 3CH 2CH 2J CH 3–CH –CH 3 J CH 3CH 2CH 2CH 2F CH 3CH 2CHCH 3 Cl CH 3–C –CH 3 Br CH 3 CH 3–CH –CH 2J CH 3 CH 3–CH –CH 2J CH 3 Этил бромид Пропил йодид Изопропил йодид Бутил фторид Иккиламчи бутил хлорид Учламчи бутил бромид Бирламчи изобутил йодид Бром этан 1-йод пропан 2-йод пропан 1-фтор бутан 2-хлор бутан 2-метил -2-бром пропан 2-метил -1-йод пропан СH4 + Cl 2 CH 3Cl + HCl СH4 + Cl 2 CH 3Cl + HCl
Bu usulning afzalligi shundan iboratki, bunda dastlabki moddalar sifatida arzon sanoat ashyolari ishlatiladi va jarayonning natijasida qimmatli mahsulot olinadi. Usulning kamchiligi sifatida jarayon natijasida bir galogenli hosilalar bilan birga ko’p galogenli birikmalarning hosil bo’lishini, buning natijasida kerakli mahsulotni ajratib olishning murakkablashuvini ko’rsatish mumkin. 1. Etilen uglevodorodlariga galoid vodorodlarni biriktirib, galogen alkillar olish eng qulay usul hisoblanadi. Bunda kerakli mahsulot yuqori unum bilan hosil bo’ladi: 2.Galogen alkillarni to’yingan bir atomli spirtlardagi gidroksil guruhini galogenga almashtirib olish mumkin. Bunda spirtlarga galoid vodorodlar, fosforning galogenli birikmalari yoki tionil xlorid bilan ta’sir ettiriladi: a) galoid vodorodlar ta’siri: yoki b) fosforni galogenli hosilalarning ta’siri: v) spirtlardan galogen alkillar olishda eng qulay usul ularga tionil xlorid bilan ta’sir etish hisoblanadi:CH 3 –CH = CH 2 + HBr CH 3 –CH –CH 3 Br CH 3 –CH 2 –CH 2 Br 90 % 10 % CH3 –CH = CH 2 + HBr CH 3 –CH –CH 3 Br CH 3 –CH 2 –CH 2 Br 90 % 10 % R –OH + HBr R –Cl + H 2O R –OH + HBr R –Cl + H 2O R –OH + KBr + H 2SO 4 R –Br + KHSO 4 + H 2O R –OH + KBr + H 2SO 4 R –Br + KHSO 4 + H 2O R – OH + PCl 5 R – Cl + POCl 3 + H 2 O 3 R – OH + PCl 3 3 R – Cl + P(OH) 3R – OH + PCl 5 R – Cl + POCl 3 + H 2 OR – OH + PCl 5 R – Cl + POCl 3 + H 2 O 3 R – OH + PCl 3 3 R – Cl + P(OH) 33 R – OH + PCl 3 3 R – Cl + P(OH) 3 R – OH + SOCl 2 ROSO –Cl + HCl ROSO –Cl R – Cl + SO 2 R – OH + SOCl 2 ROSO –Cl + HCl R – OH + SOCl 2 ROSO –Cl + HCl ROSO –Cl R – Cl + SO 2 ROSO –Cl R – Cl + SO 2
Bunda hosil bo’lgan galogen alkil juda osonlik bilan ajratib olinadi. Uchlamchi spirtlardagi gidroksil guruhi galogenga juda osonlik bilan almashinadi. Birlamchi spirtlardan galogen alkillar olishda katalizatorlar ishlatiladi.(ZnCl 2 , H 2 SO 4 , …). 4. Ftorli galogen alkillarni yuqoridagi usullar yordamida olib bo’lmaydi. Ularni asosan uglevodorodlarni xlorli, bromli yoki yodli hosilalariga simob, kumush, kobalt, surma kabi metallarning ftoridlari bilan ta’sir etib olinadi: Fizik va kimyoviy xossalari. Galogenalkillarning fizik xossalari gelogen atomining tabiatiga va uglevodorod radikalining tuzilishiga bog’liq bo’ladi. Oddiy sharoitda metil-, etil-, propil- va butilftoridlar, metil-, etilxlorid, metil bromidlar gaz, qolganlari suyuqlik, yuqori alkillari qattiq moddalardir. Ularning qaynash haroratlari ftorli galogen alkillardan yodli galogen alkillarga qarab ortib boradi. Galogen alkillar qutbli kovalent bog’ hosil qilib tuzilgan. Infraqizil spektrlarda C–F bog’lanishi 1000-1350sm -1 , C–C bog’lanishi esa 600-800 sm -1 to’lqin uzunligiga mos xarakterli chiziq hosil qiladilar. Galogen alkillar kimyoviy jihatdan juda aktiv birikmalardir. Ular uchun asosan nukleofil almashinish jarayonlari xosdir. Bundan tashqari, ular turli organik molekulalar tarkibiga alkil radikallarini kirituvchi muhim vosita hisoblanadilar. Quyida biz shu jarayonlarga misollar keltiramiz. 1. Galogen alkillarning gidrolizi. Bu jarayon natijasida bir atomli spirtlar hosil bo’ladi:2 C 2H5Br + HgF 2 2 C 2H5F + HgBr 2 2 C 2H5Br + HgF 2 2 C 2H5F + HgBr 2 R –Х + H 2O R –OH + HX R –Х + H 2O R –OH + HX
