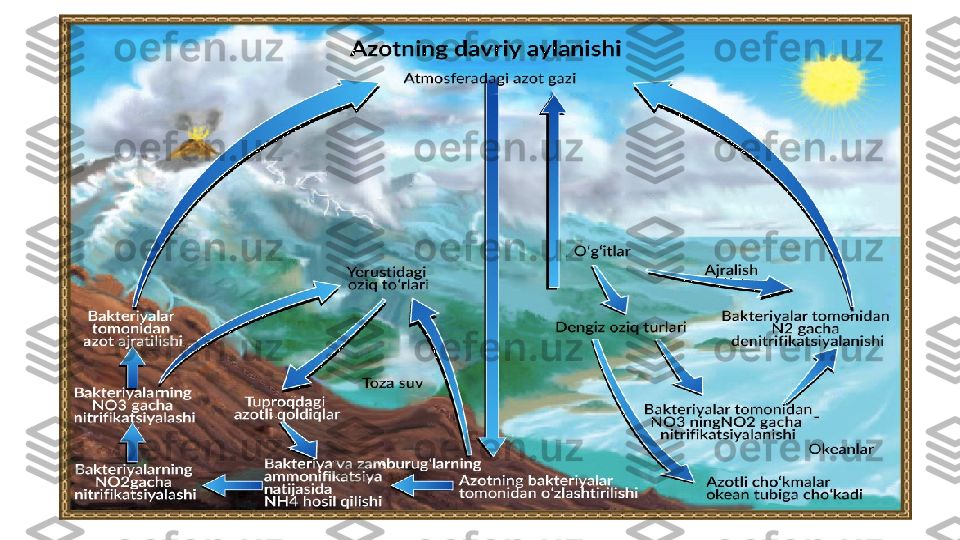
Atmosfera azotini bog‘lash muammosi va uning hal etilishi


















13-Mavzu: Atmosfera azotini bog‘lash muammosi va uning hal etilishi. Reja: 1. Azotning tabiyatda aylanishi. 2. Azot birikmalarining ishlatilishi. 3. Atmosfera azotini biriktirib olishning uch usuli. 4. Ammiak sintezi uchun azot vodorodli aralashmaning olinishi va tozalash usullari
• Tayanch iboralar: ko‘mir, neft, torf, slanes, Konversiya usuli, Ammiakli usulda, Elektr vov (plazma) usuli. Azot tabiatda erkin holda va birikmalar shaklida bo'ladi. Azotning asosiy qismi atmosferada (massa bo'yicha 75,6%) erkin holda bo‘ladi. Birikmalar shaklida esa yer po‘stlog‘ining 0,4 % ini (massa bo‘yicha) azot tashkil etadi. U turli organik moddalar tarkibida, odam, hayvonlar va o‘simliklar organizmida, qazilma boyliklar, ko‘mir, neft, torf, slanes tarkibida uchraydi. Anorganik birikmalar shaklida azot kam uchraydi. Uning natriy nitrat tuzi (Chili selitrasi) Chilida va janubiy Afrikada, kaliy nitrat (Hind selitrasi) esa Hindistonda topilgan. Ma’lum miqdor ammoniy sulfat tuzi ko‘mirni kokslashdan olinadi. Azot tirik tabiatda odamlar, hayvonlar va o‘simliklar hayotida benihoyat muhim rol o‘ynaydi, muhim ozuqa mahsuloti hisoblanadi. U oqsil tarkibiga kiradi.
Organizmda muhim biokimyoviy jarayonlarda ishtirok etadi. Ammo odam va hayvonlar, o‘simliklar, mikrorganizmlar tanasida oqsillar yoki boshqa organik moddalar (fermentlar, vitaminlar, garmonlar, nuklein kislotalar va boshqalar ) sintezida elementar holdagi azot emas (u juda inert elementdir, uning disotsiyalanish energiyasi 945 kJ/mol ‘ bo‘lib, atomlari orasidagi bog‘lar juda mustahkamdir, taqqoslash uchun xlor molekulasining dissotsiyalanish energiyasini 243 kJ/mol olish mumkin), balki uning birikmalari ishtirok etadi. Azot birikmalari bo‘yoqlar, plastmassalar (aminoplastlar) kimyoviy tolalar (kapron, neylon, enant, poliamid tolalar) suratkashlik preparatlari, dori-darmonlar, portlovchi moddalar, azotli o‘g‘itlar, ammiak va nitrat kislotasi va boshqa o‘nlab xalq xo‘jaligi uchun muhim bo'lgan qator mahsulotlar ishlab chiqarishda ishlatiladi.
XX asming boshlarida atmosfera azotini biriktirib olishning uch usuli topildi: 1 ) sianamidli usul; 2 ) elektr yoy usuli; 3) ammiak sintezi usuli. Sianamidli usulda ( 1904-vilda A. Frak va N. Karolar bu usulni kashf etishgan) yuqori haroratda ohakka ko‘mir qo‘shib maxsus pechlarda qizdiriladi. So‘ngra hosil bolgan kalsiy karbid sianamidga aylanadi. CaO + 3C = CO + CaC2 CaC2 + N2 = Ca(CN)2 + С+301/uE
