Al2O3 ASOSIDA MEZOG‘AVAK SORBENTLAR SINTEZI VA ULARNINIG TEKSTUR XARAKTERISTIKALARI



![modifikatsiyalash va ularning qo‘llanilish imkoniyatlarini tadqiq etish import
o‘rnini qoplaydigan sorbentlar bilan ichki bozorni ta’minlash nuqtai nazaridan
O‘zbekiston Respublikasi uchun dolzarb muammolardan biridir.
Keyingi yillarda “zol-gel” usulida yangi gibrid organoanorganik sorbentlarni
sintez qilishga qiziqish kuchaymoqda. Usulning ustunligi shundan iboratki, u
yordamida sorbent strukturasi va fizik-kimyoviy xossalarini tekshiriladigan
namunadagi aniqlanadigan komponent bilan o‘ziga xos ta’sirini unga turli
funksional guruhlarni kiritib o‘zgartirish mumkin. Bu boradagi ishlarni amalga
oshirish ham mahalliy xom ashyo asosida yangi sorbentlar va turg‘un fazalarni
izlash, sintez qilish, modifikatsiyalashda samarali usul hisoblanadi.
Ma’lumki, zol-gel texnologiya aniq kimyoviy va fizik-mexanik xossalarga
ega bo‘lgan anorganik sorbentlar, katalizatorlar, sintetik seolitlar, anorganik
qovushqoq moddalar, maxsus teplofizik, optik, magnitli va elektrik xossalarga ega
bo‘lgan keramika, shisha, shishakeramika, tolalar va boshqalarni olishda
almashinmaydigan va kelajagi porloq usuldir [1-4].
Ba’zi metallar va metallmaslarning oksidlari xromatografiyada sorbent
sifatida keng qo‘llaniladi [2-7]. Keyingi paytlarda bu boradagi ishlar oksidlarning
monolitlari va ularning qoplamalaridan foydalanish tomonga siljigan [2]. Bu
boradagi ishlarning jadal rivojlanishiga zol-gel usulida monolitlar va ularning turli
tutuvchilar sirtida qoplamalar olish sabab bo‘lmoqda.
Shuning uchun ham O‘zbekistondagi tabiiy xom-ashyolardan foydalanib
sorbentlar, jumladan, xromatografiya uchun “zol-gel” texnologiyani qo‘llab,
sorbentlar olishning yo‘llarini ishlab chiqish, nazariy va amaliy ahamiyatga ega
bo‘lishi bilan bir vaqtda dolzarb muammolardan biridir.
Dissertatsiyaning maqsadidan kelib chiqqan holda quyidagi vazifalar
belgilandi:
Zol-gel texnologiyasi orqali turli temperaturda sirt faol moddalarni qo’llab
mezog’ovak Al
2 O
3 olish;
5](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_4.png)




![Zolga bir nechta ta’rif (tavsif) berish mumkin. Eng ko’p
qo’llaniladiganlaridan biri, amerikalik taniqli olimlar K.D.Brinker va
G.V.Shererlarning monografiyasida keltirilgan [64]. Shu yerda bu to’g’risida to’liq
ma’lumot beramiz. Zol bu-qattiq zarrachalarning suyuqlikda kolloid disperslanishi.
Kolloid zarrachalar - tarkibida dispers faza juda oz bo’lib (1- 1000 nm), bunda
gravitatsion kuchlarni hisobga olmaslik mumkin. Van-der-Vaals kuchlari kabi
qisqa ta’sir etuvchi kuchlar, shuningdek, sirt zaryadlari o’rtasidagi tortishish va
itarishish kuchlari hisoblanadi. Dispers faza inersiyasi juda kichik, shuning uchun
zarrachalarning “broun” harakati (broun diffuziyasi) ya’ni, kinetik energiyalar
tufayli dispers muhit molekulalari bilan bo’ladigan to’qnashuvlar hisobiga paydo
bo’ladigan tasodifiy sakrashlar sodir bo’ladi. Zol tabiatini o’rganishda dispers faza
zarrachalarining odatda ko’plab molekulalardan tarkib topgan molekula, agregat
emasligini aniqlash foydalidir [8].
Ba’zan zamonaviy adabiyotlarda kolloid va polimer zollar deb nomlanuvchi
ajratilgan guruhlar uchraydi. Bunda kolloid zolga (makrozarrachalardan hosil
bo’lgan zollarni), polimer zollarga esa tarmoqlangan makromolekulalar asosida
hosil bo’lgan zollarni kiritish mumkin. Gel hosil bo’lish mexanizmi kolloid va
polimer zollar uchun turlicha.
Polimer zollardan olinadigan gel, zoldagi monomer va polimerlarning
polimerlanish jarayonida hosil bo’ladi. Polimerlanadigan tarmoqlangan
oligomerlardan asta-sekin, juda katta (gigant) klaster hosil bo’ladi. Bu klaster
makroskopik o’lchamga ega bo’lganda va zolning butun hajmiga tarqalganda
zolning gelga aylanishi amalga oshdi, deyish mumkin. Bunda gel, bir tomondan,
uzluksiz strukturali turdan - qattiq skeletdan, boshqa tomondan esa uzluksiz suyuq
fazadan tashkil topgan bo’ladi.
Kolloid gelning hosil bo’lishi boshqacha mexanizm bo’yicha sodir bo’ladi.
Dispers faza (misilla) zarrachalari dispersion tortishish kuchlari ta’sirida anorganik
polimerlar skiletini hosil qilib bir-biri bilan o’zaro ta’sirlashadi.
Kimyoviy bog’lanish va o’zaro ta’sirlashuvlardan kelib chiqqan holda, gel
tushunchasiga aniqlik kiritishning zol turiga bog’liq holda, zol-gel sistemada
10](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_9.png)
![butunlay boshqa-boshqa kimyoviy va fizikaviy jarayonlar sodir bo’lganligi sababli
imkoni yo’q.
Polimer gellar uchun juda katta klaster hosil qiluvchi molekulalar va
molekulalar fragmentlari o’rtasidagi kovalent bog’larning mavjudligi xarakterlidir.
Kolloid gellar qoidaga ko’ra, agregatlar o’rtasida bo’ladigan Van-der-Vaals
tortishish kuchlari hisobiga hosil bo’ladi. Bunda kolloid sistemalarda bu
bog’lanishlar qaytar, ya’ni chayqatish jarayonida uzulishi, so’ngra esa tiklanishi
mumkin. Polimer sistemalarda kovalent bog’lar doimiy ta’sir etuvchilar
hisoblanadi.
Brinker va Sherer [64] “gel” tushunchasini quyidagicha izohlaydi: Gel kolloid
zarrachalarining o’lchami (1 nm dan 1000 nm gacha) bo’lgan tutash qattiq va
suyuq fazalardan tashkil topgan. Boshqacha aytganda, gel namunasining bir
uchidan ikkinchi uchiga tomon faqat qattiq faza bo’yicha say r qilish mumkin yoki
aksincha, “suvli usulda” suyuq faza bo’ylab suzish mumkin. Bu fazalar uzluksiz
o’zaro aralashuvchi (almashinuvchi) sistemalar hisoblanadi.
Zamonaviy tasavvurlarga ko’ra, gelning hosil bo’lishi zolning fraktal
strukturalarining hosil bo’lishi, fraktal agregatlarning o’sishi bilan boshlanadi.
Bunda hosil bo’lish nazariyasining izohlashiga ko’ra, ularning bir-biri bilan
to’qnashuvlari va o’zaro bog’lanishlari sodir bo’lmasligi kerak [13].
Gel hosil bo’lishi nuqtasi atrofida tasodifan joylashuvdan qo’shni klasterlar
(zarrachalar polimerlari yoki agregatlaridan tashkil topgan) yagona strukturali
to’rni hosil qilib birikadi. Gel hosil bo’lish nuqtasi zolning butun hajmi bo’yicha
kengayuvchi juda kuchli bog’langan yagona klaster hosil bo’lganda, hosil bo’lish
porogi (ostonasi)ga mos keladi. Gel hosil bo’lish nuqtasidan o’tgandan keyin zol
harakatchanlikni yo’qotadi va ilvirga aylanadi, “ho’l gel” deb ataluvchi gel hosil
bo’ladi.
11](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_10.png)



![tugaydigan, hosil bo’lish mexanizmi oldinroq berilgan strukturalanish jarayoni
sodir bo’ladi. Kremniyorganik kimyoning asoschilaridan biri bo’lgan, rossiyalik
olim K.A.Andrianov [11] ning ta’kidlashicha, to’rt funksional guruhli [Si(OR)
4 ]
birikmalar bo’lgan alkooksibirikmalar gidrolizi mahsulotlari uzilishining
murakkabligi bilan farq qiladi va uzunligi katta bo’lgan chiziqli molekulalardan,
sikllardan va uch o’lchamli yuqori molekulyar polimer sturukturalardan iborat
to’plamga ega bo’lishi mumkin. Yoldas B.I. [12] alkooksibirikmalar gidrolizi
mahsulotlarining ba’zi variantlarini ko’rsatdi. Bular chiziqli, tarmoqlangan yoki
siklik oligomerlar (2.3- rasm).
2.3-rasm.Tetraalkooksilanlarning gidrolitik polikondensatsiyalanish
mahsulotlari strukturasi
Eng ko’p tarqalgan prekursorlardan biri, asosan zol-gel texnologiyada ko’p
qo’llaniladigani bu alkooksibirikmalarning vakili ortosilikat kislotaning etil efiri
yoki qisqacha tetraetoksisilan (TEOS). Oldingi holatda, agar TEOSning
gidrolizlanish reaksiyasi oxirigacha boradi deb taxmin qilinsa, uni quydagicha
ifodalash mumkin.
15](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_14.png)
![(C
2 H
5 O)
4 Si+4H
2 O↔H
4 SiO
4 +4C
2 H
5 OH
Bu reaksiyaning muvozanat konstantasi quydagi formula yordamida
ifodalanadi:
TEOSning gidrolizlanish jaryoniga ko’ra, muvozanat o’ngga kuchli siljiydi.
Muvozanatni chapga siljitish va TEOS gidrolizi reaksiyasi tezligini sekinlashtirish
odatda etanol ishtirokida amalga oshiriladi. Biroq, TEOS gidrolizi jarayoni asosida
pH=7 bo’lganda oxirigacha bormaydi. K.A.Andrianovning [11] takidlashicha,
gidroliz jarayoni 20 0
C da ham 500 0
C dan ham to’liq tugallanmaydi.
Mikroelektronikada qo’llanilishi uchun yanada qiziqarli bo’lgan zol-gel
sistemalarning o’ziga xosligi shundaki, TEOS ga asoslangan, kislotali muhitda
gidrolizlangan zollar metallar alkooksidlar yoki anorganik birikmalar (kislotalar,
metallarning tuzlari) bilan ishtirok etadi.
Dopont-ingliz tilidan tarjima qilinganda legirlovchi “qo’shimcha” degan
ma’noni anglatadi. Natijada bu dopontlar hosil bo’luvchi nanokompozit silikatli
matrisani, uncha kerakli xossalarini katalitik, elektrik va boshqalarni berib
legirlaydi. Bu usul yordamida hosil bo’ladigan nanokompozitlar strukturasining
o’ziga xosligining, bundan ham oldin esa fraktal tushunchasining o’ziga jalb
qilishini batafsil ko’rib chiqamiz.
2 . 1.3 Turli tabiatli ob’yektlarda agregatlanish
Nima uchun zol-gel sistemalarga fraktal ob’yektlar sifatida qarayotganimizga
e’tibor qaratoyotganimizni tushunish uchun kirishda va kristallmas moddalar
xarakteristikasi uchun fraktallar tushunchasidan (konsepsiyasidan) foydalanishda
qanaqa ehtiyoj bo’lganligiga batafsil to’xtalamiz. Asosan, mikroelektronikaga
bog’liq bo’lgan zamonaviy texnologiyalar taassurot qoldiradigan yutuqlarga
16](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_15.png)
![erishdi. Bularning barchasining qattiq jismlar fizikasi sohasidagi muvaffaqiyatlarga
u yoki bu darajada bog’liqligi shubha uyg’otmaydi. Qoidaga ko’ra, tadqiqotning bu
sohasi kristall sistemalar bilan aloqada. Oxirgisi uchun qat’iy determinirlangan
kristall sturukturalarning mavjudligi xarakterlidir. Bularning ramkasida juda
ko’plab kristallanuvchi ob’yektlar kristall panjaraning 7 turi va 230 ta fazoviy
guruhlar asosida izohlanishi mumkin. Ya’ni, moddaning molekulyar sturukturasini,
uning kristall panjarasini va fazoviy guruhlarini bilgan holda amalda har qanday
o’lchamli kristalldagi barcha atomlarning koordinatlarini aniqlash mumkin. Biroq
bizni o’rab turgan olamda bu kabi tartibli sistemalar bilan birga ko’plab tartibsiz
sistemalar, butunlay qaytmas usullar bilan tuzilgan (yoki sodir bo’ladigan)
ob’yektlar yoki hodisalar ham mavjud.
Fraktallar konsepsiyasining paydo bo’lishigacha ular to’g’risidagi tushuncha
va izohlarni umumlashtirishga qaratilgan harakat bo’lmagan, amalda ularning
barchasi insoniyat ilmiy faoliyat sferasidan tashqarida bo’lgan.
Fraktallar konsepsiyasining [13] asosiy holatlari ifodalangandan so’ng,
tegishli noregulyar sturukturalar va hodisalarni ifodalashda ularni qo’llashga
qiziqish keskin ortdi. Bu izohlash bosqichi sanab o’tilgan ko’plab ob’yektlardagi
fraktall alomatlarning mavjudligini o’rnatish orqali muvaffaqiyatli tugatildi.
Shundan so’ng aniq bo’ldiki, bu kabi noregulyar ob’yektlar va determinirlanmagan
hodisalarni izohlashdan tashqari, ularni hosil qilishning ichki mexanizmini
o’rnatishga harakat qilish lozim.
Zol-gel sistemalarida fraktal sturukturalarning barcha alomatlari aniqlangan.
Shu yerda fraktallar konsepsiyasining zol-gel materiallarning hosil bo’lish
jarayonlarida qo’llanilish xususiyatlarini shuningdek, boshqa tabiatli
ob’yektlaridagi ularga bog’liq bo’lgan agregatsion hodisalarni ko’rib chiqamiz.
Birinchi navbatda, turli tabiatli kolloidlar agregatsiyalarining namunalarini
ko’rib chiqamiz. Oltin kolloid zarrachasining agregatsiyasi o’lchami bir necha
nanometr bo’lgan oltin sfera zarrachalarining suyuq muhitidagi suspenziyaga ega
bo’lgan oltin kolloidlardan hatto o’rta asrlarda rangli atamalar ishlab chiqarishda
foydalanilgan. Bu zarrachalarning dispersiyasi uzoq vaqt davomida barqarordir. Bu
17](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_16.png)
![barqarorlik zarrachalar sirtida kolloid zarrachalarning o’zaro itarishishi tufayli
yuzaga keladigan elektr zaryadlarining borligiga bog’liq. Shunday qilib, uzoq ta’sir
etuvchi elektrostatik o’zaro ta’sirlar sistemadagi muvozanatni eritmada ”broun”
harakati holatida oltin kolloid zarrachalarining agregasiyasini oldini olish bilan
saqlab turadi. Kolloid oltin suspenziyasidagi muvozanatni buzish uchun sistemaga
oltin zarrachalarining sirtidagi zaryadga teskari bo’lgan harakatchan ionlarni
kiritish yetarlidir.
Bunda kolloid zarrachalarning uzoq ta’sir etuvchi itarishishi teskari ionlar
bilan samarali to’qnashadi. Metall zarrachalarining bir-biriga yaqinlashuviga
halaqit qiladigan elektrostatik to’siq yo’qoladi. Bu kab natijaga kolloid oltin
zarrachalari sirtidagi organik molekulalarni fiksatsiya qilish yo’li bilan ham
erishish mumkin. Elektrostatik to’siqning yo’qolishi tufayli kolloid zarrachalarning
Van-der-Vaals tortishish kuchlari hisobiga agregatsiyalanishi boshlanishi
ko’rsatilgan. Bu jarayonning 1-bosqichida eritmada alohida zarrachalar kabi
giffundirlovchi barqaror dimer hosil bo’ladi. So’ngra bu dimerning boshqa kolloid
zarracha (yoki dimer)lar bilan agregat o’sishining davom etishi bilan boradigan
agregatsiyalanishi sodir bo’ladi. Kolloid oltin suspensiyasidagi qaytmas
agregatsiya jarayoni natijasida o’lchami mikrongacha bo’lgan agregatlar o’sadi.
Buni mutlaqo shaffof eritmaning oqimtir rangga kirishidan bilish mumkin.
Elektron mikroskopda tarmoqlanishi kam sonli bo’lgan tolali agregatlardan hosil
bo’lgan xarakterli tartibsiz strukturalarni kuzatish mumkin.
Polimerlar kolloid zarrachalarining agregatsiyasi. L.Chipeletti va boshqa
mualliflar [20] tomonidan olib borilgan tadqiqotda o’lchami 10,5nm bo’lgan
polistirol kolloid zarrachalarining suvli dispers eritmasi tayyorlangan edi. Bunda
polimer zarrachalari suspenziyasining massa ulushi 0,01-0,1% oralig’ida o’zgardi.
Agregatsiyani initsirlash uchun sistemaga kam miqdorda MgCl
2 qo’shildi. Bunda
o’lchami bir necha o’nlab mikrometr bo’lgan tarmoqlangan agregatlar o’sadi.
Kolloid silikatlar agregatsiyasi. Kolloid silikatlar (zarrachalari o’lchami
o’nlab nanometer bo’lgan)ning suvli dispers eritmalari juda past konsentratsiyasi
(massa ulushi 0,01%)da ham barqarordir [22]. Tatqiqotda silikatlarning o’lchami 7
18](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_17.png)
![va 22 nm bo’lgan monodispers sferik zarrachalarning dispers eritmalari
foydalanil gan edi. Sistemadagi muvozanat kam miqdorda NaCl qo’shish yo’li
bilan buzilgan edi. Berilgan holatda agregatsion jarayonlar juda tez sodir bo’ladi.
30 sek davomida o’lchami mikrondan katta bo’lgan tarmoqlangan strukturalar
o’sadi.
Zol-gel sistemalarda agregatsiya. 1984-yilda D.Shefer va K.Kiferlar
tomonidan olib borilgan tadqiqotga zol-gel sintez reaksiya [22] sida bevosita hosil
bo’ladigan kolloid zarrachalarning fraktal agregatsiyasi birinchi marta kuzatildi.
Zol-gel sintez jarayoni tetraetoksisilanning suvli-spirtli eritmasida 2-
bosqichda amalga oshirildi. Kislotali kataliz shartida amalga oshirilgan1-bosqichda
4-ta silikat fragmentlardan tarkib topgan klasterlar hosil bo’lgan 2-bosqichda,
ishqorli kataliz sharoitida silikat fragmentlarning o’lchami 1 nm bo’lgan dastlabki
zarrachalarining hosil bo’lishi va ularning o’lchami 20 nm gacha bo’lgan
agregatlaridagi agregatsiyalanish bilan bo’ladigan polimerlanishi bo’yicha
yuqorida ko’rilgan 3-misoldan farq qilib, zol-gel sintez jarayonlari uchun dastlabki
zarrachalarning va ulardan hosil bo’lgan agregatlarning juda kichik o’lchami
xarakterlidir. Bunda strukturalanadigan eritmalarning konsentratsiyasi yuqorida
ko’rilgan misollardagi tayyor kolloid zarrachalarning strukturlanishiga nisbatan 2
marta past.
Yuqorida izohlanganlar singari agregatlarning fraktal xarakteri XX asr 70-
yillarining oxirlaridayoq S.Farrest va T.Uittenlar tomonidan o’rganilgan edi. Bu
turli tabiatli ob’yektlardagi fraktall tassavurlarga asoslangan agregatsiyalanish
hodisalarini o’rganishga turtki bo’ldi.
2 . 2.Gel hosil bo’lish jarayonlarni boshqarish asoslari
Bu bo’limni yozishda zol-gel texnologiyaning u yoki bu bosqichida
bo’ladigan o’zgarishlarga bardosh beruvchi moddalarning asosiy xossalarini ajratib
ko’rsatish va bu xossalar o’zgarishini ifodalovchi modelni yaratish kabi maqsadlar
qo’yilgan. Keyingi bo’limlarda model tasavvurlar bazasida zol-gel sistemalari
19](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_18.png)
![to’g’risida yanada to’liqroq ma’lumot olishni ta’minlovchi analiz usullari
xarakterlangan.
2 . 2.1.Dispers sistemalar haqida umumiy ma’lumot
Dispers sistema deb, bir biridan kuchli sirtqatlam bilan ajratilgan ikki yoki
undan ortiq sondagi fazalardan hosil bo’lgan sistemaga aytiladi. Dispers
sistemalarda fazalardan kamida bittasi mayda zarrachalar (kristallar, tolalar
plyonkalar, plastinkalar, nanotrubkalar, tachi kovak) holida boshqa birida, ya’ni,
yaxlit faza-dispersion muhitda tarqalgan bo’ladi. 2.1-jadvalda dispers
sistemalarning fazalar agregat holatlari bo’yicha klassifikatsiyasi keltirilgan
jadvaldan ko’rinishiga, dispers sistemalarning fazalar agregat holati bo’yicha 8-turi
mavjud ekan. Gaz-gaz dispers sistema hosil bo’lmaydi.
Zarrachalar o’lchami dispersligi bo’yicha sistemalarni dag’al dispers va yupqa
dispersli kolloid sistemalarga bo’lish qabul qilingan kolloid sistemalarda
zarrachalarning o’lchami 10 -4
dan 10 -7
gacha [23].
Zol-gel texnologiyasi termini deganda, umumiy belgilari eritma holda bo’lgan
dastlabki tashkil etuvchilarni gomogenlash, ularni zolga, so’ngra gelga aylantirish
bo’lgan materiallar tayyorlash jarayonlarining mohiyati nazarda tutiladi. Zol-gel
aylanish bosqichi strukturali to’rning hosil bo’lishiga olib keladi va suyuqlikda,
odatda kolloid eritmada berilgan haroratda amalga oshadi.
Shunday qilib, zollar yuqori dispers kolloid sistemalar bo’lib, ularda dispers
faza zarrachalari broun harakatida ishtirok etadi va faqat shu tufayligina ular
barqaror holatda qoladi. Termodinamik nuqtai nazardan zollar beqarordir.
2.1 jadval
Dispers sistemalarning fazalar agregat holat bo’yicha klassifikatsiyasi
Gaz Gaz Mavjud emas
Suyuqlik Gaz Tuman, bulut, aerazol
Qattiq Gaz Tutun, chang, kukunlar, aerazollar, qattiq
20](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_19.png)

![2 . 2.2. Zol-gel jarayonning mitsilyar nazariyasi
Zolning hosil bo’lish tabiatini tushunish uchun kolloid eritmalar tuzilishining
umumiy mitsillyar nazaryasiga murojaat qilamiz. Bunga muvofiq, zol 2 qismdan
mitsilla va intermitsillyar suyuqlikdan tashkil topgan [23]. Mitsilla deb, qo’sh
elektrik qavat maydon bilan o’ralgan dispers faza zarrachalariga ega bo’lgan
sturukturali kolloid zarrachaga aytiladi.
Intermitsillyar (ya’ni mitsillalararo) suyuqlik deb, mitsillani 2 qismga
bo’ladigan va o’zi elektrolitlar, noelektrolitlar sirtaktiv va boshqa
komponentlardan iborat moddalar eritmasi hisoblanadigan dispersion muhitga
aytiladi.
2 . 4-rasm. Kumush yodid (AgI) zoli mitsillasining tuzilish sxemasi
Misol sifatida kumush nitrat va kaliy yodid o’rtasida bo’ladigan kimyoviy
reaksiyada hosil bo’ladigan kumush yodid zolini qaraymiz. Reaksiya natijasida
suvda yomon eriydigan va kolloid zarrachalarning asosini tashkil etadigan kumush
yodidning mayda klasterlari hosil bo’ladi.
Fraktal strukturaga ega bo’lgan bu klasterlar agregatlar deb ataladi. Agar
reaksiya KI ortiqcha olingan sharoitda bersa, u holda, yod anoinlarining tanlab
22](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_21.png)
![adsorbsiyalanishi natijasida agregat sirtida 2.4-rasmda ko’rsatilgandek, manfiy
zaryadlangan qatlam hosil bo’ladi.
Yod ionlari bu holatda potensial hosil qiluvchi (PHQ) hisoblanadi. Kumush
yodidning m ta molekulasidan iborat agregat va PHQ mitsilla yadrosini tashkil
qiladi. Elektrostatik kuchlar ta’sirida yadroga teskari ishorali n sondagi ionlar,
asosan kaliy ionlari tortiladi. Bu ionlar qarshi ionlar deb ataladi va yadro
zaryadining o’rnini to’ldiradi (kompensatsiyalaydi). Ionlarning yadro eng yaqin
joylashgan bir qism (n-x) qattiq yadro sirtini namlab turuvchi suyuqlik qatlamida
bo’ladi. Bu ionlarga nafaqat elektrostatik kuchlar balki, yadroning Van-der-Vals
kuchlari ham ta’sir etib turadi. Shuning uchun bu ionlar yadroga mustahkam
bog’lanadi va qarshi ionlarning adsorbsion qatlami deb ataluvchi qatlamni hosil
qiladi. X qarshi ionlarning qolgan qism issiqlik harakati ta’sirida diffuziyalangan
(ya’ni, yuvib turiladigan) holda suyuq fazada joylashgan va ular diffusion qatlam
deb ataladi. Hosil bo’lganlarning barchasi birgalikda mitsilla deb ataladi.
Zollarning butun mitsillasi elektroneytralldir. 2.4-rasmda keltirilgan mitsilla
sturukturasini quyidagi formula orqali ifodalash mumkin.
{m[AgI]
n I -
(n-x)K +
} x-
xK +
Bu yerda, m -agregat tarkibidaga kiruvchi molekulalar soni n -potensial hosil
qiluvchi ionlar soni; ( n-x ) – adsorbsion qatlamdagi qarshi ionlar soni; diffuzion
qatlamni hosil qiluvchi qarshi ionlar soni.
Yadro adsorbsion qatlam bilan birgalikda aynan kolloid zarracha yoki
granulani hosil qiladi. Mitsilladan farq qilib, granula berilgan holatda manfiy (-x)
zaryadga ega bo’ladi. Granula berilgan va diffusion qatlam o’rtasidagi chegara
sirpanish sirti (masalan, “broun” harakatida yoki elektr maydon ta’sirida)
dispersion muhitga nisbatan o’z joyini o’zgartirgan holatida uning kolloid zarracha
va diffuzion qatlamga bo’linishi sodir bo’ladigan geometrik sirtini bildiradi.
Kolloid sistemalar barqarorligining fizik nazariyasi DLFO nazariyasi
B.V.Deryagin va L.D.Landaular (1937) va E.Ferveya va Ya.Overbek (1941) lar
tomonidan rivojlantirilgan edi.
23](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_22.png)


![Bu holatda ikki zarracha o’rtasidagi uzoq ta’sirlashuv sodir bo’ladi. Broun
harakati natijasida zarrachalar ikkinchi potensial o’raga mos keladigan masofa
qadar yaqinlashadi, lekin ?????? U
o’ o’rani yengib o’ta olmaydi va bir-biriga juda zich
yaqinlashadi.
Sistemaning strukturlanishi (gelning hosil bo’lishi) sodir bo’ladi. Bunda
zarrachalar o’rtasida dispers faza qatlami saqlanib qoladi.Gidrofob zollarning
holati keltirilgan qonuniyatga mos keladi [20].
Agar zol zarrachalari katta elektr potensialga va diffuzion qatlamning katta
qalinligiga ega bo’lsa, u holda 2 zarracha qo’sh elektr qavatining qoplanishida
elektrostatik itarishish energiyasi molekulalararo tortishish energiyasidan ustun
keladi. Zarrachalarning sirpanishiga halaqit qiluvchi energetik g’ov U
g’ paydo
bo’ladi. Shuning uchun yaqinlashuvchi zarrachalar yana tarqaladi va bir-biridan
ajraladi. Sistema agregat holatda barqarordir.
Zol-gel aylanishni amalga oshirish uchun diffusion qatlamni siqish lozim.
Bunga dispersion muhitdagi ionlar konsentratsiyasini o’zgartirish yo’li bilan
erishish mumkin. Bu holda zarrachalar o’rtasidagi masofa kichiklashadi. Tortishish
va itarish kuchlari potensial o’rani hosil qiladi va gel hosil bo’lishi sodir bo’ladi.
Diffusion qatlamning yanada kichiklashgan holatda tortishish kuchlari itarish
kuchlaridan ustun kelganda zarrachalar o’rtasidagi masofaning qisqarish shartiga
erishiladi. Natijada zolning koagulyatsiyalanishi kuzatiladi.
Gel hosil bo’lish jarayonlarini amalga oshirishning ko’rilgan sxemasi
sistemaning agregat holatdagi barqarorligining temperatura ta’sirida yo’qolish
sabablarini tushunish imkonini beradi. Potensial g’ov ?????? U
g’ (kT birliklarida
o’lchanadigan) qiymatini pasaytiruvchi barcha omillar sistemaning agregat
holatdagi barqarorligini ham muqarrar pasaytiradi. Ko’rilgan omillarning
o’zgarishi bilan birga sodir sodir bo’ladigan eskirish jarayonlari ham zol-gel
sistemalarda bo’ladigan jarayonlarga ta’sir qiladi.
Yuqorida qayd etilganidek, adsorbsion-solvatlanish omili barqarorligining roli
bo’lgan eritmalar uchun DLFO nazariyasi taqribiy (haqiqatga birmuncha yaqin)
hisoblanadi, bu holatlarda adsorbsiyaning o’ziga hosligini va ionlarning
26](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_25.png)
![erituvchiga o’xshashligini hisobga olish lozim. Yana shuni qayd etish kerakki, zol-
gel jarayonlarda zarrachalarning zaryadlanishini boshqarish mumkin.
Masalan, agar ko’rilgan holat uchun dastlabki komponentlar konsentratsiyasi
o’zgartirilsa, (AgNO
3 va KI lar o’zaro ta’sirlashuv reaksiyasini AgNO
3 ortiqcha
olinganda amalga oshirish) u holda qiyin eruvchan AgI agregatiga I -
ionlari emas,
Ag +
ionlari tanlab adsorbsiyalanadi va mitsilla formulasining ko’rinishi
quyidagicha bo’ladi.
{m[AgI]
n Ag +
(n-x)NO
3 -
} x+
x(NO
3 ) -
2 . 2.3. Kimyoviy va fizik gellar olishning o’ziga xos xususiyatlari
Zol-gel texnologiya shartli ravishda kimyoviy polimer gel alkooksidlarning
gidrolizi va polikondensatsiyasi va fizik norasmiy gel (anorganik zollarni gellash)
olishning prinsipial turlicha usullariga ko’ra 2 guruhga bo’linadi. Kimyoviy gel
olish texnologiyasida dastlabki materiallar metallar yoki metalmaslarning
alkooksidlari hisoblanadi. Bu materiallardan gologen spirtli eritmalar tayyorlanadi
va gidrolizlash va polikondensatsiyalash usullari yordamida oksidlarning
monomerlari olinadi. Bu monomerlar termik qayta ishlash yo’li bilan olinadigan
quruq gel (kserogel) deb ataluvchi gomogen kristallmas gelga aylantiriladi.
Fizik gel olish texnologiyasi metallar va metallmaslar tularining gomogen
suvli eritmalarni tayyorlashdan iborat. Bulardan gidroliz usulida akva, gidrokso va
oksokomplekslar olinadi. Bu komplekslar so’ngra kristallmas gel va kserogel
olinadigan gomogen kolloid zollarga aylantiriladi.
Har ikkala usulda ham, texnologik jarayonlar eritmalar tayyorlashdan
boshlanadi, so’ngra gidroliz va polikondensatsiya jarayonlari boradi.
Moddalarning suv ta’sirida parchalanish reaksiyasi gidroliz deb atalishini eslatib
o’tamiz.
Olinadigan gelning xossalarida ham farq bo’ladi. Fizik gelning hosil bo’lishi
qoida ko’ra qaytar jarayon ya’ni, yangi tushgan cho’kma peptizatsiyalanadi
(zarrachalarning dezagregatsiyalanishi). ”Kimyoviy gel” peptizatsiyalanmaydi.
27](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_26.png)

![Eritmada boshqa reagentlar bo’lmaganda ligantlar (markaziy metall atomi
bilan bevosita bog’langan molekulalar va ionlar) sifatida akva-(OH
2 ) gidrokso-
(OH) va okso-(=O) guruhlar ishtirok etishi mumkin. Aniq elementlar ionlarining
suvli eritmalardagi holati M g+
kationning “g’” zaryadiga va muhitning pH iga
bog’liq bo’ladi. Kationning zaryadi va eritmaning pH qancha katta bo’lsa, akva
kompleks gidrokso va oksokomponentlarga shuncha ko’p aylanadi.
Eritmada boshqa anionlarning bo’lishi akva- va gidroksokomplekslarning
tarkibi va barqarorligiga sezilarli ta’sir qilishi mumkin. Bu kabi komplekslarning
hosil bo’lishi va barqarorligi dissotsiyalanish reaksiyalari asosida baholanadi.
[M +g’
(OH -
)
n (x -
) (OH
2 )
g’-n-1 ] (g’-n-1)+
+H
2 O→[M +g’
(OH -
)
n (OH
2 )
g’-n ] (g’-n)+
+x
Agar X -
ion H
2 O ligandlarga nisbatan elektromanfiyroq bo’lsa, reaksiya
muvozanati chapga siljiydi. U holda, X -
ion kuchli M-x kovalent bog’lanish hosil
qiladi. Bu bog’ning barqarorligi gidroliz jarayoniga ham ta’sir qiladi
[M +g’
(OH -
)
n (x -
) (OH
2 )
g’-n-1 ] (g’-n-1)
+ H
2 O→[M +g’
(OH -
)
n+1 (OH
2 )
g’-n-1 ] (g’-n-1)
+Hx
Aniq sharoitlarda komplekslar kondensatlanish reaksiyasiyalariga ishtirok
etishi mumkin. Bunda ishtirok etuvchi guruhlar kiruvchi va chiquvchi guruhlarga
bo’linadi. Akvaguruhlar har doim chiquvchi guruhlar sifatida ishtirok etadi va
akvakomplekslar kondensatlanishga moyil emas. Oksoionlar yomon chiquvchi
guruhlar hisoblanadi.
Yuqorida ifodalanganlardan ko’rinishiga, polimer (kimyoviy) va norasmiy
(fizik) gellarda bo’ladigan ajralish yetarlichi shartlidir.
2 . 2.4. Zol olish usullari va zol hosil bo’lish jarayonlarini boshqarish
Zollarni olishda turli xil kimyoviy reaksiyalardan (qaytarilish, oksidlanish,
qo’sh almashinish, gidroliz); fizikaviy kondetsatlanish usullaridan (erituvchini
almashtirish usuli yoki suyuqlikdagi qandaydir moddaning bug’larini chiqarish)
shuningdek, elektr usullaridan (Brandt usuli-metallarning suvli yoki boshqa
organik suyuqlik ostida elektr kuchlanish (volt) yoylari ta’sirida kukunga
aylanishi; Svedberg usuli-yuqori chastotali razryad ta’sirida kukunga aylanishi)
29](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_28.png)


![Eskirish jarayonida polikondensatlanish bevosita gel to’rida davom etadi
(bunda M-OH guruh saqlanadi) sinerezis (to’r hajmining kovakchalaridan suyuqlik
chiqishi bilan birga o’z-o’zidan kichrayishi) namoyon bo’ladi, turli o’lchamli
dastlabki zarrachalardan tashkil topgan moddalarning erish va qayta cho’kishi
hisobiga to’r sirtining qo’pollashuvi (dag’allashuvi) boshlanadi. Bu turning ichki
zvenolaridagi zarrachalar, shuningdek, qo’shni zanjirlar o’rtasida qo’shimcha
bog’larning hosil bo’lishiga bog’liq. Eskirish natijalari quritish bosqichida
namoyon bo’ladi.
Quritish, zol-gel texnologiyaning muhim jarayoni. U gelda kuchli
o’zgarishlarni keltirib chiqaradi va bu kuchli qisqarish, dastlabki zarrachalar
to’pining joylashish zichligi ortishi, ular o’rtasidagi juda tor tirqishlarning
kichrayishi va material solishtirma sirtining kichrayishi bilan birga davom etadi.
Quritishda suyuqlikning kapillyarlardan bug’lanishi sodir bo’ladi va gel sferasining
faqat deformatsiyasiga emas, balki buzilishiga olib kelishi mumkin. Bo’lgan
mexanik kuchlanish paydo bo’lishi mumkin [28].
Kapillyar kuchlar materialni quritishda hosil bo’ladigan g’ovaklikka ham
ta’sir qiladi. Kapillyarlarda bosimning tushib ketishini kamaytirish uchun gelning
suyuq fazasiga sirt ishqalanish koeffisiyenti qiymati kichik bo’lgan sirt faol modda
kiritmadi.
Asosiy samaraga suyuqlik yuqori kritik hamda sirt ishqalanish qiymati
amalda nolga teng bo’lgan sharoitlarda gel g’ovaklaridan bug’ fazaga
o’tkazilganda erishiladi. Bunda gel kichraymaydi va aerogelga aylanadi, g’ovak
hajmi umumiy hajmning 98 % ini tashkil qilishi mumkin.
Hozirda anorganik materiallarning zol-gel texnologiyasi (intensiv) jadal
rivojlanmoqda. Ular yordamida yupqa keramikaning yangi turlari,noyob fizik
xossalariga ega bo’lgan yupqa plyonkalar, optik muhit, anorganik kompozitlar,
nanokompozitlar olingan. Ilmiy tadqiqotlarning juda katta qismi oksidlardan
olingan materiallar zol-gel texnologiyasiga bag’ishlangan bo’lib, bu
materiallarning yarim o’tkazgichli gaz sezgir sensorlarda, katalizda tolali optikada,
va radiotexnik keramikadagi o’ziga xos ahamiyatga ega.
32](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_31.png)

![Polimer to’rlarning yoki uning fragmentlarni hosil bo’lishida dastlabki
eritmaning qovushqoqligi sezilarli darajada o’zgaradi. Shuning uchun zol-gel
nanotexnologiyani nazorat qilishning samarali usuli sifatida qovushqoqlikni
o’lchash usuli hisoblanadi. Qovushqoqlik qiymatiga asoslanib zolning eskirishi
zarrachalarning samarali o’lchamlari va hatto ularning fraktal o’lchamlari haqida
fikr yuritish mumkin.
Qovushqoqlik qiymatiga asoslanib “zolning eskirishi” zarrachalarning
samarali o’lchamlari va hatto ularning fraktal o’lchamlari haqida fikr yuritish
mumkin.
2.1. Sorbentlarning adsorbsion va katalitik xossalari
Metallar oksidlariga shimdirilgan NiO nanozarrachalar ko`plab katalitik
reaksiyalarda, jumladan gidrodexlorlash [1,60,29], vodorodning to`yinmagan va
aromatik uglevodorodlarning to`yinmagan bog`lari bo`yicha boradigan birikish
reaksiyalarining katta guruhini o`z ichiga oluvchi Murojat etilgan- [2 ,66,46 ], CO
ning CO
2 gacha selektiv oksidlanishi jarayonlarida [3 ,43 ], toluolning oksidlanishi
reaksiyasida [4 ,58 ] yuqori katalitik faollikni namoyon qiladi.Nanozarrachalar
fizikaviy va kimyoviy xossalari asosiy sabablaridan biri hajmiy fazalar ichidagi
atomlarga nisbatan boshqacha sharoitlarda bo`lgan sirt atomlar ululishining
oshishidir. Zarrachalarga o`lchamining kattalashishi bilan sirt atomlarining ulushi
kamayadi [5,60].
Metallar va ular oksidlari nanozarrachalarning adsorbsion va katalitik
xossalari eritma tabiatiga, uning tutuvchi bilan o`zaro ta`sirlashuv xarakteriga,
tutuvchining kimyoviy tabiatiga, olingan zarrachalarni tayyorlash sharoitiga va
o`lchamiga [6,44] bog`liq.
Katalizator sirtida boradigan katalitik reaksiyalarda dastlabki moddalar
molekulalarning adsorbsiyalanishi, adsorbsiyalangan moddalarning kimyoviy
34](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_33.png)
![o`zgarishi va reaksiya mahsulotlarining desorbsiyalanishi sodir bo`ladi. Metallar va
ular oksidlari immobilizatsiyalangan nanozarrachalarda boradigan katalitik
reaksiyalar mexanizmini tushunish uchun ularning tutuvchilar va reagentlar bilan
o`zaro ta`sirlashuv kuchi va tabiati haqidagi ma`lumotlar zarur [7-10].
2.2. Xromatografiya uchun sorbentlarga qo`yiladigan talablar
Xromatografiyaning eng muhim tarkibiy qismi sorbentdir. Zarrachaning
aynan o`lchami, sorbent sirtining tuzulishi va xossalari xromatografik
sistemalarning xossalarini yetarli darajada aniqlash imkonini beradi.
Xromatografiyadagi sorbent materialiga bir qator murakkab talablar
qo`yiladi:
Birinchidan, kalonka materiali yetarli darajada barqarorlikga va qattiqlikka ega
bo`lishi, kalonkada elyuentning bo`lishi va uning tarkibiga kam bog`liq bo`lishi
kerak.
Ikkinchidan, sorbent yetarli darajada bir xil sirtga va chegaralangan fraksion
tarkibli zarrachalarga ega bo`lishi zarur.
Uchinchidan, sorbent bilan elyuent komponentlari va shuningdek ajratiladigan
namuna o`rtasida qaytmas kimyoviy o`zaro ta’sirlashuv sodir bo`lmasligi zarur.
Bu kabi talablarga ko`plab anorganik va organik materiallar yetarli darajada
javob beradi, biroq sorbentlarning uzoq muddatli barqarorlik xossasini, solishtitma
sirti qiymatini qayta tiklovchilik xususiyatini namoyon qila oladiganlar silikagelli
va alyuminiy oksidlari hisoblanadi.
Ma’lumki, xromatografiyada sorbent sifatida sirkoniy, magniy va titan
oksidlari, turli tuzilishli alyumosilikatlar, anorganik tuzlar va boshqalarning
qo`llanilishiga oid ko`plab ishlar qilingan. Biroq, ananaviy silikagel sorbentlar,
35](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_34.png)













![(1.36)
bu yerda D=B(T/β) 2
.
Bu tenglamada W-adssorbsiyalangan suyuqlik hajmi, bunda W=n/ρ, bu
yerda ρ-adsorbatning mikrog`ovakdagi zichligi 1.36-tenglamaga muofiq DR
grafigi, ya’ni lgW ning [lg(ρ 0
/ρ)] 2
ga bog`liqligi mikrog`ovak umumiy hajmi W
0
logarifmiga teng, ordinata o`qini kesib o`tuvchi kesma, ya’ni to`g`ri chiziq
ko`rinishiga ega bo`lishi zarur.
Tajriba yo`li bilan aniqlanishiga, ko`p sonli DR grafiklar sistemasi
haqiqatdan ham to`g`ri chiziqli ko`rinishiga ega bo`ladi (1.5.-rasm), lekin
keltirishining yondashuvi bir qator kamchiliklari bor. Masalan, bu tenglama ham
mikrog`ovakli ham g`ovaksiz namunalardagi adsorbsiya jarayonini yoritadi.
Bundan tashqari, DR grafiklarida qo`shimcha to`g`ri chiziqlilar har xil turdagi
chetlashuvlar kuzatiladi: har xil sistemalar uchun ular [lg(ρ 2
/ρ)] 2
nisbatga ko`ra
o`qqa nisbatan qovariq yoki yoyiq bo`lishi mumkin.
1.5-rasm 20 0
C da ko`mirni faollashuv darajasini ketma-ket ortib borishida benzol
adsorbsiyasi uchun lgn(n,mmol/g) ning [lg(ρ 0
/ρ)] 2
ga bog`liqligi.
49](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_48.png)




![Ko’pgina mezog`ovak metal oksidlari katalizator sifatida muvaffaqiyatli
ishlatilgan, silikatlar va aluminosilikatlar eng katta e’tiborga ega. Masalan,
silikatlar oksidlanish, degidratlanish va polimerlanish reaktsiyalarida ishlatilgan
[7]. Shu bilan birga, mezog`ovak materiallar ajratish, optoelektronika va selektiv
adsorbsiya kabi ko’plab boshqa sohalar uchun ham katta imkoniyatlar yaratadi.
Kremniy oksidi asosidagi mezog’ovak materiallarni sintez qilish va qo’llashga
katta e’tibor berilgan bo’lsa-da, alumininiy oksidi analoglarini tadqiq qilishda
bo’sh joy mavjud. Yuqorida aytib o’tilganidek, aluminiy oksidi o’zining noyob sirt
kimyosi va ajoyib fizik xususiyatlari tufayli sanoatda ko’plab katalitik va
nokatalitik jarayonlarda samarali qo’llaniladi. Faollashtirilgan alyuminiy oksidi
odatda an’anaviy tarzda cho’ktirish usuli bilan tayyorlanadi [19]. Uning sirt yuzasi
taxminan 200 m 2
/g ni tashkil qiladi, teksturali g`ovaklilik va keng g`ovak hajmi
taqsimoti. Boshqariladigan g`ovak hajmi va kichik g’ovak o’lchamlari taqsimotiga
ega bo’lgan sof mezog`ovak aluminiy oksidi namunalarini sintez qilish usulidan
foydalanish katta qiziqish uyg’otadi.
Huo va boshqalar [16] aluminiy oksidi asosidagi mezog’ovak materiallarni
elektrostatik qarama-qarshi ionlar vositasida (S -
M +
I -
yo’nalishda (ketma-ketlikda) )
sintez qilish borasida o’z tadqiqotlarini olib borishgan. Templant sifatida
C15H25OPO3H2 va alyuminiy manbai sifatida Al(NO)
3 lardan foydalanib, turli
pH sharoitida ikki qatlamli mezofazalar [C15H25OPO3]*Al (OH) H2O va
[Ci5H250P03NaH]*Al (0H)
3 *7.5H20 sintez qilingan. Materiallarning tuzilishi 27
Al
YaMR dan foydalanib o’rganildi. Ikkala material ham suvli eritmadagi Al(NO)
3 ga
nisbatan 5 dan -20 ppm gacha bo’lgan kimyoviy siljishlar bilan rezonans
signallarini ko’rsatdi, bu barcha alyuminiy atomlari oktaedral muvofiqlashtirilgan -
ligini ko’rsatdi. Afsuski, sintez qilingan mahsulotlar barqaror bo’lmay ko’ydirish
jarayonida sirt faol moddalarni yo’qotishda qulab tushdi .
Yada va uning hamkasblari [20] gomogen eritmadan cho’ktirish usuli
yordamida mezog`ovak aluminiy oksidini sintez qilishgan. Templant sifatida natriy
dodesil sulfat (SDS) va alyuminiy manbai sifatida alyuminiy nitrat
monogidroksididan geksagonal tartibli strukturaga ega mezog`ovak aluminiy
54](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_53.png)
![oksidi sintez qilingan. Sintez jarayonining asosiy bosqichi – bu reaksion
aralashmaning kislotaligini o’zgartirish va gidroliz reaktsiyasi tezligini nazorat
qilish uchun pH modifikatori sifatida karbamidning ishlatilishi edi. Termik ishlov
berish yoki etanol yoki aseton kabi erituvchilar yordamida sirt faol moddalarni
yo’qotish orqali mezostrukturani saqlab bo’lmaydi. Qattiq modda asosiy eritmada
bir necha kun saqlanganda, olingan material yuqori harorat 600°C da issiqlikka
chidamli ekanligi qayd etilgan.
Vaudry va uning hamkasblari [21] o’zlarining ishida mezog’ovak va
taqsimlanishiga ko’ra o’lchami kichik bo’lgan g’ovaklarga ega sof aluminiy
oksidini sintez qilish usulini yoritib berishgan. Alyuminiy alkoksidi quyi
molekulyar massali spirtli erituvchilarda suvning nazorat qilinadigan miqdori bilan
gidrolizlangan. Karbon kislotalar tarkibida kondensatsiyalangan aluminiy oksidi
bo’lgan o’z-o’zidan yig’iladigan templant fazasini olish uchun ishlatilgan.
Difraktogrammalarning ko’rsatishicha, d-oraliqdagi yuqori intensiv cho’qqidan
tashqari, olingan materialning kristall holatini ko’rsatadigan psevdobemit
strukturasiga tegishli to’rtta keng past intensiv cho’qqilar topilgan. Mezofazalarni
alyuminiy alkoksid-spirt-karbon kislota tizimidan foydalangan holda turli xil
reaktsiya sharoitlarida olish mumkin. Gelning yetilish va gidroliz reaktsiyasi vaqti
materialning shakllanishiga kamroq ta’sir ko’rsatishi, ko’ydirishdan so’ng
mezog’ovak struktura saqlanib qolishi qayd etilgan. Garchi ular sirt faol
moddaning alkil zanjiri uzunligini o’zgartirgan bo’lsalar ham, g’ovak o’lchami
o’zgarmagan va har doim taxminan 20Â atrofida bo’lgan, bu MCM materiallari
bilan solishtirganda g’ovak o’lchamini boshqarishning boshqa mexanizmi
mavjudligini ko’rsatadi.
Bagshaw va boshqalarning [22] ishida neytral templant ishtirokida
mezog’ovak aluminiy oksidi asosidagi materialni sintez qilish usuli yoritilgan.
Strukturani yo’naltiruvchi agent sifatida tarkibida polietilen oksidi (PEO) va
polipropilen oksidi (PPO) bo’lgan tri-blok sopolimer ishlatilgan. Alyuminiy
alkoksidi organik va noorganik birikmalar o’rtasida vodorod bog’lanish kuchi
mavjudligi sababli sirt faol modda mitsellasi karkasining sirtida gidrolizlanadi va
55](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_54.png)
![kondensatsiyalanadi. BET natijalari materialning bir xil o’lchamli g’ovaklardan
iborat ekanligini ko’rsatdi, ammo uning diffraktogrammalarida
«chuvalchangsimon» g’ovak motivi postulyatsiyasiga olib keladigan uzoq masofali
tartib kuzatilmadi. Olingan materialning sirt yuzasi 400-600 m 2
/g va g’ovak
o’lchamlari 24-46Â oralig’ida bo’lgan. Mualliflarning ta’kidlashicha, bu material
yaxshi termik barqarorlikka ega bo’lmagan va keyingi ishlar [23] mezog’ovak
aluminiy oksidi molekulasi strukturasi (karkasi) ga noyob tuproq elementlarini
kiritish orqali uning termik barqarorligini oshirishga qaratilgan.
Cabrera va hamkasblari [24,25] mezog’ovak aluminiy oksidi asosidagi
materialni tayyorlashning yangi usulini taklif qilishgan bo’lib, unda «gidrolizni
kechiktiruvchi reagent» ishlatilgan. Mualliflar o’zlarining bu usulida alkil zanjiri
uzunligini o’zgartirish yoki mezog’ovak materialning g’ovak hajmini nazorat
qilish uchun yordamchi kimyoviy moddalarni qo’shish o’rniga, g’ovak hajmi
suvning trietanolamin (TEA) kabi «gidrolizni kechiktiruvchi vosita» ga nisbatini
ehtiyotkorlik bilan o’zgartirish orqali nazorat qilingan. Alyuminiy alkoksidi suv va
trietanolamin aralashmasiga qo’shilganda, alyuminiy alkoksidning
transesterifikatsiyasi natijasida tegishli atran kompleksi hosil bo’lgan. Yakuniy
mahsulot materialining hosil bo’lgan tarmog’i prekursor eritmasidagi agregatlar
hisobiga nazorat qilinganligi sababli, gidrolizni kechiktiruvchi reagent qo’shilishi
eritmadagi alyuminiy alkoksid turlarini kamaytirish orqali gidroliz tezligini
o’zgartirishi mumkin. Mualliflar olingan namuna chuvalchangsimon g’ovak
tuzilishga va bir-biriga kuchli bog’langan g’ovaklar tizimiga egaligini va
namunaning g’ovak hajmini oddiy usul bilan aniqlash mumkinligini ta’kidlashgan.
Biroq, ularning namunalari notekis, shimgichga o’xshash qadoqlash motivi va
taqsimlanishiga ko’ra katta hajmli g’ovaklarga ega bo’lgan nisbatan zaif tekstur
xususiyatlarga ega bo’lgan.
Liu va boshqalar [26] o’z ishlarida mezog`ovak aluminiy oksidini alyuminiy
alkoksidini tartarik kislota eritmasida gidrolizlash orqali sintez qilishganligini
ta’kidlashgan. Usulning ilmiy jihatdan yangiligi g’ovak hajmini o’zgartirishga
yondashuvdan iborat edi. Sintezda strukturani yo’naltiruvchi agentning
56](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_55.png)
![kontsentratsiyasi (dibenzoil-L-tartar kislotasi, DBTA) materiallardagi g’ovak
hajmini moslashtirish uchun ishlatilgan. Mazkur sintezni amalga oshirish uchun l g
alyuminiy alkoksidi 3,8 g suvda gidrolizlanib, 30 daqiqa davomida aralashtirilgan.
So’ngra aralashma 30 daqiqa davomida aralashtirib turilib 80-90°C gacha
qizdirilgan. Aralashma xona haroratigacha sovutilgandan so’ng 0,2 g HNO
3
qo’shilgan. Eritma aralashtirilib turilgan holda DBTA eritmasi bilan etanolda
aralashtirilgan. Gel hosil bo’lishi aralashmani xona haroratida bir hafta davomida
quritish jarayonida sodir bo’lgan. Olingan namunalarning diffraktogrammalaridagi
natijalarga ko’ra kichik burchakli sohada keng cho’qqi hosil bo’lgan. Ushbu
cho’qqining intensivligi kuchli bo’lgan va mos d-oraliq yuqori pozitsiya tomoniga
oshgan. Sintez qilingan materiallar uchun keng burchak ostida olingan rentgen
analizi natijalari namuna tarkibida kristall strukturali bemit mavjudligini korsatdi.
Materiallarning sirt yuzasi 386-425 m 2
/g oralig’ida, g’ovak hajmi 0,5 sm 3
/g
atrofida bo’lgan. Biroq, bu namunadagi g’ovak hajmi 33-42 Â oralig’ida o’zgarishi
mumkin.
Ji va boshqalar [27] tomonidan alyuminiy tri-sekbutoksid-2,4-pentandion-2-
propanol-nitrat kislota prekursorlari yordamida yuqori sirt yuzali aluminiy oksidi
namunalari sintez qilingan. Prekursor eritmalari alyuminiy tri-sek-butoksidni
(ASB) ni i’-PrOH da magnitli aralashtirgich yordamida aralashtirib turilgan holda
eritish orqali tayyorlangan. Gidroliz eritmaga HNO
3 kislota eritmasi yoki
deionlashgan suv qo’shilgandan keyin boshlangan. So’ngra hosil bo’lgan
aralashmalar yopiladi va gel hosil bo’lguncha kuchli aralashtiriladi. 10 kun
davomida xona haroratida gelning yetilish jarayoni amalga oshiriladi. Turli
reaksiya sharoitlarida olingan namunalarning kristalliligi o’rganilgan. Amorf
gellarning 400-800°C da -Al
2 O
3 ga, 1000-1050°C da -Al
2 O
3 ga aylanishi
aniqlangan. Termik ishlov berish jarayonida fazaviy o’zgarishlarga mos keladigan
ketma-ket ikkita sirt yuzaning kichirayishi kuzatilgan. Dastlabki kserogelni
ko’ydirish (kaltsinatsiyalash) orqali mezog`ovak aluminiy oksidini olish mumkin.
Yao va boshqalar [28] o’z ishlarida ultratovush yordamida xona haroratida
aluminiy oksidi zolini olishning yangi zol-gel usulini yoritib berishgan.
57](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_56.png)
![Taqsimlanishiga ko’ra o’lchami kichik bo’lgan g’ovaklardan iborat mezog’ovak
aluminiy oksidini hech qanday templant yoki boshqa organik qo’shimchalar
qo’shmasdan aluminiy oksidi eritmasini 550°C da ko’ydirish (kaltsinatsiyalash)
orqali olish mumkin. Aluminiy oksidi zolining rentgen diffraktogrammalari
namunaning dominant fazasi psevdobemit , shuningdek gelsimon bemitdan iborat
ekanligini ko’rsatgan. Mualliflar IV tipga mansub adsorbsiya/desorbsiya
izotermasi va namunaning g’ovak o’lchamlariga ko’ra taqsimotiga asoslanib,
mezog’ovak aluminiy oksidi mikrog’ovak aluminiy oksidi zollarini ma’lum
haroratlarda isitish orqali olinganligini ta’kidlashgan. Ular namunadagi
mezog’ovaklar sferik -Al
2 O
3 zarrachalarning o’lchami, shakli va prekursorlar
nisbatining to’g’ri tanlanishi hisobiga hosil bo’ladi deb taxmin qilishgan. Olingan
sferik zarrachalar o’lchami bo’yicha bir xil bo’lganligi sababli, nanozarrachalar
o’rtasidagi asosan oraliq bo’shliqlar bo’lgan mezog’ovaklar taqsimlanishiga ko’ra
kichik o’lchamli bo’lgan.
Hik va Pinnavaya [29] nanozarrachalarning o’z-o’zicha yig’ilishi usulidan
foydalanib, mezog’ovak bemitni (AlOOH) sintez qilishgan. Oddiy sintezda
alyuminiy tri-sec-butoksid etanol va deionlashgan suv aralashmasi va kerakli sirt
faol modda (masalan, sirt faol modda sifatida amin) eritmasida kuchli
aralashtirilgan holda xona haroratida gidrolizlangan. Reaktsion aralashma xona
harorati yoki 45°C da aralashtirgichli (silkituvchi) hammomda 20 soat davomida
yetiltirilgan. Sof toza namuna filtrlash orqali olingan, suv va etanol bilan yuvilgan.
Kichik burchakda olingan rentgen diffraktogrammalari 2 ning 1 va 3 darajalari
orasida olingan xarakterli cho’qqi qisqa masofali (o’xshash) tartibga tegishli
ekanligini ko’rsatgan. Qarish jarayonida amorf holatdan bemit kristalli tuzilishga
fazali o’zgarishlar yuz berdi. turli reaktsiya vaqtlariga ega bo’lgan namunalar
uchun XRD burchagi. Mualliflarning taxminiga ko’ra, materialning
mezog’ovakligi kattaligi va o’zaro o’sishi sirt faol modda orqali amalga oshirilishi
mumkin bo’lgan boehmit nanapatikullari orasidagi oraliq bo’shliqlar tomonidan
yaratilgan. Shunday qilib, asosan mezog`ovakli boehmit materiallarini
shakllantirishda shablonlash jarayoni mavjud emas edi. Mezog`ovakli aluminiy
58](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_57.png)
![oksidi materiallari uchun sintetik yo’nalishlarni ishlab chiqishga ko’p kuch
sarflangan bo’lsa-da, hisobot natijalarining xilma-xilligi va qayta ishlab
chiqarilishi sintetik materiallarni haqiqiy nazorat qilish uchun muhim yutuqlarga
erishish kerakligini ko’rsatadi. sozlanishi mumkin bo’lgan g’ovak hajmi, yaxshi
termal va kimyoviy barqarorlik va tor g’ovak hajmi taqsimoti bilan mezog`ovak
aluminiy oksidi uchun protsedura.
2.3. Alyuminiy oksidi asosidagi mezog’ovak sorbentlarning termik barqaorligi
Issiqlik barqarorligi mezog`ovakli aluminiy oksidi materiallari uchun ularni
tayyorlashda ham, qo’llashda ham muhim xususiyatdir. Ba’zi tadqiqotchilar
mezog`ovakli aluminiy oksidilarni sintez qilishdi [16,20], ammo materiallar
kalsinlanish jarayonida yuqori haroratga bardosh bera olmadi. Kalsinlash paytida
mezog`ovak aluminiy oksidining termal barqarorligi Bagshaw va Pinnavaia [22],
Vodri va boshqalar tomonidan ham tekshirilgan. [21] va Cabrera va boshqalar.
[24], the Kalsinlash yo’li bilan shablonni olib tashlangandan keyin ularning
materiallarining mezostrukturasi saqlanishi mumkin edi. Kalsinlash paytida termal
barqarorlikka qo’shimcha ravishda, katalizda qo’llanilishi kerak bo’lgan
materiallarda yuqori isitish (ayniqsa, 500-800 ° S harorat oralig’ida) strukturaning
barqarorligi muhim ahamiyatga ega. Biroq, hozircha bu mavzuga oid hech qanday
xabar topilmadi. Termal ishlov berish jarayonida turli alyuminiy gidroksidlari turli
xil issiqlik evolyutsiya yo’llarini beradi. Misol uchun, gibbsit taxminan 300 ° C da
o’tish aluminiy oksidi (islohot) ga dehidroksillanadi, boehmit yoki
psevdobemitning o’tish alyuminiy oksidiga (y-formasi) degidroksillanishi
taxminan 475 ° C ni talab qiladi [6], odatdagi sol-gel jarayonida [30] ], alyuminiy
alkoksidining gidrolizi natijasida olingan alyuminiy gidroksid bayerit yoki gibsit
tuzilmalarini beradi. reaksiya harorati 80 ° C dan past bo’ladi va aks holda boehmit
tuzilishi. Ushbu alyuminiy gidroksid prekursorlarining o’tish alyuminiy oksidiga
o’tish jarayoni alyuminiy oksididagi strukturaviy va alyuminiy muvofiqlashtirish
o’zgarishlariga to’g’ri keladi. Yuqori haroratli ishlov berish paytida strukturaning
59](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_58.png)
![barqarorligi va alyuminiyning muvofiqlashtirish holatlari o’rtasidagi o’zaro
bog’liqlik mezoporli aluminiy oksidi materiali uchun xabar qilinmagan.
2.4. Mezog’ovak materiallar morfologiyasi nazorati
Mezog`ovakli materiallarning morfologik nazorati ko’pgina hisobotlarda
keng tadqiq etilgan ramka mezog`ovakligidan tashqari, g’ovakli materiallardan
foydalanishda ham juda muhim bo’lishi mumkin bo’lgan tekstura mezog`ovakligi
va makroporozligi mavjud. Teksturali mezog`ovaklik mohiyatan kristall
bo’lmagan intraagregat bo’shliqlari va zarrachalar orasidagi aloqa natijasida hosil
bo’lgan bo’shliqlardan kelib chiqadigan g’ovaklik. Qurilish bloklari sifatida asosiy
zarrachalardan foydalanib, uzunlik shkalasining yuqori darajasidagi mezoporli
materiallarning morfologiyalarini qurish mumkin edi. Olingan materiallar bir
necha darajadagi aniq belgilangan tuzilmalarga ega bo’lgani uchun ularni «ierarxik
tartiblangan materiallar» deb atash mumkin. Mezog`ovakli materiallarni qo’llashda
makroshkala uzunligida aniq belgilangan tuzilishga ega bo’lgan zarrachalarni
ishlab chiqarish foydali bo’ladi. Masalan, katalizatordagi mezoporlar ustidagi
makrog’ovaklik molekulalarning reaksiya sodir bo’ladigan mezoporlarga yoki
undan tashqariga tarqalishini osonlashtirishi mumkin. So’nggi paytlarda
mezoporöz kremniy moddasining morfologik nazorati (O.l-lOjjm) katta e’tiborga
sazovor bo’ldi. Schacht va boshqalar. [31] makromiqyosdagi morfologiyani
boshqarishga emulsiyalangan aralashmalarda moy-suv (masalan, «-geksan-suv
tizimi) interfeysidan foydalanish orqali erishish mumkinligini xabar qildi. Ushbu
usul bilan diametri 1 dan 100|im gacha bo’lgan ichi bo’sh mezog’ovak kremniy
sferalari sintez qilindi. Taklif etilayotgan mexanizm makrostruktura uchun shablon
emulsiyalangan yog ‘tomchisi ekanligini taxmin qildi, nanometr miqyosdagi o’z-
o’zidan tashkil etilgan sirt faol moddalar yig’indisi esa mezostrukturalarni nazorat
qildi. Kislotali muhitda, tetraetoksisilan (TEOS) neft tomchilarida erigan, neft-suv
interfeysida gidrolizlangan va keyin makro tuzilmalarni hosil qilgan, ular kattaroq
uzunlikdagi yog’ tomchilarining o’lchami va shaklini aks ettirgan. Pauly va
boshqalar. [32] birgalikda erituvchilar qo’llaniladigan ierarxik tartiblangan
60](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_59.png)
![materialning mezoporlarini nazorat qilishda sirt faol moddalar emulsiyalarining
ahamiyatini o’rganib chiqdi. Erituvchining qutbliligi suvning organik fazaga
nisbati va emulsiya intensivligi bilan bevosita bog’liq edi. Eritmada emulsiya
bo’lmaganida, sintez qilingan mahsulotlar mikrometr o’lchamdagi monolit zarralar
edi. Biroq, agar sintez sharoitlari sirt faol modda emulsiyasi hosil bo’ladigan tarzda
o’zgartirilsa, hosil bo’lgan mezog’ovak kremniy zarralari taxminan 50 nm
o’lchamdagi teksturali mezog’ovaklikni o’z ichiga oladi. Mualliflarning taxminiga
ko’ra, o’lchami taxminan 200 nm bo’lgan asosiy zarralar sintez jarayonida
to’plangan. Asosiy zarrachalarning oraliqlari tasodifiy taqsimlanganligi sababli,
natijada makroporlar aniq belgilangan tuzilishga ega emas edi, lekin ularni olingan
material uchun adsorbsion/desorbsion izoterma sxemasidan o lchash mumkin edi.ʻ
Lin va boshqalar. [33] mezog`ovakkremniy moddasi uchun ierarxik tartiblangan
tuzilmalarni «naychalardagi naychalarga» erishish usuli haqida xabar berdi.
Yakuniy mahsulotlar kichik ichi bo’sh edi diametri 0,3 dan 3 pm gacha bo’lgan
tubulalar. Ushbu tubulalarning devorlari mezog`ovak edi va MCM-41 materiali
bilan bir xil aniq belgilangan tuzilishga ega edi. Dastlab eritma asosiy edi va
silikat-sirt faol moddasi tizimi lamel-hexagonal faza chegarasiga yaqin edi.
Keyingi kislotalanish bosqichi silikatning kondensatsiyasiga va organik-noorganik
interfeysdagi zaryad muvozanatiga olib keldi, bu transrod yo’nalishi bo’ylab
interfeysning egriligini ta’minladi. Neytrallashning umumiy ta’siri hosil bo’lgan
membranani butunlay bir xil o’lchamdagi tubulalarga egishdan iborat edi.
Mualliflarning ta’kidlashicha, ichi bo’sh mikronaychalarning paydo bo’lishi uchun
ikkita eksperimental omil hal qiluvchi ahamiyatga ega: reaktsiya aralashmasidagi
sirt faol moddasining suvga nisbati va kechiktirilgan sekin neytrallash jarayoni.
Boshqa tadqiqotchilar [34,35,36] kremniy dioksidiga asoslangan mezoporli
materiallarni makromiqyosda morfologik nazorat qilish bo’yicha o’z ishlari haqida
xabar berishdi. Sfera, tola yoki novda shaklidagi zarrachalar morfologiyasi amalga
oshirildi. Mezog`ovakz kremniy moddasining zarracha morfologiyasini nazorat
qilish bilan solishtirganda, alyuminiy oksidi materialining ierarxik tuzilishini
yaratishga kamroq e’tibor qaratildi. Buning bir qismi alyuminiy alkoksidning
61](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_60.png)
![yuqori reaktivligi va qiyin kimyoviy xossalari bilan bog’liq bo’lib, u odatda oxirgi
mezog`ovak aluminiy oksidi materialining kashshofi hisoblanadi. Luo va
boshqalar. [37] nanometr o lchamdagi mezog’ovak aluminiy oksidi sferalariningʻ
sintezi haqida xabar berdi. O’rtacha diametri taxminan 400 nm bo’lgan bu sharlar
gidrolizlash orqali ishlab chiqarilgan suv va asetonitril aralashmasidagi sirt faol
moddasi eritmasi bilan alyuminiy tri-sek-butoksid. Butun jarayon suvli ammiak
yoki gidroxlorid bilan katalizlangan. Past burchakli XRD va BET ma’lumotlari
olingan materialning mezog’ovakligini tasdiqladi. Oqim havoda 550 ° C da
kalsinlangandan so’ng, aluminiy oksidi sharlarining morfologiyasi saqlanib qolishi
mumkin, ammo hajmi biroz qisqaradi. 27Al NMR spektrlari sintezlangan
mezog’ovak aluminiy oksidi sferalari uchun alyuminiy turlarining aksariyati
oktaedral muvofiqlashtirilgan muhitda ekanligini ko’rsatdi.
Malumot
1. Anon., Fed. Reg. 57 (130) 1992.
2. Anon., Catalysis looks to the future, National Academy Press, Washington, DC,
1992.
3. D. E. W. Vaughan, Industrial Uses of Zeolite Catalysts, Properties and
Applications of
Zeolites, The Chemical Society, Burlington House, London, 1980.
4. J. Scherzer and A. Gruia, Hydrocracking Science and Technology, Marcel
Dekker, Inc.
New York, 1996.
5. G. Maczura, K. P. Goodboy, J. T. Koenig, Aluminum oxide, Kirt Othmer
Encyclopedia of
Chemical Technology, Vol.2, pp. 218-224, 3rd edition. Weily, New York, 1978.
6. Karl Wefers, Chanakya Misra, oxide and hydroxide of Aluminum. Alcoa
Technical Paper
No. 19, 1987.
7. R. K. Oberlander, in: B. E. Leach (Ed), Applied Industrial Catalysis Vol. 3,
Academic
Press, London, 1984, p63.
8. C.T. Kresge, M. E. Leonowicz, W. J. Roth, J. C. Vartuli, and J. S. Beck, Nature
359
(1992)710.
9. J. S. Beck, J. C. Vartuli, W. J. Roth, M. E. Leonowicz, C.T. Kresge, K. D.
Schmitt, C. TW.
Chu, D. H. Olson, E. W. Sheppard, S. B. McCullen, J. B. Higgins, and J. L.
Schlenker, /. Am. Chem. Soc. 114 (1992) 10834.
62](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_61.png)











![panjaralari bajaradi. Bunda sochilishning intensiv (ravshan) cho’qqilari Vulf-Bregg
sharti bajarilsakuzatiladi:
2d sin2 =nλ
bunda, d-kristall tekisliklari orasidagi masofa, m;
θ-difraksiya kuzatiladigan burchak, grad;
n-kristallga tushadigan monoxromatik rentgen nurining to’lqin uzunligi;
3.2-rasm.Rentgen nurining tushish va qaytish sxemasi
Difraksion maksimum. Kukun yoki monomonokristall material bilan
monoxromatik rentgen nurining ta’sirlashishidan aniq sondagi har qaysi tekisligida
qaytish holatida tushuvchi kristallar bo’ladi.Bu holatda, θ burchak ostida berilgan
tipdagi tekislik uchun turli ravshanlikdagi difraksion maksimum
kuzatiladi.Maksimumning burchak holati d qiymat bilan aniqlanadi, oxirgisi esa
kristall panjara geometriyasini beradi.
Ravshanlik . Kristall panjara tekisligi H=nh, K=nk, L=nl bilan n-chi tartibli
”qaytish” esa, hkl bilan belgilansa, u holda integral refleks ravshanligi I
HKL
quyidagi ifoda bilan aniqlanadi [ ];
74](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_73.png)
![bunda C-difraktogramma barcha chiziqlari uchun nurlanish to’lqin uzunliga bog’liq
bo’lgan umumiy ko’paytuvchi;
-strukturli faktor
f
j -element tartib raqamiga bog’liq bo’lgan masofaning atom amplitudasi;
X
j , Y
j , Z
j , -bazis atomlarning koordinatalari; P
HKL - bir xil difraksion chiziq beruvchi
va kristall panjara tekisliklar turiga bog’liq ekvivalent tekisliklar sonini hisobga
oluvchi takrorlanish faktori; ℮ -2M
–temperatura omili; A( θ )-tekshirilayotgan modda,
nurlanish to’lqin uzunligi va difraktogrammani tushirish holatiga bog’liq bo’lgan
yutilish omili [ 47].
Refleks ravshanligiga yuqorida qayd etilgan omillardan tashqari rentgen
apparatining ishlash rejimiga: trubka (nay) orqali o’tadigan tok, naydagi
kuchlanish tirqishlar o’lchash, rentgen nurlari kvantlari hisoblagichining ish rejimi,
namuna va hisoblagichning aylanish tezligi, diagramma lentasining tortilish
tezligi.Va nihoyat, refleks ravshanligi berilgan faza miqdori bilan aniqlanadi.
Rentgenogramma . Har qanday faza o’zining kristall panjarasini namoyon
qiladi va aynan unga taalluqli bo’lgan (1) formula bo’yicha aniqlanadigan
tekisliklararo masofalar d
hkl to’plash bilan xarakterlanadi. Bu holatda
rentgenogrammada bir moddaga taalluqli bo’lgan cho’qqilar ishtirok etadi.
3.3-rasm.a) mis, b) fullerin C
60 nanokukunlar rentgenogrammasiga misollar
75](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_74.png)

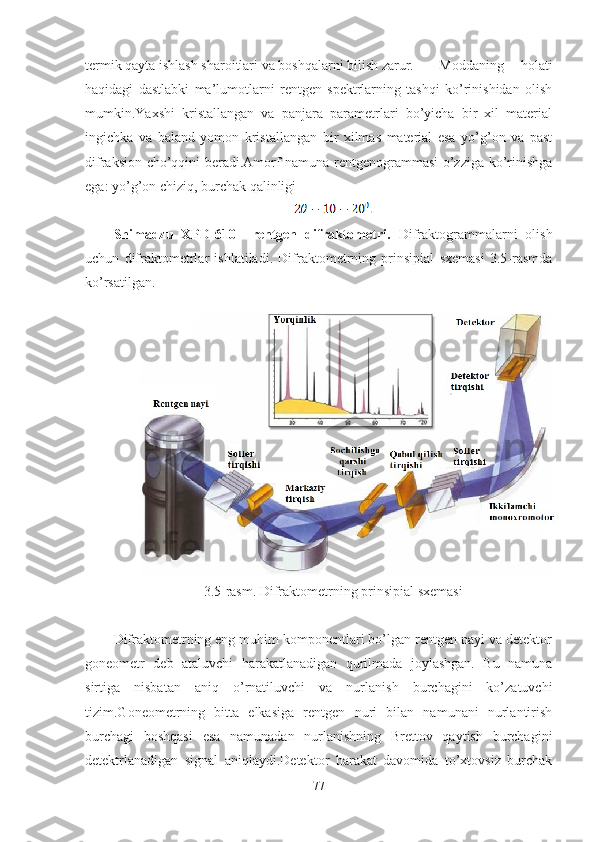

![-Right Gonivo System dasturini ishga tushirish: Analysis Condition Edit
Program.
-Ochiladigan oynaga standart pristavkani tanlab syomkani yangi dasturi
( File→New) yaratiladi.
Rentgenogrammani o’qish (Kukun usuli). Rentgenogrammani o’qish
jarayoni asosan quyidagi bosqich ishlarini boshqarishni talab etadi.
Rentgenogrammani birlamchi qayta ishlash;
Modda identifikatsiyasi;
Kristall singoniyasini aniqlash va rentgenogrammani inditsirlash;
Elementar yacheyka parametrlarini hisoblash va aniqlashtirish;
Hisob natijalarining to’g’riligini tekshirish;
Brave panjarasi tishini aniqlash;
Umuman olganda, usul kristall panjara annotatsiyasi va uning elementar
yacheykasi parametrlarini aniqlash imkonini beradi.Bundan tashqari maxsus
vazifalar:
Brave yacheykasi tipi, elementar yacheykadagi formulaviy birliklar soni,
kristalar o’lchamlari va h.k.ham qo’shilishi mumkin.Lekin, umumiy va maxsus
topshiriqlar bajarilishning muvaffaqiyati kristallning qaysi singoniyaga taalluqligi
va uning tuzilishi haqida qanchalik ma’lumotga egaligimizga juda katta bog’liq.
O’rta va quyi singoniyali kristallar rentgenogrammasini o’qishning o’ziga xos
tomonlari [32] da atroflicha bayon etilgan.
Rentgenogrammaga dastlabki ishlov berish. Rentgenogrammani yozib
olish avtomatik ravishda rentgen difraktometrida amalga oshiriladi.
Difraksiya maksimumning joylashishi ±0,05 º
aniqlikgacha aniqlash uchun
rentgenogrammaga qiymatining metrik o’lchagich (lineyka) qo’yiladi va cho’qqi
balandligidan yaqin o’ng tomonidagi burchaklarning shtrix belgilovchilariga mos
keladigan vertikal chiziqning koordinat to’ri orasidagi masofa o’lchanadi.
Millimetrlarda ifodalangan olingan masofa difraksion burchak qiymatining
o’nlamchi va yuzlamchi ulushlariga mos keladi. Masalan,
2 =16,85º.
79](/data/documents/aef93553-27d6-443a-acb8-15c57e46886e/page_78.png)







Al 2 O 3 ASOSIDA MEZOG‘AVAK SORBENTLAR SINTEZI VA ULARNINIG TEKSTUR XARAKTERISTIKALARI MUNDARIJA KIRISH …………………………………………………………………… 3 I BOB. MEZOG’OVAK MATERIALLAR SINTEZI, ULARNING TEKSTUR VA MORFOLOGIK XARAKTERISTIKALARI . (ADABIYOTLAR SHARHI) ……………………………………………... 5 2.1. Mezog‘ovak nanomateriallar sintezi va ularning fizik-kimyoviy x arakteristikalari …………………… 5 Mezog‘ovak sorbentlarning geom e trik, tekstur x arakteristikalarini o‘rganish ……………………………………………………. 2.2. Alyuminiy oksidi asosida mezog’ovak sorbentlar sintez i ………….. 2.3. Alyuminiy oksidi asosidagi mezog’ovak sorbentlarning termik barqaorligi ………………………………………………………….. 2.4. G’ovak strukturani boshqarish (Mezog’ovak materiallar morfologiyasi nazorati) ……………………. 2.2. Xromatografiya uchun sorbentlarga qo‘yiladigan talablar ………… 16 2.3. Sorbentlarning xromatografik xarakteristikalarini aniqlash usullari ……………………………………………………… 18 II BOB. TADQIQOT MANBAALARI VA USULLARI ( AMALIY QISM ) ………………………………………………… 37 3.1. Tadqiqot ob`ekti, asbob-uskunalar va analiz usullari ………………. 37 Alyuminiy oksidi asosida mezog’ovak sorbentlarning is hqoriy muhitdagi sintezi ………….. 2
Alyuminiy oksidi asosida mezog’ovak sorbentlarning kislotali muhitdagi sintezi ………….. 3.1.1. Sorbsiya hodisasi ……………………………………………………... 38 3.1.2 Adsorbentlarning solishtirma sirt yuzasini aniqlash ………………… 39 3.1.3 Real qattiq jismlar …………………………………………………….. 40 3.2. Adsorbsiya - desorbsiya izotermalari ………………………………… 41 III BOB. ALYUMINIY OKSIDI ASOSIDA MEZOG’OVAK SORBENTLARNING TEKSTUR, FIZIK-KIMYOVIY VA SORBSION XARAKTERISTIKALARINI O‘RGANISH ………………………… 3.2.1. Alyuminiy oksidi asosidagi mezog’ovak sorbentlar ning tekstur xarakteristikalarini o‘rganish …… 44 Alyuminiy oksidi asosidagi mezog’ovak sorbentlarda turli gazlar aralashmalarini ajratish ……………………………………………….. IV. XULOSALAR ……………………………………………………………. 48 V. ADABIYOTLAR RO‘YXATI …………………………………………… 49 I. KIRISH So’ngi yigirma yillikda Al 2 O 3 va asosida olinadigan kompozitsion materiallar sanoat va ishlab chiqarish sohalarida qo’llanilishi bo’yicha yuqori o’sish sur’atlari mavjud. Yuqori texnologiyali sanoat tarmoqlarida Al 2 O 3 nanodispers shaklidagi zollar, gellar va kukun holdagi nanokompozit materiallar issiqlikdan himoyalovchi qoplamalar sifatida, muqobil energiya ishlab chiqarishda, katalizda, kimyoviy sensorlar ishlab chiqarishda, meditsinada turli xil funksional guruhli dori 3
vositalarini tashib o‘tkazishda (nanokontenerlar), fermentlarni immobilizatsiyalashda, ekolologik muammolarni hal etishda g‘ovakli kremniy nanomateriallarining o‘rni beqiyos. Shuningdek bu turdagi birikmalarning gaz va suyuqlik xromatografiyasida ba’zi organik birikmalar aralashmalarini ajratishda qo’llanilishi istiqbollidir. IUPAC tasnifiga ko'ra, mezo g’ovak materiallar 2-50 nm oralig'ida g’ovak diametri bilan tavsiflanadi. Mezog’ovak materiallarning xilma-xilligi, shuningdek, ularning g'ovakligini nazorat qilish va sintez jarayonida amaliy qo'llanilishiga qarab modifikatsiya qilish imkoniyati ushbu materiallar uchun katta qiziqish uyg'otadi. Nisbatan past sirt maydoni va g'ovak hajmiga ega bo'lgan an'anaviy g’ovakli alumina materiallari bilan solishtirganda, buyurtma qilingan mezog’ovak alumina katta sirt maydonlari va g’ovaklik hajmiga, shuningdek, tartiblangan go’ak o'lchamlariga ega va shuning uchun bu turdagi materiallar katalizatorlar va adsorbent olishda katta istiqbolga ega. Hech qaysi analitik usul qo‘llanilishda universalligi va murakkab tarkibli aralashmalarni ajratishdagi samaradorligi bo‘yicha xromatografiya bilan raqobatlasha olmaydi. Kapillyar kolonkali zamonaviy gaz xromatograflarida bir yo‘la, masalan, neftning benzin fraksiyalaridan 1000 dan ziyod komponentlarni ajratish mumkin, ikki o‘lchamli elektroforez biologik namunalar yoki peptidlar gidrolizatlaridan 2000 gacha oqsillarni ko‘rish imkoni beradi. Faqat xromatografiya turli variantlarining elektroforez bilan gibridlanishi DNK da nukleotidlar ketma-ketligini aniqlash va “Inson genomi” dasturi bo‘yicha ishlarni yakunlash imkonini berdi. Xromatografiyani qo‘llab, supertoksikantlar miqdorini, jumladan polixlorlangan dioksanlarning juda kichik konsentratsiyasini (10 -10 %) atrof-muhit ob’ektlaridan aniqlash mumkin. Qayd etilganlarning barchasi xromatografiyada ishlatiladigan sorbentlar va turg‘un fazalarning tabiati va xossalari bilan aniqlanadi. Y a ngi sorbent va turg‘un fazalarning olinishi xromatografiya usullarining qo‘llanilish ko‘lamini yanada kengaytirishga olib keladi. Bu borada gaz, suyuqlik va ion xromatografiyasi uchun mahalliy xom ashyo asosida yangi sorbentlar va turg‘un fazalarni izlash, sintez qilish, 4
modifikatsiyalash va ularning qo‘llanilish imkoniyatlarini tadqiq etish import o‘rnini qoplaydigan sorbentlar bilan ichki bozorni ta’minlash nuqtai nazaridan O‘zbekiston Respublikasi uchun dolzarb muammolardan biridir. Keyingi yillarda “zol-gel” usulida yangi gibrid organoanorganik sorbentlarni sintez qilishga qiziqish kuchaymoqda. Usulning ustunligi shundan iboratki, u yordamida sorbent strukturasi va fizik-kimyoviy xossalarini tekshiriladigan namunadagi aniqlanadigan komponent bilan o‘ziga xos ta’sirini unga turli funksional guruhlarni kiritib o‘zgartirish mumkin. Bu boradagi ishlarni amalga oshirish ham mahalliy xom ashyo asosida yangi sorbentlar va turg‘un fazalarni izlash, sintez qilish, modifikatsiyalashda samarali usul hisoblanadi. Ma’lumki, zol-gel texnologiya aniq kimyoviy va fizik-mexanik xossalarga ega bo‘lgan anorganik sorbentlar, katalizatorlar, sintetik seolitlar, anorganik qovushqoq moddalar, maxsus teplofizik, optik, magnitli va elektrik xossalarga ega bo‘lgan keramika, shisha, shishakeramika, tolalar va boshqalarni olishda almashinmaydigan va kelajagi porloq usuldir [1-4]. Ba’zi metallar va metallmaslarning oksidlari xromatografiyada sorbent sifatida keng qo‘llaniladi [2-7]. Keyingi paytlarda bu boradagi ishlar oksidlarning monolitlari va ularning qoplamalaridan foydalanish tomonga siljigan [2]. Bu boradagi ishlarning jadal rivojlanishiga zol-gel usulida monolitlar va ularning turli tutuvchilar sirtida qoplamalar olish sabab bo‘lmoqda. Shuning uchun ham O‘zbekistondagi tabiiy xom-ashyolardan foydalanib sorbentlar, jumladan, xromatografiya uchun “zol-gel” texnologiyani qo‘llab, sorbentlar olishning yo‘llarini ishlab chiqish, nazariy va amaliy ahamiyatga ega bo‘lishi bilan bir vaqtda dolzarb muammolardan biridir. Dissertatsiyaning maqsadidan kelib chiqqan holda quyidagi vazifalar belgilandi: Zol-gel texnologiyasi orqali turli temperaturda sirt faol moddalarni qo’llab mezog’ovak Al 2 O 3 olish; 5
Olingan mezog’ovak sorbentlarning tekstur xarakteristikalari va sorbsion xossalarini skanerlochi electron mikroskopiya hamda simobli porometriya usullarida o’rganish; Mezog’ovak sorbentlar olishning maqbul sharoitlarini tanlash; Mezog’ovak Al2O3 sorbentlari asosida chiqindi suvi tarkibidan bo’yoqlarni ajratishda qo’llash. Tadqiqotning ilmiy yangiliklari: Turli temperatura zol-gel texnologiyasi yordamida sirt faol moddalar qo llab AlClʼ 3 va mochivina asosida g ovaklarining o rtacha diametri ʼ ʼ 2,2÷32,0 nm bo lgan mezog ovak Al ʼ ʼ 2 O 3 sorbentlar olindi hamda ularning tekstur, geometrik va sorbtsion xarakteristikalari aniqlangan Mezog ovak sorbentlarda yupqa qavat xromatografiyasi usulida ʼ tetragidroizoxinolin hosilalari aralashmalarini aniqlash, chiqindi suv tarkibidan organik bo yoqlarni ajratish va neft mahsulotlarining guruh ʼ tarkibini YuSSX usulida o rganish metodikasi ishlab chiqilgan. ʼ Tadqiqotning amaliy ahamiyati: Tadqiqot natijalarining ilmiy ahamiyati zolь-gelь texnologiyasi va teskari mikroemulьsiya usuli yordamida sorbtsion xossalari yaxshilangan selektiv tabiatli, termik barqaror mezog ovak kremnezem sorbentlar hamda ʼ ularning kompozitlarini olish, ularning tekstur, sorbtsion xarakteristikalari sirt hodisalari fizik kimyosiga qo shgan hissasi bilan izohlanadi. ʼ Tadqiqot natijalarining amaliy ahamiyati mezog ovak sorbentlarda ʼ yupqa qavat xromatografiyasi usulida tetragidroizoxinolin hosilalari aralashmalari aniqlash, chiqindi suv tarkibidan organik bo yoqlarni ajratish ʼ va neft mahsulotlarining guruh tarkibi o rganish metodikasi ishlab ʼ chiqilganligi hamda amaliyotga joriy etilganligidan iborat. Tadqiqot natijalarining ilmiy ahamiyati zol-gel texnologiyasi va teskari mikroemulьsiya usuli yordamida sorbtsion xossalari yaxshilangan selektiv tabiatli, termik barqaror mezog ovak kremnezem sorbentlar hamda ʼ 6
