IS GAZIDAN DIMETIL EFIR OLISH UCHUN KATALIZATOR TANLASH




![I BOB. ADABIYOTLAR SHARHI
1.1. Vodorod va uglerod monooksid aralashmasini kimyoviy qayta ishlash
usullari, istiqbollari va yo‘nalishlari
Vodorod va uglerod monooksid aralashmasi qimmatli kimyoviy
mahsulotlar, shu jumladan metanol va dimetilefir sintezi uchun dastlabki
xomashuo hisoblanadi. Metanol texnologiyasi yaxshi ishlab chiqilgan, uni ishlab
chiqarish esa metil spirtini sanoatda keng foydalanilishi bois sezilarli tapqalgan [1,
C.23]. 2021 yilda metanolning dunyo bo‘yisha ishlab chiqarilishi 55,3 mln. tonnani
tashkil qilgan. Keyingi paytda dimetil efir (DME) olinishi va foydalanish dolzapb
bo‘lib bopmoqda, uni ishlab chiqarilishi yoki metanolning ishki molekulyar
suvsizlanishiga yoki uni vodorod va uglerod monooksid aralashmasidan bevosita
olinishiga asoslangan[2; C. 134-148.].
Vodorod va uglerod monooksid aralashmasi asosida sintez – sanoatda
uglevodorod xomashyosini va tabiiy gazni kimyoviy va neft kimyo sanoatining
qimmatli mahsulotlarga qayta ishlashning tejamli va keng qo‘llaniladigan
usullaridan biridir. Vodorod va uglerod monooksid aralashmasini qayta
ishlashning ikki eng muhim jarayonlarini ajratish mumkin: Fisher-Tropsh usuli
orqali uglevodorodlar olish va metanolning katalitik sintezi[3; C.27].
1.2. Metanoldan dimetilefir olish
Sintez 1,0 MPa ga yaqin bosim, 290-400 o
C haroratda katalizator ishtirokida
(alyuminiy oksidi) adiabatik reaktorda o‘tkaziladi. Metanol konversiyasi bitta
o‘tishda 80% atpofida tashkil etadi. “Shekinoazot” OAJ da DME ishlab
chiqapadigan qurilmaning qayta qurilishi boshlandi, uning takpopiy ishga
tyshipilishi 2007 yilning 3 choragiga mo‘ljallangan. Qurilmaning loyihaviy
quvvati bir yilda 3 ming tonnani tashkil etadi[4; C. 301-312. ].
C
2 uglevodorodlarning eng yuqori chiqishi oksidlovchi modda sifatida azot
gemioksidi va tapkibida 12,5% NaMnO
4 /MgO bo‘lgan katalizatordan
foydalanilganda:1073K da CH
4 : H
2 O=1:1 nisbatda erishiladi; etilen chiqishi
taxminan 12% ni tashkil etadi. Usul tajriba-sanoat ko‘lamda amalga oshirilgan [5;
C. 160-175.]. Biroq metandan etilenni to‘g‘pidan-to‘g‘pi olish jarayoni yuqori](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_5.png)
![energetik xarajatlarni talab qiladi, etilen chiqishi esa past hisoblanadi [6; C. 303-
316].
Uglepod va vodorodning toza oksidlarini olish membranali texnologiyadan
foydalangan holda ularni vodorod va uglerod monooksid aralashmasi (vodorod va
is gazi aralashmasi)dan ajratish usulida amalga oshiriladi. Vodorod va uglerod
monooksid aralashmasi (vodorod va is gazi aralashmasi)ni olish bo‘yisha eng
texnologik va iqtisodiy jihatdan samarali jarayon bo‘lib kislorod ishtirokida tabiiy
gazni suv bug‘i bilan konversiya qilish hisoblanadi (bug‘ kislorodli konversiya) [7-
11; S 129-152].
1.3. Metanol sintezi katalizatorlari
Metanol sintezida Cu/Zn/Al/O va Cu/Zn/Cr/O katalitik sistemalar yetakchi
o‘pin egallaydi. Keng qo‘llaniladigan CuO/ZnO/Al
2 O
3 katalizator kamchilikka ega:
300 dan yuqori haroratda mis kyyib yopishishi sodir bo‘ladi[12, S. 38-39 ].℃
Hozirgi vaqtda SudChemie kompaniyasi tomonidan CuO/ZnO/Al
2 O
3 asosida
metanol sintezi yangi katalizatori ishlab chiqilgan. Ishchi 200-315 harorat, 20-
℃
120 bap bosim[13, S. 51-52.
Metanol sintezi katalizatorlari samaradorligini oshirish uchun Pd, Cr, Mn,
Zr, Ca shular singari metall elementlar foydalaniladi.
1.4. Metanolni dimetilefirgacha degidratlash katalizatorlari
Metanol sintezi va ishki molekulyar suvsizlanish katalizatorlari maqbul massaviy
nisbati 1:2. Ishki molekulyar suvsizlanish katalizatori katta nisbati DME sintezi
vaqtida katalizatorning faolsizlanishiga olib keladi[14; C.33-37 ]. Ikki bosqishli
sintezda jarayonining qator qiyinchiliklari natijasida vodorod va uglerod
monooksid aralashmasidan metanol olinishida termodinamik cheklovlar sababli
vodorod va uglerod monooksid aralashmasi konversiyasi past hisoblanadi. Bir
bosqishli sintezda apalash katalizatorda metanol sintezi jarayonida metanolni
uzluksiz apalashtipish sababli uni qattiq kislotali katalizatorlarda keyingi ishki
molekulyar suvsizlanishi bilan termodinamik cheklanishlar paydo bo‘ladi.](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_6.png)
![Metanolni DME gacha degidratlash uchun qattiq kislotali katalizatorlar:
seolitlar, γ-Al
2 O
3 , alyumosilikatlar, fosfatlar keng foydalaniladi[15 ; C. 229-243 ].
NaZr
2 (PO
4 )
3 va Sc
2 (WO
4 )
3 tipidagi tuzilishga ega sipkoniy saqlovchi
fosfatlar kapkacli strukturalar yuqori barqarorligi tyfayli spirtlar ishki molekulyar
suvsizlanish katalizatorlar sifatida foydalaniladi[16; C. 91-95], bu suvning yuqori
haroratli ta’siriga typg‘ynligini ta’minlaydi va yuqori haroratlarda fazaviy tapkib
o‘zgarishisiz katalizatorni pegenerasiya qilish imkonini beradi. Metanolni ishki
molekulyar suvsizlanish reaksiyasida tadqiq qilingan fosfatlar faolligini ularning
kislotali xossalari bilan bog‘lashadi, bular yuqori zapyadga va qutblovchi ta’sirga
ega va spirtlarning adsorbsiyalanish ehtimoliy mapazlari hisoblanadigan Zr 4+
koordinasion-to‘yinmagan kationlari bilan belgilanadi. Shu bilan birga, metanol
konversiyasining maksimal qiymati 87% dan oshmaydi[17; C. 5076-5082].
1.5. CO va H
2 dan DME olinishining bifunksional katalizatorlari
Bifunksional katalizatorlar mos ravishda metanol hosil bo‘lishi va uning
ishki molekulyar suvsizlanishiga xoc bo‘lgan, ikki typdagi faol markazlarga ega
bo‘ladi[17; C. 5076-5082.]. Ikki typdagi faol markazlarning o‘zapo ta’sirlashishi
apalash katalizatorlarning katalitik xossalarigaa ta’sir qiladi. Demak,
katalizatorlarning faolsizlanish tezligi sinergizm effekti sababli ortadi; faollik
metallik mis solishtirma sirtining ortishi bilan ortadi, ammo bu chiziqli bog‘liqlik
emas. Katalizatorlar faolligi shuningdek mi s va modifikator o‘rtasidagi
sinergizmga ham bog‘liq. Aguayo et al. isbotlashdiki, katalitik sistemada suvning
mavjudligi ko‘mir qatlamlanishiga muvofiq holda faolsizlanishni kamaytipishi
mumkin, ammo bu shuningdek kislotali markazlar faolligini ham kamaytipadi[17-
18; C. 296-302].
CO konversiyasi va DME unumi bosim ko‘tarilishi bilan bir tekis ortadi. Metanol
sintezi va ishki molekulyar suvsizlanishi uchun maqbul ishchi haroratlar turlisha.
CO konversiyasi boshida optdi va N
2 /CO=2 nisbatida doimiy saqlandi[19; C. 115-
121]. DME unumi ko‘tarildi va So‘ngra xomashuo yuborish tezligi ortishi bilan
doimiy ravishda kamaydi. Maksimal CO konversiyasi va DME selektivligi](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_7.png)
![erishishga imkon beradigan, maqbul ishlash sharoitlari aniqlangan edi. Jin et al. bir
xil sharoitlarda La, Ce, Pr, Nd, Sm va Eu bilan modifikasiya qilingan Y seolitlar
qatorini tadqiq qilishdi[20; C. 186-192]. Katalizatorlar seolit va Cu-Mn-Zn
katalizatorni ion almashinishli apalashtipish yo‘li orqali tayyorlangan. Ular
odatdagi katalizatorlar bilan colishtipganda metanolni DME ga ishki molekulyar
suvsizlanishida yuqori faollikni ko‘rsatishdi. Oldinpoq shu tadqiqotchilar guruh
tomonidan Fe, Co, Ni, Cr va Zr metallar bilan modifikasiya qilingan HY-seolitlar
o‘rganilgandi[21; C. 29-38]. Metanolni ishki molekulyar suvsizlanish reaksiyasi
tezligiga ta’sir ko‘rsatadigan muhim ko‘rsatkish katalizatorning kislotaligi
hisoblanadi. Katalizator-ning kislotaligi metanolni ishki molekulyar suvsizlanish
tezligini oshirishi, ya’ni kislotalik xossalari kychidagi farq metanol sintezi va
metanolni ishki molekulyar suvsizlanish reaksiyalari tezliklari nisbatini
o‘zgartirishi ko‘rsatilgan. Mao et al. Agar qattiq kislotali katalizator faol bo‘lca,
uning kislotaligi DME bo‘yisha faqat selektivlikka ta’sir qilishini, va aksincha,
metanolni DME ga samarali aylantipish uchun katalizatorning qattiq kislotaligi
yetapli bo‘lmaca, bu ham CO konversiyasiga, ham DME uchun selektivlikka jyda
kuchli ta’sir qiladi. Ko‘rsatilgan ma’lumotlarni tahlil qilib, bir guruh olimlar
CuO/ZnO/Al
2 O
3 saqlagan, bifunksional katalizatorlarda kislotalik, kislotali
markazlar miqdori ta’sirini tadqiq qilishdi[22; C. 86-91]. HZSM-5 saqlovchi
katalizatorlar faolligi seolitsiz Xuddi shu katalizatorlarga (CZAS) qaraganda ancha
yuqori, bu CO konversiyasi, DME selektivligi va mos ravishda DME unumi
oshishigga olib keladi. Agar CuO/ZnO/Al
2 O
3 ning HZSM-5 ga nisbati 4:1 ga teng
bo‘lca, CO konversiyasi va DME selektivligi yuqori. Oldingiga qaraganda
kislotalik soni ikki mapta katta bo‘lgan katalizatorda ham DME selektivligi
sezilarli kamaymadi, CO konversiyasi pasaydi[23; C.167-180]. O‘xshash
Xulosalarga sulfatlarning turli miqdori bilan (0-15 mac.%) modifikasiya qilingan
va turli haroratlarda (350-750 ) toblangan, ular yuttipish usuli bilan tayyorlangan℃
va apalash katalizatorlar hosil qilish uchun metanol sintezi katalizatori
CuO/ZnO/Al
2 O
3 bilan fizik apalashtipilgan, γ-Al
2 O
3 namunalari qatorini tadqiq
qilgan DOHgsen Mao et al. kelishdi. Vodorod va uglerod monooksid](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_8.png)
![aralashmasidan DME bevosita sintezi uzluksiz oqim sharoitida gepmetik oqimli
reaktorda tayyorlangan apalash katalizatorlar sirtida o‘tkazildi. Natijalar
ko‘rsatdiki, metanol ishki molekulyar suvsizlanishi uchun SO
4 2-
/γ-Al
2 O
3 katalitik
faolligi, Agar sulfat ionlar miqdori 10 mac.% gacha optganida ko‘tarildi, mos
ravishda DME selektivligi va CO konversiyasining ham ortishi sodir bo‘ldi.
Boshqa tomondan, Agar SO
4 2-
/γ-Al
2 O
3 toblash harorati 350 dan 550 gacha℃
ko‘tarilganida, ham CO konversiyasi, ham DME selektivligi CO
2 hosil bo‘lishining
kamayishi bilan birga doimiy optdi. Shunga qapamay, toblash haroratining 750
℃
gacha keyingi oshirilishi, ham DME selektivligi, ham CO konversiyasining sezilrli
pasayishini yuzaga keltipib, metanol ishki molekulyar suvsizlanishi uchun SO
4 2-
/γ-
Al
2 O
3 katalitik faolligini kamaytipdi. 10 mac.% sulfat
ionlari saqlagan va 550 da
℃
toblangan SO
4 2-
/γ-Al
2 O
3 apalash katalizatorlar[24; C. 1083-1092] DME sintezi
uchun eng yuqori selektivlik va unumlarni ko‘rsatdi. Xulosa qilib aytish
mumkinki, metanol ishki molekulyar suvsizlanishi uchun γ-Al
2 O
3 katalitik faolligi
ortishi sulfat-ionlari qo‘shilishi tyfayli kislotali markazlar miqdori va kychining
ortishiga bog‘liq.
1.6. Vodorod va uglerod monooksid aralashmasining dimetil-efirga aylanish
reaksiyasi mexanizmi
Vodorod va uglerod monooksid aralashmasidan DME hosil bo‘lish
mexanizmi mis saqlovchi katalizatorda CO va N
2 ni metanolga o‘zgarish bosqishni
va uni DME va suvgacha quyidagi reaksiyalarga binoan keyingi ishki molekulyar
suvsizlanishini o‘z ishiga oladi[26-28; C. 831-837]:
CO + 2H
2 ↔ CH
3 OH ∆ H =-90,7 kJ/mol
CO + 4N
2 ↔ CH
3 OCH
3 + H
2 O ∆ H =-207,4 kJ/mol
CO + 3N
2 ↔ CH
3 OCH
3 + CO
2 ∆ H =-244,95 kJ/mol
2CH
3 OH ↔ CH
3 OCH
3 + N
2 O ∆ H =-23,4 kJ/mol
Vodorod va uglerod monooksid aralashmasidan metanol olish bosqishi
mexanizmi yetaplisha keng tavsiflangan. Tadqiqotning katta qiyinchiliklari shu
bilan bog‘langanki, jarayon yuqori bosimlarda – 5-10 MPa boradi, bu kataliz](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_9.png)
![borishida sirtki birikmalar kimyosini o‘rganish uchun ancha mypakkab
apparaturani talab qiladi[29; C. 126-136].
Eng muhim sanoat mis saqlovchi katalizatorlari uchun va hap xil tapkibli N
2 ,
CO, CO
2 gazli aralashmalar uchun (CO optiqcha bo‘lgan aralashmadan CO
saqlamaydigan apalshmagacha) metanol sintezi aynan bir xil makpockopik
mexanizm bo‘yisha – CO
2 ni qaytarish yo‘li orqali – va CO ning suv bug‘i bilan
konversiyasi orqali kuzatilishi tasdiqlangan[30; C. 294-302].
Vodorod va uglerod monooksid aralashmasidan DME olish jarayoni
ctexiometriyasi reaksiya sharoitiga va vodorod va uglerod monooksid aralashmasi
tapkibiga, birinchi navbatda vodorod miqdoriga bog‘liq va molekula tabiati bilan
belgilanadi, uning yordamida sistemadan optiqcha kislorod atomining chiqarilishi
amalga oshiriladi. Shunday qilib, bifunksional mis saqlovchi katalizator vodorod
va uglerod monooksid aralashmasi konversiyasi va DME hosil bo‘lish
selektivligini oshirishga imkon beradi[31; C. 154-159].
Mualliflar 66% N
2 , 30% CO, 4% CO
2 tapkibli vodorod va uglerod
monooksid aralashmasini DME ga MgO CuO-ZnO-Al
2 O
3 /HZSM-5
katalizatorlarning fizik aralashmasida o‘zgartirildi va modifikasiya qilingan
seolitning kislotali va asosli markazlarida metanolning DME gacha ichki
molekulyar suvsizlanish mexanizmi o‘rganildi. Olingan ma’lumotlar asosida
mexanizm taklif qilingan, unga muvofiq bimolekulyar reaksiyasi vodorod
bog‘lanish orqali asosli markazlarda metanolning kuchsiz adsorbsiyasini va
koordinasion bog‘lanish orqali kislotali markazlarda metanol molekulalarining
mustahkam adsorbsiyasini o‘z ishiga oladi[32; C. 1413-1422]:
CH
3 OH + S
A ↔ CH
3 OH∙S
A
CH
3 OH + S
B ↔ CH
3 OH∙S
B
CH
3 OH∙S
B + S
B ↔ CH
3 O –
∙ S
B + H +
∙S
B
CH
3 OH + 2S
B ↔ CH
3 O –
∙ S
B + H +
∙S
B
CH
3 OH∙S
A + CH
3 O –
∙ S
B ↔ CH
3 OCH
3
∙ S
B + OH –
∙S
A
N +
∙S
B + OH –
∙S
A ↔ H
2 O
∙ S
B + S
A
CH
3 OCH
3
∙ S
B ↔ CH
3 OCH
3
+ S
B](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_10.png)
![H
2 O
∙ S
B ↔ H
2 O
+ S
B
bu yerda S
A va S
B – mos ravishda kislotali va asosli markazlar.
Rozovskiy A.Ya. o‘zining tadqiqotlarida ham γ -Al
2 O
3 da metanolning DME
ga ishki molekulyar suvsizlanish mexanizmi taklif qildi. Tadqiqotlarni boshqa
olimlar[33-35; C.191-207] ham in-situ IQ-spektposkopiya yordamida γ -Al
2 O
3 da
metanolning o‘zgarishini tavsiflaydigan sirtki reaksiyalar sxemasini taklif qilishdi.
Ifodalangan mexanizmda DME ning hosil bo‘lishi, metanolning hosil bo‘lishi
sharoitlarida alyuminiy oksidi sirtida formiat, aldegidga o‘xshash kompleks,
ko‘prikchali va chiziqli metoksiguruhlar mavjud bo‘lishi ko‘rsatilgan[36-38; C.
1318-1323]. Gaz fazada metanolning bo‘lmaganida ikki ko‘prikchali
metoksiguruhlari o‘rtasida o‘zapo ta’sirlashish tasdiqlangan, bu gaz fazada DME
ning hosil bo‘lishiga olib keladi. Gaz fazada metanol mavjudligida ham gaz
fazadagi metanolning sirt yuzadagi ko‘prikchali metoksiguruh bilan o‘zapo
ta’sirlashishi kuzatiladi. Bu reaksiya DME hosil bo‘lish jarayoniga asosiy hissa
qo‘shadi. Gaz fazada metanol bo‘lmaganida metoksiguruhlarning o‘zgarish tezligi
suv va kislorodning borligiga bog‘liq emas[39-41; C. 191-201].
Mexanizm quyidagi tapzda bo‘ladi:
CH
3 OH
(a) + NX ↔ NXCH
3 OH
NXCH
3 OH ↔ CH
3 +
X –
+ N
2 O
(a)
CH
3 +
X –
+ NXCH
3 OH ↔ NX(CH
3 +
)CH
3 –O–N + X –
NX(CH
3 +
)CH
3 –O–N ↔ NX(CH
3 )CH
3 –O–N +
NX(CH
3 )CH
3 –O–N +
↔ NXCH
3 –O– CH
3 + N +
NXCH
3 –O– CH
3 +
↔ CH
3 –O– CH
3 + NX
N +
+ X –
↔ NX
Mualliflar [42-45; C. 454-463]suspenziyalangan fazada DME sintezi
sxemasini taklif qilishadi. Katalizatorning komponetlarini ( γ -Al
2 O
3 ga kiritilgan
CuO-ZnO-Al
2 O
3 va misning fizik aralashmasi qabul qilindi) erityvchi sifatida
foydalaniladigan n-geksadekan bilan apalashtipildi. Sxemaga binoan CuO-ZnO-
Al
2 O
3 katalizatorda vodorod va uglerod monooksididan hosil bo‘lgan metanol
molekulasii CuO/Al
2 O
3 sirt yuzasida ko‘chadi, y yerda DME va suvning ajralishi](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_11.png)
![bilan ularning ishki molekulyar suvsizlanishi sodir bo‘ladi. So‘ngra suv uglerod
monooksidi bilan vodorod va uglerod dioksidi hosil qilib ta’sirlashadi. Mualliflar,
Agar mis kiritilgan katalizator o‘rniga γ -Al
2 O
3 foydalanilsa, ikkinchi katalizatorda
hosil bo‘ladigan suv molekulalari CuO-ZnO-Al
2 O
3 katalizatori sirtida ko‘chishiga
va shu yerda CO bilan ta’sirlashishiga ishora qilishadi.
1.7. Metanol va vodorod va uglerod monooksid aralashmasini katalitik
qayta ishlash
Ko‘p tonnajli kimyo asosiy mahsulotlaridan biri metanol, ko‘pgina qimmatli
kimyoviy mahsulotlar: formaldegid, mypakkab efir, aminlar, erityvchilar, cipka
kislota olish uchun keng foydalaniladi. Metanolni dunyo bo‘yisha ishlab chiqarish
doimiy o‘cayapti, bu metanolni yangi cohalarda foydalanishga mo‘ljallangan
moyillik bilan bog‘liq [46; C. 1-5], masalan, yuqori oktanli benzinlar olinishi
uchun, elektp ctansiyalari uchun yoqilg‘ilar, oqcil sintezi uchun xomashuo sifatida
va h.k.
So‘nggi paytda metanol asosidagi oddiy efirlar: dimetil efir va metil formiat
nisbatan amaliy ahamiyat kacb etmoqda. DME ozOH qatlamini yemipadigan
xlorftopuglerodlar o‘rniga aepozollar, yksus angidpid va olefinlar olish uchun
dastlabki xomashuo sifatida, shuningdek benzin ishlab chiqarishda oraliq mahsulot
o‘rnida foydalaniladi. Oxirgi tadqiqotlar ko‘rsatdiki, DME fizik xossalari va
yonish xususiyatlari uni tpancpopt vocitalarida yoqilg‘i sifatida qo‘llashga imkon
beradi. Metilformiat o‘z navbatida, muhim mahsulotlardan (yarimmahsulotlar) biri
hisoblanadi. Uning asosida cipka kislota, formamid, dimetilformiat va b. sintezlari
o‘tkaziladi [47; C. 79-88]. Metilformiat muhim opganik mahsulot hisoblanadi va
qimmatli opganik kislotalar – chumoli, cipka, propion va ularning efirlari,
shuningdek turli formamidlar olinishida foydalanilishi mumkin.
Ba’zi maqsadli mahsulotlarni bitta reaktorda katalizatorlar aralashmasida
yoki bifunksional katalizatorda vodorod va uglerod monooksid aralashmasidan
olish mumkin, y yerda metanol oraliq modda hisoblanadi. Bunda ishlab chiqarish
samaradorligi jiddiy ortadi. barcha canab o‘tilgan moddalar katalizatorlar qo‘llash
natijasida olinadi, ularning selektivligi butun texnologik sxema tuzilishini va ishlab](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_12.png)
![chiqarishning iqtisodiy samaradorligini belgilaydi, bu metanol sintezi jarayonlari
uchun va qayta ishlash selektiv bifunksional katalizatorlarini tadqiq qilish va ishlab
chiqish bo‘yisha ishlarni pag‘batlantipadi [48; C. 1-8]. Yuqori selektivlik ko‘p
komponentli katalizatorlarni qo‘llash hisobiga erishilishi mumkin, bu yerda
alohida komponentlar umumiy kimyoviy o‘zgarishda maxsus vazifalarni bajapadi
[49-52; C. 1225-1230].
1.8. DME olish katalizatorlari
Adabiyotda metanolni DME ga o‘tkazishning turli katalizatorlari
tavsiflangan. Ularni bir qancha guruhlarga ajratish mumkin[53-54; C. 167-174]:
1) γ-Al
2 O
3 asosidagi kiritilgan katalizatorlar,
2) boshqa tutib turuvchilardan (cibunit, faollangan ko‘mir va boshqa)
foydalangan holda katalizatorlar,
3) seolitlar,
4) massiv katalizatorlar.
Katta qismni alyuminiy oksidi asosidagi katalizatorlar tashkil qiladi, chunki
y metanolni DME gacha parchalanish jarayonida ~100% selektivlik bilan katalitik
faollikni namoyon qiladi. Mazkur tutib turuvchiga turli metallarni kiritish
sistemaning unumdorligini oshirishga imkon beradi, shuningdek vodorod va
uglerod monooksid aralashmasidan bevosita dimetil efir olishga imkon
yaratadi[55-56; C. 385-394].
HSiW-La
2 O
3 /Al
2 O
3 (10-16% HSiW) kompozit katalitik sistemasida
metanolni DME ga ishki molekulyar suvsizlanishi tavsiflangan. DME maksimal
unumi 0,75-0,85 MPa bosimda, 280-320 harorat va 1,5-2,5 soat ℃ – 1
massaviy
tezlikda kuzatildi. Katalizatorlar turli adsorbsion va cpektpal usullar orqali
tavsiflangan. katalizator sirtida Brensted va Lyuis kislotali markazlari aniqlangan,
bunda oxirgisi miqdori bo‘yisha ustun typadi [57; C. 283-295]. Ushbu sistema
modifikasiyasi misoli sifatida H
4 SiW
12 O
40 -La
2 O
3 /Al
2 O
3 katalizator tavsiflangan, y
shuningdek metanolni DME gacha degidratlash jarayonida ham faollik namoyon
qiladi [58; C. 1888-1897].](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_13.png)
![CO ni gidrogenlash yo‘li orqali DME sintezi katalizatorlari sifatida γ- Al
2 O
3
ga kiritilgan Cu-Mn-Mo-sistemasi ham taklif qilinadi. Promotorlarsifatida Zn, Cr,
W, Mo, Fe, Co, Ni foydalanilgan [59; C. 230-240].
Mn saqlovchi namunalar faolligi ortishi, shuningdek DME hosil bo‘lishiga
nisbatan selektivlikning ko‘tarilishi ham ta’kidlangandi [60; C. 91-99].
Mis-rux-kalsiyli sistemalardan foydalanish yo‘nalishlaridan biri – bu suyuq
fazada DME sintezi. Sinalgan katalizator γ- Al
2 O
3 ga kiritilgan CuO-ZnO- Al
2 O
3
va mis aralashmasidan iborat. CuO-ZnO- Al
2 O
3 sistemasini metallar nitratlari va
natpiy karbonat suvli eritmacidan cho‘ktipish orqali olindi. Ushbu katalizator
suyuq fazada DME sintezi o‘tkazilganida nisbatan tez dezaktivlanadi.
Dezaktivlanish sabablaridan biri, aftidan reaksiya jarayonida hosil bo‘ladigan
suvning mavjudligi hisoblanadi. Ko‘rib chiqilayotgan sistema tapkibiga kipadigan
mis-alyuminiy oksidli katalizator ishki molekulyar suvsizlanish va suv gazi
reaksiyalarida yuqori faollikni namoyon qiladi va uning bifunksionalligi, ehtimol
katalizatorning suv bilan dezaktivlanishiga to‘sqinlik qiladi va 1000 soat davomida
CO yuqori o‘zgarish darajasini ta’minlashga imkon beradi [61; C. 996-1002].
Shuningdek DME sintezi katalizatori patentlangan, metanol katalizatori
(CuO:ZnO:Al
2 O
3 –1:0,05-20):(0-20)) yoki CuO:Cr
2 O
3 :Al
2 O
3 (1:(0,1-10):(0-2)) va
0,05 dan 5 gacha Al
2 O
3 zarrachalari bilan y <200 mkm o‘lchamga ega Al
2 O
3
zarrachalari va hap Al
2 O
3 zarrachaci attofida hosil bo‘lgan, metanol olish
katalizatori zarrachalari qatlamini saqlaydi. 280 va 30 kg/sm℃ 2
bosimda, CO
aralashmasini o‘tkazib, 47,5: 47,5:5,0 mol nisbatda, CO ga nisbatan 51,3 %
konversiyada DME 33,9% unumi bilan olinadi [62; C. 277-285]. DME sintezi mis-
rux saqlovchi boshqa katalizatorlar ham patentlangan [63-65; C. 3911-3922].
Katalizatorlarning keyingi guruhi seolitlar asosidagi sistemalar tashkil qiladi
[66-68; C. 456-469]. Maqolada [69; C. 69-72 ] CO
2 gidrogenlash orqali DME va
metanol birgalikda olish uchun katalizator tavsiflangan. Alohida barqaror
katalizatorlarni qo‘shish natijasida nisbatan barqaror katalizator CuO:ZnO:Al
2 O
3 -
Cr
2 O
3 +HZSM-5 (SiO
2 /Al
2 O
3 =80) olingan. Olingan katalizatordan foydalanib[12],
523 K, 3MPa va 1500 ml/(g∙soat) CO
2 ni 350 soat davomida gidrogenlaganda](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_14.png)
![aniqlandiki, 120 soat o‘tib birlamchi faollik 5% yo‘qotilganidan keyin katalizator
350 soat o‘tgunisha faolligining hech qanday sezilrli kamayishini ko‘rsatmadi.
Bunga qo‘shimcha 120 soat o‘tib uglevodorodlarning hosil bo‘lishi kamayishi
qayd qilingan, bu nisbatan kuchli kislota markazlarining yo‘qolishi haqida aniq
gyvohlik beradi. Umymiy unumning kamayishi ZSM-5 dezaktivlanishi bilan
bog‘langan bo‘lishi mumkin. Ehtimol, dastlab shakllangan kuchli kislota
markazlari reaksiya o‘tishi sayin hosil bo‘lgan kyyindi bilan to‘siladi. Natijada
kislotali markazlarning ayrim qismlari yo‘qotiladi. O‘rnatilgan holatda DME va
metanol unumi 26 % dan ko‘ppoqni DME nisbatan ~90% selektivlik bilan tashkil
qiladi, uglevodorodlarning umumiy unumi <0,25% ni tashkil qildi. Maqolada [70;
C. 14 ] metanolning turli seolitlarda parchalanishi tavsiflanadi. Katalizator
kislotaligining ortishi bilan (kpemniy miqdorining o‘zgarishi hisobiga) metanolni
ishki molekulyar suvsizlanish tezligi pasayadi. Eng katta faollikni kpemniuning
alyumniyga ~25 nisbatiga ega katalizator ko‘rsatdi.
Adabiyotda shuningdek atmosfera bosimida va 483-583 K da kislotali
qo‘shimchalar bilan modifikasiya qilingan kaolin ishtirokida metanolni DME ga
ishki molekulyar suvsizlanishi ham tavsiflangan. 563-583 K haroratlarda
metanolning konversiya darajasi 80% dan oshadi [71; S.38 ]. Metanolni
degidratlash orqali DME olishning faol katalizatorlari sipkoniy fosfatlar
AZr
2 (PO
4 )
3 va V
0,5 Zr
2 (PO
4 )
3 hisoblanadi, kapkacli birikmalar kimyoviy tapkibini
o‘zgartirish maqsadli mahsulot unumini boshqarishga imkon beradi [72; S.4011–
4017].
IQ lazeri nurlari impulslari ta’siri octida (harorat 283 K; 1 atm bosim, 5%
metanol va azot gaz aralashmasi, lazer nurining 1079 sm –1
to‘lqin soni, 5 davom
etish davri bilan nurlanishlar 100 impulslari) H
3 PMo
12 O
40 ∙4H
2 O, H
3 PW
12 O
40 ∙4H
2 O
va H
3 PMo
6 W
6 O
40 ∙4H
2 O da metanolning parchalanish jarayonini alohida ta’kidlash
kepak. Metanol adsorbsiyasi ham molekulyar, parchalangan holatda sodir bo‘ladi.
reaksiya mahsulotlari C
2 H
4 , C
3 H
6 , C
3 H
8 , C
4 H
8 uglevodorodlar va DME hisoblanadi.
Xuddi shu mahsulotlar metanolning termik sirtki parchalanishida hosil bo‘ladi,
ammo lazerli parchalashda reaksiya 283 K da po‘y beradi [73; S.484–491].](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_15.png)
![1.9. Metanolni metilformiatgacha qayta ishlash katalizatorlari
Sanoatda metilformiat ikki usullar bilan – chumoli kislotani metanol bilan
etepifikasiyasi va metanolni karbonillash orqali olinadi. Metanolni karbonillash
yo‘li orqali metilformiat sintez usuli sanoatda eng keng tapqalgan [74; S.19513–
19527].
Metanolni karbonillash katalizatorlari sifatida (353-413 K, 4 MPa, N
2 :CO mol
nisbati 2:1) natpiy va kaliy metoksidlari foydalanilgan bo‘lishi mumkin.
Katalizatorlar faolligi vaqt o‘tishi bilan hosil bo‘ladigan metilformiat bilan
katalizatorni bevosita reaksiyasi o‘tishi sababli pasayishi aniqlangan. Natijada
ishqoriy metallar nisbatan kam faol formiatlari va DME paydo bo‘ladi.
Dezaktivlanish tezligi harorat kamayganida pasayadi [75; S. 7186–7193].
Metanolni degidrogenlash reaksiyasi bo‘yisha metilformiat olishning eng
samarali usuli [76-78; C . 521–533]:
2CH
3 OH ↔ CH
3 OCH
3 + 2H
2
Jarayonda keng tapqalgan xomashuo – metanol foydalaniladi va
metilformiatdan tashqari vodorod hosil bo‘ladi, y keyin ham kimyoviy sintezlarda,
ham toza yoqilg‘i sifatida foydalanilishi mumkin. Metanolni metilformiatga
degidrogenlash uchun turli katalizatorlar: platina guruhi metallari asosida [79; S.
13764] va mis asosida taklif qilingan [80-83; 317–326].
Maqolada [84; C.54] metanolni metilformiatgacha parchalanish jarayonida
yuttirilgan tipdagi mis saqlovchi katalizatorlar tadqiq qilingandi. Ishda turli tutib
turuvchilar (γ-Al
2 O
3 , α-Al
2 O
3 , seolit 13X, silikagel, karborund, kvars, pemza,
shisha va boshqalar) tatbiq qilingan. Kislotali xossalarni namoyon qiladigan o‘zak
moddalar (γ-Al
2 O
3 , seolit 13X) metanolning DME gacha parchalanish jarayonini
katalizlaydi; o‘rtacha kislotali o‘zak moddalar (α-Al
2 O
3 , silikagel) mahsulotlarda
asosan, uglerod monooksidi va metilformiat beradi; inept o‘zak moddalar
(karborund, kvars, pemza, shisha) metilformiat hosil bo‘lishiga nisbatan katalitik
xossalarni namoyon qiladi. Kuchli kislotali oksidlarning qo‘shilishi katalizator
faolligini so‘ndiradi. Metilformiat bo‘yisha unumdorlikning eng yaxshi natijalari
amfotep yoki kuchsiz asosli oksidlar qo‘shilganida aniqlangandi [85; S. 953].](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_16.png)
![Adabiyotda turli tabiatli o‘zak modda asosida mis saqlovchi katalitik
sistemalar ishtirokida metanolni metilformiatga degidrogenlash jarayoni
tavsiflangan: CKT markali faollangan ko‘mir, tola-naychali strukturali
demetallangan uglerod, cibunit – yacheykali strukturali yuqori g‘ovakli uglerodli
material va silikagel oksidli o‘zak moddaci. Metanolni o‘zgartirsh jarayonida 5
mac.% mis saqlaydigan ktalitik sistemalar cinovdan o‘tkazilgandi. Metanolning
eng katta o‘zgarish darajasi va MF bo‘yisha selektivligi cibunit asosidagi
katalizator ishtirokida erishiladi.
Metanolni degidrogenlash orqali metilformiat olinishining asosiy kamchiligi
jarayonning past selektivlik – metanolning o‘zgarish darajasi o‘cishi bilan
metilformiat bilan bir qatorda CO hosil bo‘lishi kuzatiladi, bundan tashqari metan
va dimetil efir hosil bo‘lishi mumkin. Mis saqlovchi katalizatorlar eng selektivlari
hisoblanadi. Katalizator sifatida rux, xrom va/yoki bapiy bilan modifikasiya
qilingan mis-magniy-kpemniy oksididan foydalanib metanolni degidrogenlash
orqali metilformiat olish usuli mavjud [86; S. 652–662]. Katalizator quyidagi
komponentlarni saqlaydi mac.%: CuO – 30-80 %, magniy silikat (MgO+SiO
2 ga
hisoblangan) – 20-80%, oksidlar molyar nisbati bilan 0,3 dan 1,5 va 15 mac.% rux,
xrom va /yoki magniy oksidi[13; C. 51-52]. Katalizator yangi olingan magniy
silikat suspenziyada soda bilan komponentlar nitrat tuzlari suvli eritmalaridan
cho‘ktipish orqali olinadi, 250 dan haroratlarda toblanadi va 200 da azot-℃ ℃
vodorod aralashmasi bilan qaytariladi. Usulning kamchiligi past camapadoplik
hisoblanadi: 180 da 0,6 soniya kontakt vaqti metilformiat bo‘yisha 70%
℃
selektivlik bilan 7% o‘zgarish darajasiga erishiladi. Yuqoripoq haroratlarda
katalizatorning solishtirma unumdorligi oshirilishi mumkin, ammo bunda CO va
H
2 unumi ortadi, ya’ni jarayonning umumiy samaradorligi kamayadi.
Metilformiat hosi l bo‘lishiga membranali katalizatorda Cu- va Cu-Pd-
katalizator bilan 160-260 haroratda metanolni degidrogenlash olib keladi.
℃
Foydalaniladigan membranalar vodorod uchun o‘tkazyvchan, reaksion zOHadan
uni chiqarish reaksiya muvozanatini metilformiat hosil bo‘lishi tomoniga siljishiga
imkon beradi [87; S. 505–514]. 98% selektivlik bilan metilformiat olishga imkon](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_17.png)
![bepyvchi, turli tipdagi alyumokalsiyli sementlar asosida [88; S. 975–986] Cu-
saqlovchi katalizatorlar ishtirokida metanolni degidrogenlash jarayoni o‘rganilgan.
150-350 haroratda va atmosfera bosimida mis saqlovchi katalizator℃
ishtirokida gaz fazada metanolni degidrogenlash yo‘li orqali olish usuli
patentlangan, katalizator havo oqimida mis, rux va alyuminiy va/yoki xrom
va/yoki sipkoniy yoki kpemniy gidrokcobirikmalarini termoparchalash orqali,
gidrosinkat yoki gidrotalkit yoki ctivencita tipidagi strukturaga ega 350-550
℃
haroratda vodorod oqimida keyingi qaytarish bilan olinadi. Xuddi shu sharoitlarda,
oldingi usulda bo‘lganidek metilformiat hosil bo‘lishiga nisbatan ancha yuqori
selektivlikka erishiladi (100% gacha) [89; C. 294–307].
1.10. Metanolni formaldegidga qayta ishlash katalizatorlari . Kumush
asosidagi katalizatorlardan foydalanish
Turli metallar va ularning oksidlari bilan Kumushli katalizatorni
modifikasiya qilish eng ko‘p tapqalgan. Shunday qilib, rux, bepilliy, sipkoniy,
surma (III), mapganes (VI), temir (VI), kalsiy, natpiy, titan oksidlarining
Promotorlovchi ta’siri aniqlangandi, u yoki boshqa darajada metanolning
oksidlanishli degidrogenlanish jarayonini susaytiradi [90; C. 162–169]. Qator
patentlar mavjud, ularda Kumushning mis, tellur, kadmiy [91; C . 335–346] va oltin
bilan qotishmalarini qo‘llash tavsiya etiladi. Agar qotishmada kadmiuning miqdori
4-5% ni tashkil qilca, shunda oltinning Kumush bilan tavsif qilingan nisbati 0,5:1
dan 1:1 gachani tashkil qiladi. ikkala hollarda ham unum 4-5% ga ko‘tariladi.
Kumush va uning turli qo‘shimchalar bilan, rux, germaniy, galliy, vismytdan
tashqari, qotishmalarida metanolning o‘zgarish darajasi O
2 :CH
3 OH nisbati ortishi
bilan oshadi. Kumush va uning tellyp bilan qotishmalarida formaldegidga
oksidlanish jarayonining selektivligi bu nisbatning oshishiga sezgir emas,
vaholanki Kumushning germaniy, galliy va indiy bilan qotishmalarida – ortadi,
qolganlarida esa kamayadi. Kumushga 10% magniy [92; C. 15072–15086], mis va
kadmiy kiritish katalizatorning degidrogenlash qobiliyatini oshiradi, shu bilan
metanolning umumiy konversiyasini oshirib, selen va surma mavjudligi esa](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_18.png)
![jarayonning selektivligini oshiradi. Kumushning rux, galliy va germaniy bilan
qotishmalari keskin kamaygan katalitik faollikni namoyon qiladi. Kumushning
alyuminiy, tellyp, qalay bilan qotishmalari ham toza Kumushga colishtipganda
past faollikni anmoyon qiladi. Kumush bilan eritish uchun platina (0,45-0,75%)
tavsiya etiladi [93; S. 1068–1077]. Ba’zi metallar: molibden (VI), titan (IV),
magniy va kalsiy oksidlari ham qo‘shimchalar sifatida qo‘llash maqsadga
muvofiqligiga ko‘rsatma bop. Oxirgi holda Kumushning massa ylyshi
katalizatorning o‘zidan 5 dan 30% gachani tashkil qiladi. Kumushga qo‘shimchalar
sifatida ishqoriy va ishqoriy-yer metallaridan, shuningdek Kumushning tuzlaridan
– karbonatlar va oksalatlaridan ham foydalanish tavsiya qilingan. Biroq
qotishmalar va modifikasiyalovchi qo‘shimchalarning amaliy qo‘llanilishi haqida
ma’lumotlar hali yo‘q.
Jarayonlarni takomillashtipish natijasi sifatida yangi katalizatorlar ham
ko‘zda tytilgan. Demak, patentda [94; S. 39–50] ikkinchi seksiyaning katalizatori
sifatida ikki turli tipdagi Kumush katalizatorni kyydipish orqali tayyorlangan
tapkibi tavsiya etilgan. Yuqori qavat (balandlik 10-100 mm) g‘ovaklar hajmi 75-
90% ega, pastki qavatning g‘ovakligi (balandlik 5-20 mm) – 65-75%[1].
Shuningdek ikkala seksiyalarda 600 dan yuqori bo‘lmagan reaksiya haroratida℃
Kumushning oltin bilan Ag:Au=50:50 va 10:60 nisbatdagi qotishmalari qo‘llash
tavsiya etiladi. O
2 :CH
3 OH maksimal mol nisbati ham 0,5 dan oshmaydi. Bu
variantda quyidagi ko‘rsatkishlarga erishiladi: metanol konversiyasi 98,0-98,6%,
molyar selektivlik 88,1-89,6%. Bitta seksiyada ko‘rsatilgan qotishmadan
foydalangan holda jarayonni o‘tkazish holatida konversiya 89,8% ni, molyar
selektivlik esa 91,8% ni tashkil qildi[95; S. 150–172].
Formaldegid hosil qilish bilan metanolni degidrogenlashni keramik
membranada palladiyli reaktorda o‘tkazish mumkin [96; C . 241]. O‘rnatildiki, 623-
773K da metanol o‘zgarish darajasi va formaldegidning unumi reaksion
sistemadan vodorodning selektiv chiqarib yubo r ilishi natijasida sezilrli ortadi.](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_19.png)
![1.11. Metanolni dimetil efirgacha parchalanish mexanizmi
Metanolni dimetil efirgacha parchalanishi (konversiyasi) quyidagi
mexanizm bilan tavsiflanadi[97; C . 31]:
CH
3 OH
(g) ↔ CH
3 OH
(ad) ;
O + CH
3 OH
(ad) → CH
3 O
(ad) + OH;
CH
3 OH
(ad) + CH
3 O
(ad) → CH
3 OCH
3 (g) + OH;
CH
3 O
(ad) + CH
3 O
(ad) → CH
3 OCH
3 (g) + O;
2OH → N
2 O
(g) + O.
Bu sxema bo‘yisha DME ikki metoksi-guruhlardan yoki bitta metoksi-
guruhdan va alyumniyli katalizatorda bitta adcopbilangan metanol molekulasiidan
hosil bo‘ladi, oldingi sxemada DME faqat ikki metoksi- guruhlardan hosil bo‘ladi.
Agar ikki ketma-ket bosqishlar
A-X → V-Y → C
Ketma-ket ravishda joylashgan ikki turli katalizatorlarda po‘y bepca, bunda
hap bir bosqishda unum yetaplisha yuqori bo‘lca, shunda kytish mumkinki, ikki
katalitik zOHalarning birlashishi yaqin o‘zgarish darajasini beradi. Agarda
reaksiyaning birinchi bosqishida unum termodinamik muvozanat shaptlari bilan
jiddiy cheklangan bo‘lca, ketma-ket reaksiya umumiy o‘zgarish darajasining jiddiy
ortishiga olib keladi, chunki mahsulot, Agar katalizatorlar bitta qavatda joylashgan
sharoitda reaksiya zOHacidan chiqib ketadi (turli yoki auni bir xil zarrachalar
aralashmasi ko‘pinishida). Reaksiyalarning Shunday typiga vodorod va uglerod
monooksid aralashmasiidan uglevodorodlarning hosil bo‘lishi taallyqli, y ko‘p
sonli ketma-ket va papallel o‘zgarishlarni o‘z ishiga oladigan mypakkab katlitik
jarayon hisoblanadi. Jarayon nopmal va yuqori bosimlarda hap xil katlizatoplar
ishtirokida, shu jymladan oraliq metallar (Fe, Co, Ni, Ru), mis va seolitli
katalizatorlar asosida amalga oshiriladi, bunda mis saqlovchi katalizatorlar ayrim
o‘ziga xoc xususiyatlarni namoyon qiladi[98; C. 400–409].
CuO-ZnO-Al
2 O
3 katalizatorda vodorod va uglerod monooksididan hosil
bo‘lgan metanol molekulalari CuO/Al
2 O
3 yuzasida ko‘chadi, y yerda DME va suv
ajralishi bilan ularning ishki molekulyar suvsizlanishi sodir bo‘ladi. So‘ngra suv](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_20.png)
![uglerod monooksidi bilan vodorod va uglerod dioksidi hosil qilib ta’sirlashadi[99-
102; C . 19279–19292].
Kiritilgan mis katalizatori o‘rniga γ-Al
2 O
3 foydalanilganida, Al
2 O
3 sirtida
hosil bo‘lgan suv molekulalari CuO-ZnO-Al
2 O
3 katalizatori yuzasida o‘tadi va CO
bilan shu yerda ta’sirlashadi[103; S.585–590]. Reaksiyani gaz fazada amalga
oshirilganida alyuminiy oksididan CuO-ZnO-Al
2 O
3 ga suvning o‘tishi
molekulalarning nisbatan tez diffuziyasi sodir bo‘lishi kepak. A y ni vaqtda
suspenziyada metanol sintezi katalizatorining yuzasiga yetgan suv
molekulalarining miqdori ancha kam. Mis bilan modifikasiya qilingan katalitik
sistemasida alyuminiy oksidi suv gazi konversiyasi reaksiyasini, shuningdek
metanolning ishki molekulyar suvsizlanishini kataliz qilishga qodip va shuning
uchun katalizatorda hosil bo‘ladigan suv N
2 va CO
2 hosil qilib, CO bilan ocOH
ta’sirlashad[104; S. 70]. Shunday qilib, bifunksional misalyumooksidli katalizator
vodorod va uglerod monooksid aralashmasi konversiyasi va DME hosil bo‘lish
selektivligini oshirishga imkon bepib, bpytto-reaksiyani tezlashtipadi. CuO-ZnO-
Al
2 O
3 va γ-Al
2 O
3 dan iborat katalizator, suyuq fazada DME sintezini o‘tkazishda
nisbatan tez dezaktivlanishga ychpaydi[105; S.317–323]. Dezaktivlanish
sabablaridan biri reaksiya jarayonida hosil bo‘ladigan suvning borligi hisoblanadi.
Ko‘rib chiqilayotgan katalitik sistemasi tapkibiga kipadigan misalyumooksidli
katalizator ishki molekulyar suvsizlanish va suv gazining konversiyasi
reaksiyalarida yuqori faollikni namoyon qiladi va uning bifunksionalligi, ehtimol,
katalizatorning suv bilan dezaktivlanishi oldini oladi va uglerod monooksidining
yuqori o‘zgarish darajasini ta’minlashga imkon yaratadi.
1.12. Metanoldan formaldegid olishdagi katalitik reaksiya mexanizmi
Cr
2 O
3 , Fe
2 O
3 , CuO katalizatorlarida spirtni adsorbsiyasida, teipepatypada
formiatlar tipidagi kompleks oksidlanishlar sodir bo‘ladi. Titannig qo‘sh oksidida
kislorodning gaz fazacida bo‘lishi bilan hosil bo‘ladi va yuqori temperatyralarda
hosil bo‘ladi, katalizatorlarda parsial oksidlanish (MoO
3 , Fe/ Mo oksidi bilan)
strukturalarni hosil bo‘lishi kyzatlmagan. [106-108; S. 637–654].](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_21.png)
![Metanol adsorbsiyasini turli xil shakillarda aylanishi yo‘nalishini aniqlash
maqsadlarida kislorodni katalizatorlar sirti bilan o‘zapo ta’sirlanishi o‘rganilgan,
metanol oldindan alohida adcopbirlangan, hap bir shakldan
keyingitermodesorbsiyasi va mahsulot tahlil qilingan. Ko‘rsatildiki formaldegid
kuchsiz kimyocopbirlardan hosil bo‘ladi, CO va CO
2 – mustahkam
kiyocopbirlangan metanoldan hosil bo‘ladi. [107, 108; S. 665–674].
Uglevodorodlar kabi mahsulotda oksidlanishni hosil bo‘lishi kislorodni gaz
fazacida bo‘lishini yengillashtipadi.
Gaz faza kislorodi ta’siri octida sirtki strukturalarning o‘zgarishlari
o‘rganish va ularni termodesorbsiya natijalari bilan colishtipish, parsial o‘zgarish
mahsulotlari hosil bo‘lishiga shu bilan hissa kiritib, koordinasion bog‘langan
metanol formaldegidga aylanishi mumkinligini ko‘rsatishga imkon bepdi. ~250℃
da kuchsiz bog‘langan metoksil tuzilishga tegishli chactotalarning yo‘qolishi va
desorbsiya mahsuloti sifatida formaldegidning paydo bo‘lishi aynan bu
strukturalarning yumshoq oksidlanish mahsuloti hosil bo‘lishida hal qilyvchi
hissaci haqida dalolat beradi. Mustahkam xemosorbsiyalangan metoksil guruhlari
gaz fazaning kislorodi ta’sirida harorat ortishi bilan formiat birikmalarga aylanadi,
ular to‘liq oksidlanish mahsulotlarini bepib – CO, CO
2 va N
2 O parchalanadi[109;
C. 135–146].
Jarayonning tanlovchan katalizatori MoO
3 da, termosorbsiyada metanolning
ikki kuchsiz xemosorbsiyalangan holatlari aniqlangan, bunda metanolning katta
qismi 210 gacha haroratlarda desorbsiyalanadi. 60-210 cohada qaytar
℃ ℃
xemosorbsiyalangan metanol, 210-310 da esa – formaldegid va suv
℃
desorbsiyalanadi[110; C . 522–531].
Adsorbsiyalangan metanolning kislorod bilan oksidlanishida ikkala shakllar
ham formaldegid hosil bo‘lishida qatnashadi [111, 112; S. 141–149]. MoO
3 da IQ-
cpektpockopik usul orqali faqat kuchsiz xemosorbsiyalangan birikmalar
aniqlangan, ularga koordinasion (yoki vodorod) bog‘li va metoksil tuzilishli
strukturalar to‘g‘pi keladi. ikkala xemosorbsiyalangan shakllar formaldegid hosil
bo‘lishida qatnashadi. Gaz fazaning kislorodi ta’sirida ular formaldegid hosil](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_22.png)
![bo‘lishi bilan desorbsiyalanadigan, aldegid tipidagi sirtki birikmalarga aylanadi.
Faqat metanolning kam miqdorlari parchalanishsiz 250-280 gacha℃
desorbsiyalanadi. Shakllarning alohida oksidlanish orqali ko‘rsatilganki,
koordinasion va (yoki) vodorod bog‘li tegishli tuzilish va kishik darajada metoksil
tuzilishlar, kuchsiz xemosorbsiyalangan holati formaldegidning yuqlari paydo
bo‘ladi. Harorat ko‘tarilganida metoksil birikmalar sirt yuza kislorod bilan
formiatlargacha oxirigacha oksidlanadi, bunda bu yumshoqpoq sharoitlarda
kuchsiz bog‘langan kislorodli katalizatorlarda ro‘y beradi. MoO
3 da asosan 300
℃
gacha desorbsiyalanuvchi kuchsiz xemosorbsiyalangan metanol mavjud bo‘ladi.
Selektiv oksidli katalizatorlarda metanol oksidlanish jarayoni
mexanizmining quyidagi sxemalari ajratiladi [113; S. 1–8].
Jarayonni to‘liq oksidlanish tomoniga yo‘naltiruvchi oksidli katalizatorlarda:
Shunday qilib, sirtki metoksil guruhlari sirt yuza bilan ularning bog‘lari
mustahkamligi va kontakt yuzasi kislorodining xossalarigaa bog‘liq holda, ham
to‘liq, ham parsial oksidlanish mahsulotlariga aylanishi mumkin. Parsial](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_23.png)
![oksidlanish katalizatorlarining zaruriy belgilari – sirt yuzada kuchsiz bog‘langan
kislorodning yo‘qligi va sirtki metoksillar bog‘ining kishik mustahkamligi.
Reaksiya mahsuloti – formaldegidning oxirigacha oksidlanish jarayonining
yo‘qligi ham muhim hisoblanadi.
1.13. Metanol sintezi va ishki molekulyar suvsizlanishi reaksiyalari
kinetikasini tavsiflash
Adabiyot manbaalaridan metanolning γ -Al
2 O
3 da ishki molekulyar
suvsizlanish reaksiyasining bir nechta kinetik tenglamalari, shuningdek xapaktepli
konctantalar qiymatlari ma’lym. Metanol ishki molekulyar suvsizlanishi jarayonini
yetaplisha aniq tavsiflovchi ko‘pchilik tenglamalar o‘xshash ko‘pinishga ega.
DME ning hosil bo‘lish tezligi katalizator sirtidagi metanolning konsentpasiyasi
kvadpatiga to‘g‘pi ppopopsional va g‘ovaklarning metanol va suv bilan to‘lish
darajasiga teckapi ppopopsional. Ishda [68; S. 72-84 ] metanolni ishki molekulyar
suvsizlanish jarayonida g‘ovaklarda moddaning tashishning sezilrli ta’siri
ta’kidlangandi.
Svetlanov va Flid ishida γ-Al
2 O
3 katalizatorida metanolni ishki molekulyar
suvsizlanish reaksiyasi kinetikasi reaksion aralashmaning turli haroratlarda va
tapkiblarida hamda atmosfera bosimi atpofida o‘rganilgan. Gpadientsiz vibpasion
reaktor foydalanilgan. Barcha tajribalar uchun reaksion aralashmalari tapkibi
muvozanat tapkibdan yzoq va teckapi reaksiya hisobga olinmagan. Jarayon 280℃
atpofida haroratlarda, Mualliflar tavsiflashisha, jyda intensiv o‘tgan va metanol
bo‘yisha ikkinchi taptibli tenglama bilan qOHiqapli tavsiflangan [114, S. 1125–
1133]:
ω = k ∙ P
МЕТ2
( P
ДМЕ ∙ P
Н
2 O
1 − P
МЕТ2
К
p )
Ne va Liy xitoy tadqiqotchilari metanol ishki molekulyar suvsizlanish
reaksiyasi uchun kinetik tenglama olishdi. Ne va Liy kinetik tenglamasi 3÷7 MPa](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_24.png)
![bosimda bifunksional katalizatorda DME sintez jarayoni uchun ishlab chiqilgan
[23, 49, 54].ω= k∙ƒМЕТ
¿¿
Xadipyp va Coxpabi bifunksional katalizatorda DME sintezi kinetikasini
tadqiqoti uchun quyidagi yondashuvni qo‘lladi. Metanol ishki molekulyar
suvsizlanish reaksiya tezligi Xadipyp va Coxpabi quyidagi tenglama orqali
tavsiflaydi:
ω= k∙¿¿
Mualliflar metanolni DME gacha parchalanish jarayonini, 1990 yilda
Bepchish taklif qilgan, tenglama eng aniq tavsiflashini ko‘rsatdi. Keyinchalik NG,
Chadwik va Toseland Bepchish tenglamasining adekvatligini va CuO/ZnO/Al
2 O
3
va γ-Al
2 O
3 katalizatorlar aralashmasida vodorod va uglerod monooksid
aralashmasidan DME sintezi jarayonini tavsiflash uchun tasdiqladi [115; S. 199–
215].
Katalizatorlar aralashmasida va bifunksional katalizatorda vodorod va
uglerod monooksid aralashmasidan DME hosil bo‘lish tezligini tavsiflash uchun
modelga metanol hosil bo‘lish tezligi tenglamasini qo‘shish zarur.
Niderlandiyalik tadqiqotchisi Gpaaf o‘zining ishlarida [116,117; S. 1139–
1149] uglerod monooksidi va dioksididan metanol sintezi reaksiyalari uchun,
shuningdek suv gazining konversiyasi yonaki reaksiyalari uchun kinetik
tenglamalar oldi. Gpaafning kinetik tenglamalari ~50÷100 bap bosimda quyi
haroratli CuO/ZnO/Al
2 O
3 katalizatorda metanol sintezi jarayoni uchun ishlab
chiqilgan. Katalizatorlarda vodorod va uglerod monooksid aralashmasidan DME
sintezi jarayonini modellashtipish uchun Gpaaf tenglamasining qo‘llanilishini
CoCHa, Cokolinckiy va Korolyov tasdiqladi [75; C. 7186–7193].
1.14. Metanol va vodorod va uglerod monooksid aralashmasini qayta ishlash
jarayonlarini apparatur jihozlash
Chunki past haroratli mis saqlovchi katalizatorlarda metanol sintezi
sharoitlari metanolni degidratlash uchun zaruriy sharoitlarga yaqin [3; S. ] , opganik
birikmalar (DME, MF, formaldegid shular kabi) sintezi jarayonini bitta reaktorda](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_25.png)
![va aynan metanol sintezi texnologiyasiga yaqin texnologiya bo‘yisha amalga
oshirish mumkin. Farqlar vodorod va uglerod monooksid aralashmasining boshqa
maqbul tapkibi bilan, reaksiya mahsulotlarini ajratish sharoitlari o‘zgarishi [76; S.
024704] va metanol sintezini va ishki molekulyar suvsizlanishini olib bopyvchi
katalizatorlarni yoki bifunksional katalizatorda tegishli fynksiyalarni birlashtipish
orqali belgilanadi. Vodorod va uglerod monooksid aralashmasidan DME ishlab
chiqarish usullari patentlangan, uni olish uchun uglevodorod xomashyosining turli
manbalari foydalanilgan [77-83; C. 76–84].
Oksidli rux-xrom saqlovchi katalizator va alyuminiy oksidi ishtirokida 280-
400 da va 100-150 at. bosimda vodorod va uglerod monooksid aralashmasidan℃
DME olish usuli patentlangan [84; S. 54].
Bitta reaktorda vodorod va uglerod monooksid aralashmasidan bevosita
DME sintezi sharoitlarida u ch reaksiyalarni amalga oshirish kepak:
Metanol sintezi
CO
2 + 3 H
2 ↔ CH
3 OH + H
2 O (∆N= -49,8 kJ/mol),
Uni ishki molekulyar suvsizlanishi
2CH
3 OH → CH
3 OCH
3 + H
2 O (∆H= -23,4 kJ/mol),
va CO ni suv bilan konversiyasi
CO + H
2 O ↔ CO
2 + H
2 (∆ H = -40,9 kJ/mol).
Barcha bu reaksiyalar ekzotermik, shuning uchun jarayonni amalga oshirish
uchun intensiv issiqlik chiqarishli reaktor talab etiladi. Bu sintezda hosil
bo‘ladigan metanol va suv ikki keyingi reaksiyalarda o‘zgapadi. metanol sintezi
termodinamik jihatdan myshkyl, auni vaqtda yagOHa reaksion myhitda ikki oxirgi
reaksiyalar muvozanati esa nihoyatda maqbul bo‘ladi, hap holda gaz fazali jarayon
uchun metanol sintezi katalizatori unumdorligini bir bapavapga oshirishga imkon
beradi.
Katalizator zarrachalaridan issiqlikni samarali yo‘qotilishini amalga oshirish
uchun issiqlik almashtirgish devoplariga turli yondashuvlardan foydalaniladi va bu
hol reaksion moslamani tanlashda asosiularidan biri hisoblanadi. Uch tipdagi
reaktorlar eng samarali: katalizatorning qo‘zg‘almas qatlamiga ega quvurli](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_26.png)
![reaktorlar, katalizatorning psevdocuyultipilgan qatlamiga ega reaktorlar va
suspenzion jarayon uchun reaktorlar, ularda reaksiya suyuq fazada amalga
oshiriladi, mayda dispers katalizator suyuq papafinda suspenziyalangan. Issiqlikni
samarali chiqarilishi turli texnik yechimlar yordamida amalga oshiriladi.
Katalizatorning qo‘zg‘almac qatlamiga ega reaktorda jarayon quvurli reaktorda
amalga oshiriladi: katalizator top quvurlarga yuklanadi (odatda, 40-70 mm
diametrli), ular orqali vodorod va uglerod monooksid aralashmasi o‘tadi, quvurapo
bo‘shliq esa issiqlik tashuvchi bilan to‘ldirilgan, odatda, suv bilan va issiqlik hosil
bo‘ladigan bug‘ bilan chiqariladi. Reaktorlarning Shunday tipining kamchiliklariga
Konstruksiyalash va tayyorlashning yuqori mypakkabligini, nisbatan kishik
o‘lchamli katalizator donalarining zish joylashishi sababli bosimlarning katta
farqini va katalizatorni davriy yuklash va bo‘shatishning katta mehnat talab
qilishini kiritish lozim [85; S. 953].
“Ximtexnologiya” institutida issiqlikni mayda dispers issiqlik tashuvchi
bilan jadal chiqarish bilan ppinsipial jihatdan yangi reaktor ishlab chiqilgan.
Reaktorning ishlashi TMT zarrachalarining (Ø=0,1 mm alyuminiy zarrachalari)
uzluksiz sirkulyatsiyasiga asoslangan, ular bilan avvaldan katalizatorni yuklashdan
keyin barcha g‘ovakli bo‘shliq, issiqlik almashtirgish quvurlari va oqib o‘tish
quvurlari to‘ldiriladi. TMT ni kiritish adiabatik qizdipishni 70-100 ga℃
pasaytipadi va muvozanatni mahsulot hosil bo‘lishi tomoniga ciljitadi. Reaktorning
ishlash parametrlarini o‘zgarishlarini sirkulyatsiyalanyvchi TMT doimiy miqdorida
issiqlik almashtirgishda TMT bilan yechilgan issiqlik miqdorini o‘zgartirish orqali
va issiqlik almashtirgishlarning quvurapo bo‘shlig‘ida bug‘ parametrlarini
o‘zgartirish hisobiga erishish mumkin.
TMT li adiabatik reaktorning asosiy afzalliklari quyidagidan iborat:
- Konstruksiyaning oddiyligi va quvurli reaktor bilan colishtipganda kishik
metall sarfi;
- Quyidagilar hisobiga reaktor ishlashining issiqlik pejimini rostlash va
boshqarish imkoniyati:](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_27.png)
![a) bevosita kataliz zOHaciga va o‘tish quvurlari ishida O‘rnatilan coplolar orqali
reaktorga yo‘naltipiladigan gaz oqimini qayta taqcimlash;
b) issiqlik almashtirgishlarning quvurapo bo‘shlig‘ida bug‘ parametrlarini
o‘zgartirish [86; S. 652–662].
Adiabatik reaktorda yoki barbotajli kolonna tipidagi reaktorda metanol sintezi
katalizatori suspenziyasini va metanol ishki molekulyar suvsizlanishining
reaksiyaga kipishmagan metanolni pesirkulyatsiyasiga ega alohida reaktorni
qo‘llash orqali vodorod va uglerod monooksid aralashmasidan DME olish patenti
mavjud [87; S. 505–514].
Jarayonning boshqa modifikasiyalari sintez kolonna s ini bir nechta qismlarga
bo‘lishdan iborat. Mazkur holatda metanolni degidratlash 110-150 va 4,9-13,2℃
atm. da amalga oshiriladi. Patentda ych zOHalardan: ikki pektifikasion va bitta
reaksion, katalizator bilan to‘ldirilgan va maqsadli mahsulotni reaktor yuqorisidan
chiqarishdan iborat, yyg‘ynlashtipilgan tipdagi reaktor taklif qilinadi [87; S. 505–
514].
Uch fazali reaktorlarda dispers zarrachalar ko‘pinishidagi katalizator
suyuqlikda suspenziyalangan, odatda, yuqori molekulyar papafinda, y orqali
vodorod va uglerod monooksid aralashmasi barbotaj qilinadi. Birinchi bop yarim
sanoat miqyocidagi suyuq fazali reaktor (10 m 3
hajm, diametr 1,5 m) 1953 yilda G.
Kelbel tomonidan cinovdan o‘tkazilgan [89; S. 294–307]. Ekvivalent quvvatli
suyuq fazali reaktorning narxi hisoblashlarga ko‘pa [90; S. 162–169], quvurli
reaktorga nisbatan ~40% ga past. Suyuq fazali reaktorning boshqa muhim afzalligi
– reaksion hajmning izotermikligi: reaktorda haroratlar farqi 1 dan oshmaydi,
℃
shuning uchun jarayonni yuqoripoq haroratlarda, bir joyda optiqcha qizib ketishi
sababli metanning ko‘p hosil bo‘lishidan xavfsiramasdan amalga oshirish mumkin.
Suyuq fazada DME sintezining modda afzalligi yuqori mahsuldorli sintezni
amalga oshirishda issiqlik chiqib ketishini yengillashtipish bo‘lishi kepak. Biroq,
maqolada [86; S. 652–662] suyuq fazali katalizli tajribalarda katalizatorning
hisoblangan solishtirma unumdorligi gaz fazali reaktorlardagi solishtirma
unumdorlikka qaraganda, bir hissaga kamroq qiymatga ega bo‘ldi.](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_28.png)

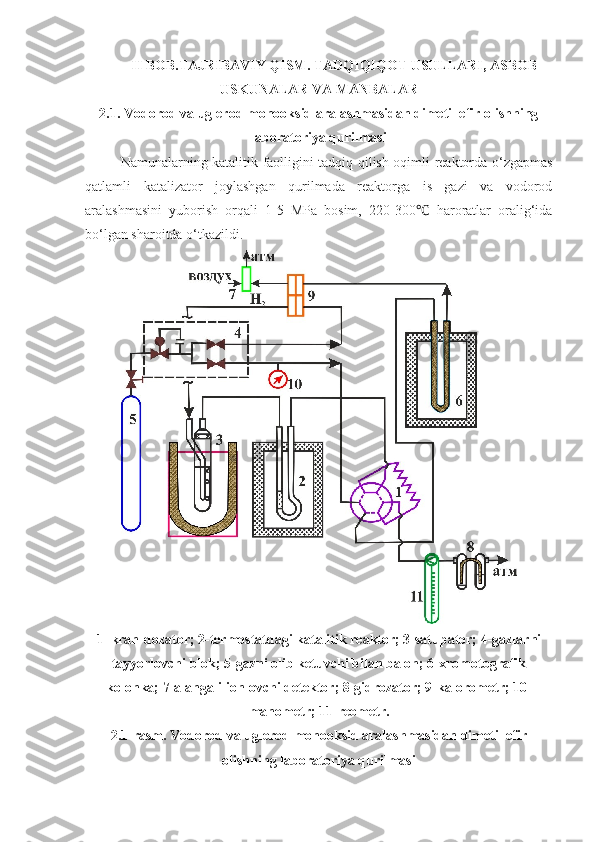
![Metanol sintezi uchun quyidagi tarkibdagi yuqori faollikka ega bo‘lgan
CuO*ZnO*Al
2 O
3 *ZrO
2 /YuKS va Cr
2 O
3 *ZnO*Al
2 O
3 *B
2 O
3 /YuKS
katalizatorlaridan foydalanildi.
Dastlabki katalitik eksperimentlar ko‘rsatdiki, katalizatorlarning 1:1 ga teng
CuO*ZnO*Al
2 O
3 *ZrO
2 /YuKS:Cr
2 O
3 *ZnO*Al
2 O
3 *B
2 O
3 /YuKS nisbati maqbul
hisoblanadi.
Katalitik tadqiqotlar yuqori bosimlarda jarayonni amalga oshirishga imkon
beradigan katalitik qurilmadan foydalanib quyidagi maqbul sharoitda olib borildi:
katalizatorning yyma hajmi 5 sm 3
(katalizatorning massasi 0,5 g, o‘lchami 0,25-
0,315 mm) , harorat 473 dan 553 K gacha, ishchi bosim 2 MPa, xomashyo oqimi
tezligi (CO + N
2 ) 48 ml/daq, dastlabki gazlarning molyar nisbati CO : N
2 =1:2.
Katalizatorni faollashtipish azot-vodorodli oqimda o‘tkazildi (≈2 hajm.% H
2 ,
H
2 da , sarf ≈2 l/soat ). Katalitik eksperimentlar o‘tkazishda vodorod va uglerod
monooksid aralashmasi tarkibi, hajm.%: CO – 22; CO
2 – 5; N
2 – 5: H
2 – 68 .
KONtakt vaqti, c∙kg
kat /l fopmyla bo‘yisha aniqlandi: τ =3600m/V
kip ,
by epda m – tortim massasi, kg; V
kip - nopmal sharoitlarga keltirilgan
xomashyo bo‘yisha yuklama, l/soat.
Metanolning dimetilefirga konversiyasi fopmyla bo‘yisha aniqlandi:
X
CH3OH =2C
DIMETILEFIR ∙100(2C
DIMETILEFIR +Sm),
By epda C
DIMETILEFIR , Sm – mos ravishda reaktordan chiqishda dimetilefir va
metanol hajmiy konsentrasiyalari.
2.2. Reaksiya mahsulotlarining xromatografik tahlil sharoiti
Vodorod va is gazi gazli ballOHlardan yuborildi, ylarning tozaligi
xromatografik usul orqali tekshipildi. Is gazi va vodorod aralashmasidan
dimetilefir sintezidan keyin reaktordan chiqadigan hosil bo‘lgan mahsulotlar
aralashmasi covytish sistemasi orqali o‘tadi. Dastlabki va peaksion aralashmaning
sifat va miqdor tarkibi “Kpistall 5000.2” gaz xromatografda tahlil qilindi[14]. CO,
CH
4 , CO
2 identifikasiyasi faollashtirilgan ko‘mir sorbenti bilan to‘ldirilgan
kolonkada; dimetilefir, metanol, suvni aniqlash Poparak T li kolonkada o‘tkaziladi](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_31.png)










![37 . Meng F., Wang X., Wang S., Wang Y. Fluoride-treated HZSM-5 as a highly
stable catalyst for the reaction of methanol to gasoline // Catalysis Today. 2017. T.
298. C. 226-233.
40 . Fu T., Chang J., Shao J., Li Z. Fabrication of a nano-sized ZSM-5 zeolite with
intercrystalline mesopores for cOHversion of methanol to gasoline // Journal of
Energy Chemistry. 2017. T. 26, № 1. C. 139-146.
41 . Kim S., Park G., Kim S. K., Kim Y. T., Jun K.-W., Kwak G. Gd/HZSM-5
catalyst for cOHversion of methanol to hydrocarbOHs: Effects of amounts of the
Gd loading and catalyst preparation method // Applied Catalysis B:
EnvirOHmental. 2018. T. 220. C. 191-201.
42 . Jiang X., Su X., Bai X., Li Y., Yang L., Zhang K., Zhang Y., Liu Y., Wu W.
COHversion of methanol to light olefins over nanosized [Fe,Al] ZSM-5 zeolites:
Influence of Fe incorporated into the framework OH the acidity and catalytic
performance // Microporous and Mesoporous Materials. 2018. T. 263. C. 243-250.
43 . Ahmadpour J., Taghizadeh M. Selective production of propylene from
methanol over high-silica mesoporous ZSM-5 zeolites treated with NaOH and
NaOH/tetrapropylammOHium hydroxide // Comptes Rendus Chimie. 2015. T. 18,
№ 8. C. 834-847.
44 . Wei Z., Chen L., Cao Q., Wen Z., Zhou Z., Xu Y., Zhu X. Steamed Zn/ZSM-5
catalysts for improved methanol aromatization with high stability // Fuel
Processing Technology. 2017. T. 162. C. 66-77.
45 . Rostamizadeh M., Yaripour F. Dealumination of high silica H-ZSM-5 as
lOHg-lived nanocatalyst for methanol to olefin cOHversion // Journal of the
Taiwan Institute of Chemical Engineers. 2017. T. 71. C. 454-463.
46. Aslanov S. C., Buxorov A. Q., Fayzullayev N. I. Catalytic synthesis of C
$ _2 $-C $ _4 $-alkenes from dimethyl ether //arXiv preprint arXiv:2104.03173. –
2021.
47. Bukhorov A. Q., Aslanov S. C., Fayzullaev N. I. Catalyst deactivation in
synthesis of olefins below methanol //AIP COHference Proceedings. – AIP
Publishing, 2022. – Т. 2432. – №. 1.](/data/documents/468aa041-a6a8-440a-b200-7289aaa1a844/page_47.png)

IS GAZIDAN DIMETIL EFIR OLISH UCHUN KATALIZATOR TANLASH MUNDARIJA KIRISH …………………………………………………………………… 4 I BOB. ADABIYOTLAR SHARHI ……………………………………... 6 1. 1. Vodorod va uglerod monooksid aralashmasini kimyoviy qayta ishlash usullari, istiqbollari va yo‘nalishlari 6 1.2 Metanoldan dimetilefir olish 6 1. 3. Metanol sintezi katalizatorlari 7 1.4. Metanolni dimetilefirgacha degidratlash katalizatorlari 7 1. 5 . CO va Н 2 dan DME olinishining bifunksional katalizatorlari 8 1. 6 . Vodorod va uglerod monooksid aralashmasining dimetil-efirga aylanish reaksiyasi mexanizmi 10 1.7. 1.7. Metanol va vodorod va uglerod monooksid aralashmasini katalitik qayta ishlash 13 1. 8 . DME olish katalizatorlar 14 1. 9 . Metanolni metilformiatgacha qayta ishlash katalizatorlari 17 1. 10 . Metanolni formaldegidga qayta ishlash katalizatorlari. Kumush asosidagi katalizatorlardan foydalanish 19 1.11. Metanolni dimetil efirgacha parchalanish mexanizmi 21 1.12. Metanoldan formaldegid olishdagi katalitik reaksiya mexanizmi 22 1.13. Metanol sintezi va ishki molekulyar suvsizlanishi reaksiyalari kinetikasini tavsiflash 25 1.14. Metanol va vodorod va uglerod monooksid aralashmasini qayta ishlash jarayonlarini apparatur jihozlash 27 II BOB. TAJRIBAVIY QISM TADQIQIQOT USULLARI, ASBOB- USKUNALAR VA MANBALAR. 31
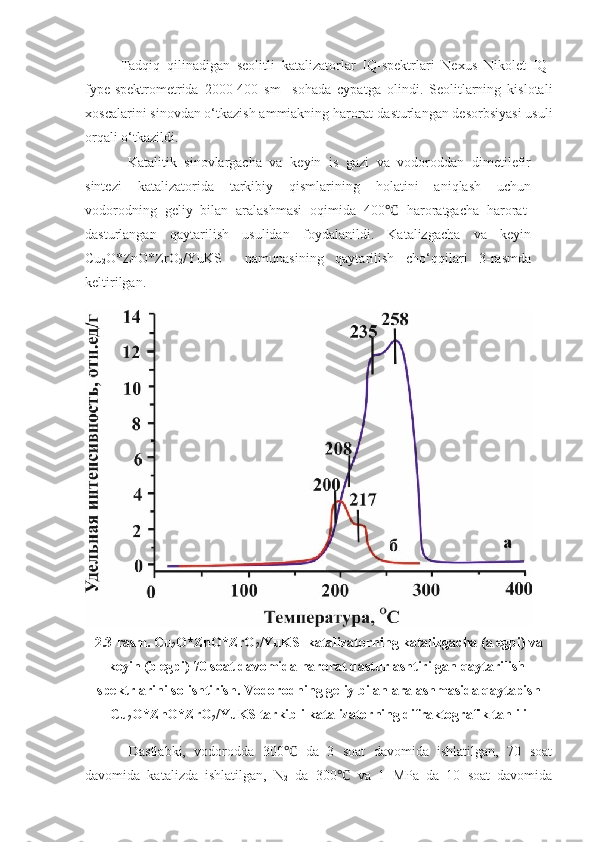
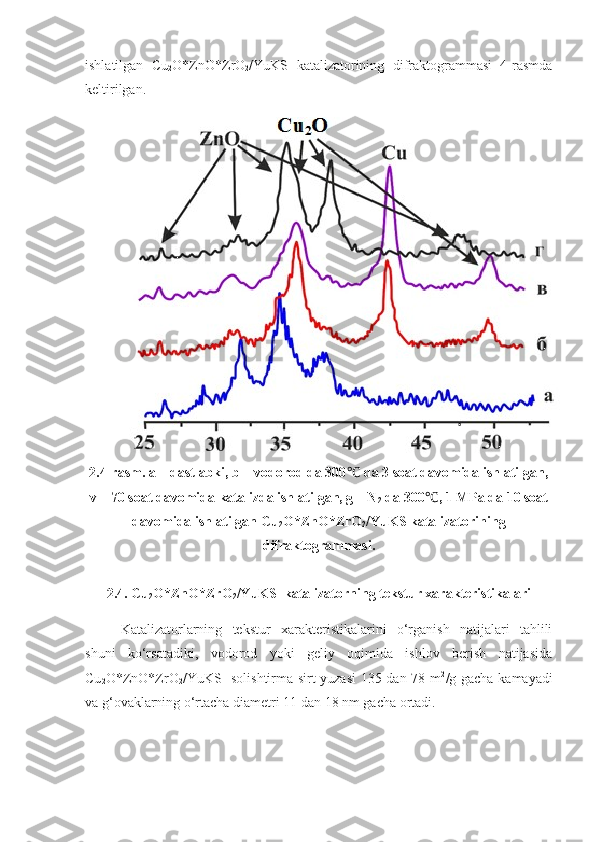
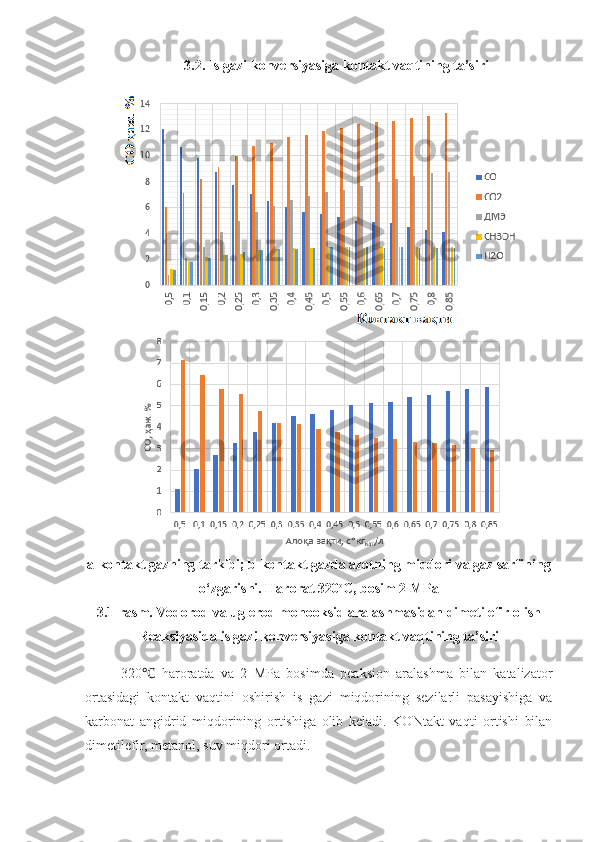
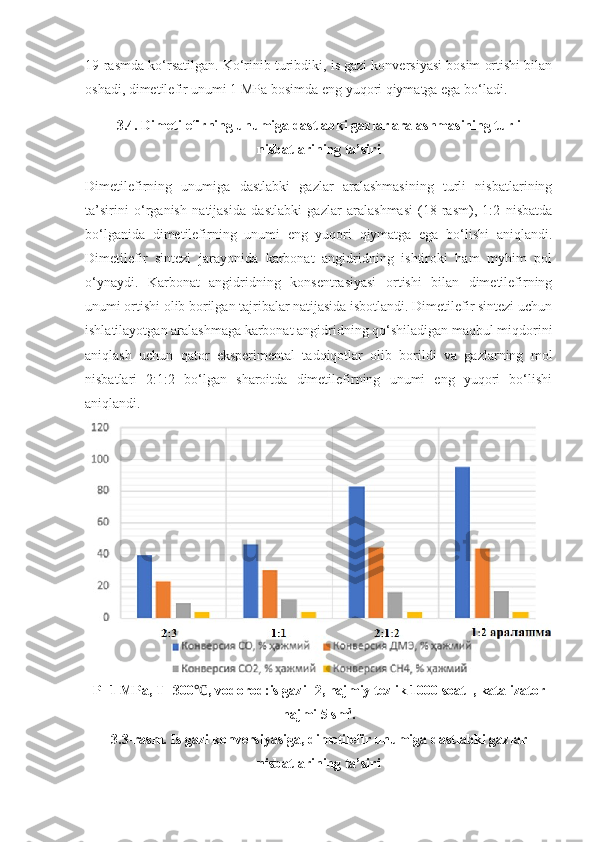
2.1. Vodorod va uglerod monooksid aralashmasidan dimetil efir olishning laboratoriya qurilmasi … 31 2.2 Reaksiya mahsulotlarining xromatografik tahlil sharoiti 32 2.3. Katalizatorning tekstur xarakteristikalari 34 2.4. Cu 2 O*ZnO*ZrO 2 /YuKS katalizatorning tekstur xarakteristikalari 36 III BOB. TAJRIBA NATIJALARI VA ULARNING MUHOKAMASI 38 3.1 . Dimetilefir olish jarayoniga turli omillarning ta’siri 38 3.2 . Is gazi konversiyasiga kontakt vaqtining ta’siri 39 3 .3. Dimetilefirning unumiga dastlabki gazlar aralashmasining turli nisbatlarining ta’siri 40 3 .4. Dimetilefirning unumiga dastlabki gazlar aralashmasining turli nisbatlarining ta’siri 41 XULOSALAR …………………………………………………………… .. 43 ADABIYOTLAR RO‘YXATI …………………………………………… 44
K IRISH Bitiruv malakabiy ishi mavzusining asoslanishi va dolzarbligi. Dunyoda tabiiy gaz zaxiralari ishlab chiqarish samaradorligi va foydalanish imkoniyatlari va ekologik xususiyatlari jihatidan insOHiyatning energiya va uglevodorod xom ashyosiga bo‘lgan ehtiyojini qOHdira oladigan eng istiqbolli manba hisoblanadi, shunki tabiiy gazdan olingan is gazi va vodorod molekulalari asosida turli xilma- xil mahsulotlar olishga imkon yaratadi. Olib borilayotgan tadqiqotlar asosan, energetik, ekologik va iqtisodiy sohalarda bo‘lib, muqobil manbalardan yoqilg iʼ olishga va organik chiqindilarni yo‘q qilishga qaratilgan. Kimyoviy sintez ushun xom ashyo bo‘lishi mumkin bo‘lgan uglevodorodlarni olish ham dolzarb vazifadir. Dimetil efirni suyuq uglevodorodlarga katalitik aylantirish ushun katalizator sifatida ishlatiladigan seolitlar keng doiradagi xususiyatlarga ega. Seolit katalizatorlarining kamshiliklari, ularning tez dezaktivlanishi va suyuq uglevodorodlar ushun unumdorligining rastligidir. Shu munosabat bilan, xizmat ko rsatish muddatini ham, faolligini ham oshirish maqsadida yangi katalizatorlarni ʼ ishlab shiqish va mavjudlarini takomillashtirish muhim ahamiyat kasb etmoqda. Tadqiqot ob yekti ʻ sifatida metan, vodorod va uglerod monooksid apalashmasi, metanol, dimetilefir, katalizator, mezog ovakli seolitlar olingan ʼ . Tadqiqotning maqsadi. metandan vodorod va uglerod monooksid aralashmasi orqali metanol va dimetilefir olishning yuqori samarali seolitli katalizatorlarini yaratish hamda dimetilefirni ajratish jarayonlarini o‘rganish, vodorod va uglerod monooksid aralashmasidan dimetil efirni bevosita olish texnologiyasini yaxshilashga imkon beradigan tadbirlarni ishlab chiqishdan iborat . Tadqiqotning vazifalari Mahalliy xomashyolar asosida olingan turli katalitik sistemalar, shu jumladan metanolni ishki molekuluar suvsizlanishi jarayonida vodorod va uglerod monooksid aralashmasidan dimetilefirning bevosita sintezida mahalliy katalizatorlarning xossalarini tadqiq qilish, yuqori faolligi va selektivligi bilan xarakterlanadigan katalizatorning maqbul tarkibini tanlash va metandan vodorod va uglerod monooksid aralashmasi orqali metanol va dimetilefir ishlab chiqarish ko‘rsatkichlariga katalizator tarkibining ta sirini o‘rganish. ʼ
Ilmiy yangiligi mahalliy xomashyolar asosida metandan vodorod va uglerod monooksid aralashmasi orqali metanol va dimetilefirlar sintezi uchun yuqori katalitik faollikka ega bo ‘ lgan Syo* CuO*ZnO*Al 2 O 3 *ZrO 2 / YuKS вa Cr 2 O 3 *ZnO*Al 2 O 3 *B 2 O 3 /YuKS tarkibli uangi bifunksional katalizator olingan va maqbul tarkibi tanlangan . Tadqiqot natijalarining nazariy va amaliy ahamiyati . metanol ishlab chiqarishning amaldagi uskunasida metanol va dimetilefirni birgalikda olish jarayonlari sinovdan o‘tkazilgan hamda texnologiyani takomillashtirish usullari ishlab chiqilgan Ish tuzilmasining tavsifi . Bitiruv malakaviy ishi kirish qismi, adabiyotlar sharhi, asosiy qism, xulosalar va foydalanilgan adabiyotlar sharhidan iborat 3 bob, 49 bet hajmda rasmiylashtirilgan bo lib, 7 ta rasm, 2 ta jadvallar hamda 48 taʻ foydalanilgan adabiyotlar ro‘yxatidan iborat. Chop etilgan ilmiy ishlar: 1 ta xorijiy ilmiy jurnalga maqola hamda 2 ta anjumanga tezis nashrga yuborilgan.
I BOB. ADABIYOTLAR SHARHI 1.1. Vodorod va uglerod monooksid aralashmasini kimyoviy qayta ishlash usullari, istiqbollari va yo‘nalishlari Vodorod va uglerod monooksid aralashmasi qimmatli kimyoviy mahsulotlar, shu jumladan metanol va dimetilefir sintezi uchun dastlabki xomashuo hisoblanadi. Metanol texnologiyasi yaxshi ishlab chiqilgan, uni ishlab chiqarish esa metil spirtini sanoatda keng foydalanilishi bois sezilarli tapqalgan [1, C.23]. 2021 yilda metanolning dunyo bo‘yisha ishlab chiqarilishi 55,3 mln. tonnani tashkil qilgan. Keyingi paytda dimetil efir (DME) olinishi va foydalanish dolzapb bo‘lib bopmoqda, uni ishlab chiqarilishi yoki metanolning ishki molekulyar suvsizlanishiga yoki uni vodorod va uglerod monooksid aralashmasidan bevosita olinishiga asoslangan[2; C. 134-148.]. Vodorod va uglerod monooksid aralashmasi asosida sintez – sanoatda uglevodorod xomashyosini va tabiiy gazni kimyoviy va neft kimyo sanoatining qimmatli mahsulotlarga qayta ishlashning tejamli va keng qo‘llaniladigan usullaridan biridir. Vodorod va uglerod monooksid aralashmasini qayta ishlashning ikki eng muhim jarayonlarini ajratish mumkin: Fisher-Tropsh usuli orqali uglevodorodlar olish va metanolning katalitik sintezi[3; C.27]. 1.2. Metanoldan dimetilefir olish Sintez 1,0 MPa ga yaqin bosim, 290-400 o C haroratda katalizator ishtirokida (alyuminiy oksidi) adiabatik reaktorda o‘tkaziladi. Metanol konversiyasi bitta o‘tishda 80% atpofida tashkil etadi. “Shekinoazot” OAJ da DME ishlab chiqapadigan qurilmaning qayta qurilishi boshlandi, uning takpopiy ishga tyshipilishi 2007 yilning 3 choragiga mo‘ljallangan. Qurilmaning loyihaviy quvvati bir yilda 3 ming tonnani tashkil etadi[4; C. 301-312. ]. C 2 uglevodorodlarning eng yuqori chiqishi oksidlovchi modda sifatida azot gemioksidi va tapkibida 12,5% NaMnO 4 /MgO bo‘lgan katalizatordan foydalanilganda:1073K da CH 4 : H 2 O=1:1 nisbatda erishiladi; etilen chiqishi taxminan 12% ni tashkil etadi. Usul tajriba-sanoat ko‘lamda amalga oshirilgan [5; C. 160-175.]. Biroq metandan etilenni to‘g‘pidan-to‘g‘pi olish jarayoni yuqori
