To'yingan bir atomli spirtlar


![Etilen uglevodorodlariga katalizatorlar ishtirokida suv
biriktirilganda bir atomli spirtlar hosil bo’ladi. Katalizator sifatida
asosan konsentrlangan sulfat kislotadan foydalaniladi. Etilen
uglevodorodlariga suvning birikish quyidagi bosqichlar orqali sodir
bo’ladi:
Spirtlarni aldegid va ketonlarni katalizator ishtirokida qaytarish
orqali yoki ularga magniy organik birikmalar biriktirish orqali olish
mumkin:
Bu jarayon mis, kobalt, nikel, platina. Palladiy katalizatorligida
300-500 0
C haroratda olib boriladi.
Aldegid va ketonlarga magniy organik birikmalarni biriktirish
orqali birlamchi, ikkilamchi yoki uchlamchi spirtlar olinadi. Karbonil
guruhi kuchli qutblangan bo’lganligi uchun ularga nukleofil agentlar
oson birika oladi:
Hosil bo’lgan oraliq modda suv ishtirokida juda oson parchalanadi:
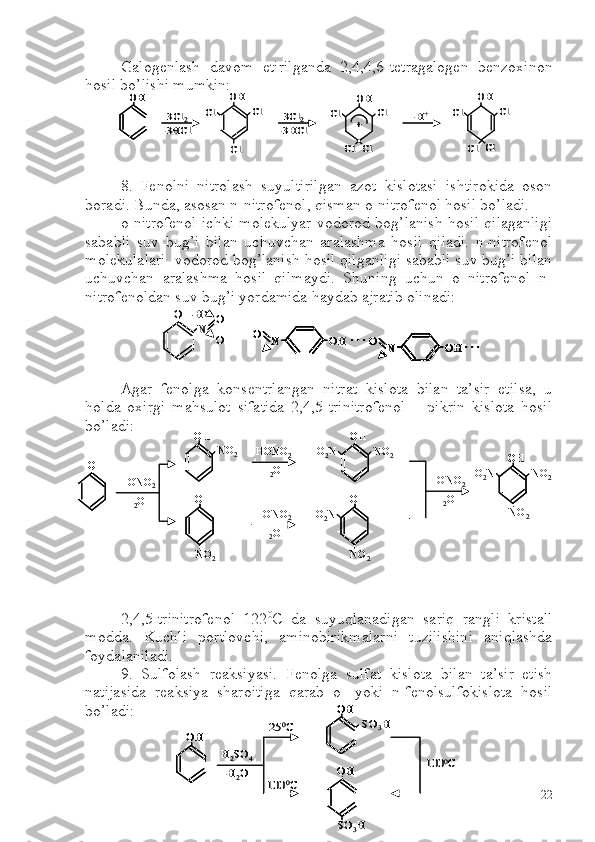
4R –CH = CH 2 + HOH R –CH –CH 3
H2SO 4
OH
R –CH = CH 2+ HOSO 3H R –CH –CH 3
OSO 3H
R –CH –CH 3
OH OSO 3H
HOH R –CH –CH 3+ H 2SO 4
R –CH = CH 2 + HOH R –CH –CH 3
H2SO 4
OH
R –CH = CH 2 + HOH R –CH –CH 3
H2SO 4
OH
R –CH = CH 2+ HOSO 3H R –CH –CH 3
OSO 3H
R –CH = CH 2+ HOSO 3H R –CH –CH 3
OSO 3H
R –CH –CH 3
OH OSO 3H
HOH R –CH –CH 3+ H 2SO 4 R –CH –CH 3
OH OSO 3H
HOH R –CH –CH 3+ H 2SO 4
R –C + [H] R –CH 2OH O
H
R –C –R’ + [H] R –CH –R’
O OH
R –C + [H] R –CH 2OH O
H R –C + [H] R –CH 2OH O
H
O
H
R –C –R’ + [H] R –CH –R’
O OH
R –C –R’ + [H] R –CH –R’
O OH
R –C O
H
+ CH 3MgJ R –C –H
O –MgJ
CH 3
+ - + -
R –C O
H
+ CH 3MgJ R –C –H
O –MgJ
CH 3
+ - + -
R –C –H
O –MgJ
CH 3
HOH R –CH –CH 3+ Mg(OH)J
OH
R –C –H
O –MgJ
CH 3
HOH R –CH –CH 3+ Mg(OH)J
OH](/data/documents/a95635cb-b9dc-47c4-983d-34e8b31a1f32/page_4.png)



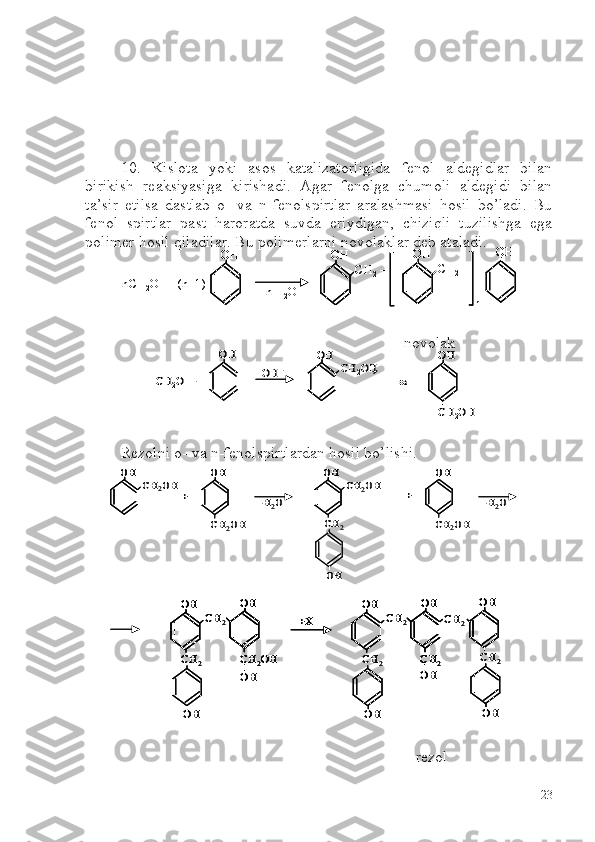
![Spirtlarga galoid vodorod kislotalar, fosforning, oltingugurtlarning
galogenli hosilalari bilan ta’sir etilganda ulardagi gidroksil guruhi
galogenga almashinadi:
Bu jarayon uchlamchi spirtlarda juda osonlik bilan boradi, jarayon
ye
1 -mexanizmiga mos keladi:
Spirtlardagi gidroksil guruhni RCl
5 yoki RCl
3 ta’sirida xlorga
almashtirish jarayoni quyidagi sxema bo’yicha boradi:
Spirtlardagi gidroksil guruhni xlorga almashtirishda eng qulay
ta’sir etuvchi vosita tionilxlorid hisoblanadi:
Bunda hosil bo’ladigan SO
2 va HCl gaz holida ajralib chiqadi,
kerakli mahsulot R – Cl juda osonlik bilan tozalanadi.
Spirtlarning oksidlanishi. Birlamchi spirtlarningkatalizatorlar (mis
birikmalari) ishtirokida 300-500 0
C da oksidlanishi yoki ulardan 100-
180 0
S da mis, kumush, nikel, platina kabi katalizatorlar ishtirokida
vodorodning tortib olish natijasida aldegid, ikkilamchi spirtlardan esa
ketonlar hosil bo’ladi:
Spirtlarning oksidlanish jarayoni murakkab bo’lib, buning
natijasida oksidlanish olib borilayotgan sharoitga qarab oxirgi mahsulot
sifatida turli mahsulotlar hosil bo’lishi mumkin.
8R – OH + HCl R – Cl + H 2O R – OH + HCl R – Cl + H 2O
CH 3 C OH CH 3 C O –H CH 3–C+ CH 3–C –Br
H –Br ..
.. +
CH 3
CH 3
CH 3
CH 3
+ – CH 3
CH 3
CH 3
CH 3
-H2O
+Br –
CH 3 C OH CH 3 C O –H CH 3–C+ CH 3–C –Br
H –Br ..
.. +
CH 3
CH 3
CH 3
CH 3
+ – CH 3
CH 3
CH 3
CH 3
-H2O
+Br –
R –OH + PCl 5 R –Cl + POCl 3+ HCl
3R –OH + PCl 3 3R –Cl + P(OH) 3
R –OH + PCl 5 R –Cl + POCl 3+ HCl R –OH + PCl 5 R –Cl + POCl 3+ HCl
3R –OH + PCl 3 3R –Cl + P(OH) 3 3R –OH + PCl 3 3R –Cl + P(OH) 3
R –OH + SOCl 2 R –Cl + SO 2 + HCl R –OH + SOCl 2 R –Cl + SO 2 + HCl
R –CH 2OH R –C + H 2O [O]
-H2
O
H
R –CH –R’ R –C –R’ + H 2O [O]
-H2 OH O
R –CH 2OH R –C + H 2O [O]
-H2
O
H R –CH 2OH R –C + H 2O [O]
-H2
O
H
O
H
R –CH –R’ R –C –R’ + H 2O [O]
-H2 OH O
R –CH –R’ R –C –R’ + H 2O [O]
-H2 OH O](/data/documents/a95635cb-b9dc-47c4-983d-34e8b31a1f32/page_8.png)


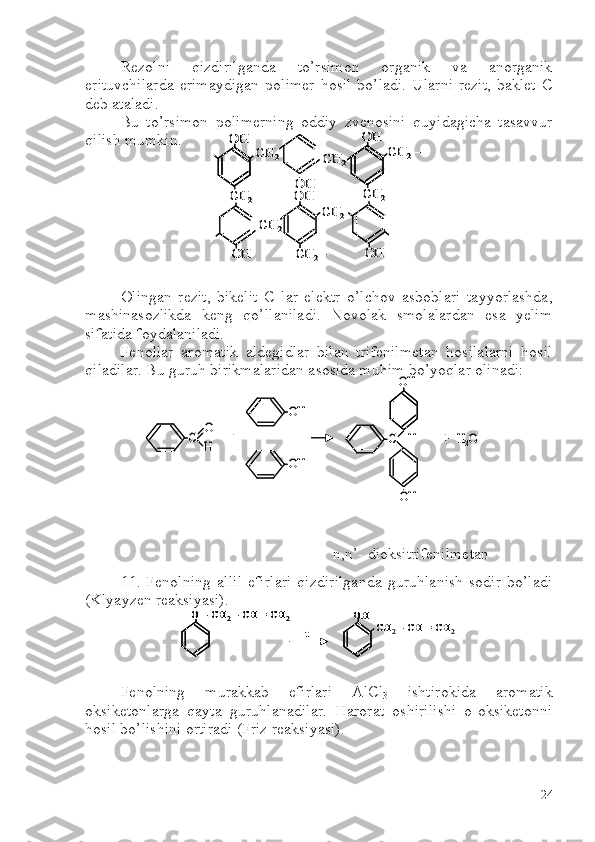
![2. Mineral va organik kislotalar bilan ular to’liq va to’liqmas
efirlarni hosil qiladilar:
S h uningdek spirtlar bilan ham to’liq va to’liqmas oddiy efirlarni
hosil qilishlari mumkin:
Etilsellyulozalar bo’yoqlar, tutamaydigan porox, atsetat ipagi va
boshqalarni olishda erituvchi sifatida ishlatiladi.
3. Glikollarning oksidlanishi natijasida oksialdegid, oksikislota,
dialdegid, aldegidokislota, ikki asosli kislota va boshqalar hosil bo’ladi.
Masalan, etilengilkol oksidlanishi natijasida quyidagi birikmalar hosil
bo’lishi mumkin:
4. Glikollardan suvni tortib olish ichki molekulali yoki
molekulalar-aro borishi mumkin. Bunda oxirgi mahsulot sifatida jarayon
olib borilayotlan sharoitga qarab turli birikmalar hosil bo’ladi:
11CH 2–OH
CH 2–OH
CH 3COOH
2CH 3COOH
CH 2OH –CH 2OCOCH 3+ H 2O
CH 2COOCH 2–CH 2OCOCH 3+ 2H 2O
CH 2–OH
CH 2–OH
CH 3COOH
2CH 3COOH
CH 2OH –CH 2OCOCH 3+ H 2O
CH 2COOCH 2–CH 2OCOCH 3+ 2H 2O
CH 2–OH
CH 2–OH
C2H5OH
2C 2H5OH
CH 2OH –CH 2OC 2H5+ H 2O
C2H5OCH 2–CH 2OC 2H5 + 2H 2O
CH 2–OH
CH 2–OH
C2H5OH
2C 2H5OH
CH 2OH –CH 2OC 2H5+ H 2O
C2H5OCH 2–CH 2OC 2H5 + 2H 2O
CH 2–OH
CH 2–OH
CH 2OH –COOH
OHC –CHO
CHO
CH 2OH
HOOC –COOH
HOOC –CHO
CH 2–OH
CH 2–OH
CH 2OH –COOH
OHC –CHO
CHO
CH 2OH
HOOC –COOH
HOOC –CHO
CH 2OH –CH 2OH [CH 2= CHOH] CH 3CHO
H2O
CH 2–CH 2
O
CH 2OH –CH 2OH [CH 2= CHOH] CH 3CHO
H2O
CH 2–CH 2
O
CH 2–CH 2
O
CH 2OH –CH 2–CH 2OH CH 2= CH –CHOH + H 2O CH 2OH –CH 2–CH 2OH CH 2= CH –CHOH + H 2O
CH 2–CH 2
CH 2 CH 2
OH OH -H2O
CH 2–CH 2
CH 2 CH 2
O
CH 2–CH 2
CH 2 CH 2
OH OH -H2O
CH 2–CH 2
CH 2 CH 2
O](/data/documents/a95635cb-b9dc-47c4-983d-34e8b31a1f32/page_11.png)



![To’yinmagan spirtlarni to’yingan spirtlarni olish usullaridan
foydalanib olinadi. Masalan. allil spirtini sanoatda allilxloridni
gidrolizlash orqali olinadi:
Propargil spirti esa atsetilenga katalizator ishtirokida chumoli
aldegidi biriktirib olinadi:
Bu jarayonni shu bosqichda to’xtatib qolish qiyin. Bu jarayonda
asosiy mahsulot sifatida butindiol hosil bo’ladi.
To’yinmagan spirtlar kimyoviy xossalari jihatdan etilen yoki
atsetilen birikmalarni hamda spirtlarning xossalarini namoyon qiladilar.
Masalan, allil spirti gidroksil guruhi hisobiga oddiy va murakkab efir
hosil qilishi, gidroksil guruhi galogenga almashinishi mumkin.
Qo’shbog’ning hisobiga esa birikish jarayonlariga kirishishi mumkin:
To’yinmagan spirtlar orasida allil va propargil spirtining ahamiyati
katta. Ular sanoatda turli qimmatli birikmalarni olishda xom ashyo
sifatida ishlatiladi.CH
2 = CH –CH 2 OH
CH 2 Br –CH 2 –CH 2 OH
CH
3 –CH 2 OH –CH 2 OH
CH
2 Cl –CH 2 Cl –CH 2 OH
CH2 = CH –CH 2 OH
CH 2 Br –CH 2 –CH 2 OH
CH
3 –CH 2 OH –CH 2 OH
CH
2 Cl –CH 2 Cl –CH 2 OH
СH2 = CH –CH 2 Cl + NaOH CH 2 = CH –CH 2 OH + NaCl СH2 = CH –CH 2 Cl + NaOH CH 2 = CH –CH 2 OH + NaCl
HC CH + CH 2O CH C –CH 2OH
Ag +
HC CH + CH 2O CH C –CH 2OH
Ag +
CH 2= CH –CH 2OH
CH 2= CH –CH 2OR
CH 2= CH –CH 2OCOR
CH 2= CH –CH 2Cl
CH 2= CH –C
O
H
ROH
RCOOH
PCl 5
[O]
CH 2= CH –CH 2OH
CH 2= CH –CH 2OR
CH 2= CH –CH 2OCOR
CH 2= CH –CH 2Cl
CH 2= CH –C
O
H
ROH
RCOOH
PCl 5
[O]
16](/data/documents/a95635cb-b9dc-47c4-983d-34e8b31a1f32/page_16.png)

![4. Fenol va uning gomologlarini birlamchi aromatik aminlardan
diazobirikmalar orqali hosil qilish mumkin:
5. Fenollarni aromatik karbon kislotalarni oksidlovchilar
ishtirokida dekarboksillab hosil qilish mumkin:
Bu jarayonda oraliq modda sifatida salitsil kislota hosil bo’lishligi
aniqlangan.
6. Fenolning gomologlari fenolni bir atomli spirtlar bilan
katalizatorlar ishtirokida alkillab olinadi.
Bunda alkil fenollar bilan ( C -alkillash mahsuloti) birga fenolning
oddiy efirlari (o-alkillash mahsuloti) ham hosil bo’ladi:
Fizikaviy xossalari . Fenol – 43 0
S suyuqlanadigan kristall modda,
suvda qiyin eriydi. Suv bug’i bilan uchuvchi aralashma hosil qiladi.
O’tkir xidga ega. Suv bilan 16 0
S suyuqlanadigan kristall gidrat hosil
qiladi, zaharli. Teriga tegsa kuydiradi.
Kimyoviy xossalari. Fenollar turli kimyoviy jarayonlarga
gidroksil guruhi yoki aromatik halqa vodorodlari hisobidan juda oson
kirisha oladilar.
1. Fenollarni spirtlar yoki suvga qaraganda kislotalik xossasi katta.
Ularning kislotalik xossasi karbonat yoki karbon kislotalarga nisbatan
kuchsiz.
Agar sirka kislotaning dissotsalashish konstantasi 1,8 .
10 –6
,
karbonat kislotaniki 4,9 .
10 –16
bo’lsa, fenolniki 1,3 .
10 –10
ga teng. FenollarOH
+ CH 3– CO – CH 3
OH
+ CH 3– CO – CH 3
NH 2 HNO 3
HCl
N2Cl H2O OH
+ N 2 + HCl
NH 2 HNO 3
HCl
N2Cl H2O OH
+ N 2 + HCl
СО OH +О 2, H 2O
Cu 2+
OH
+ CO 2
СО OH СО OH +О 2, H 2O
Cu 2+
OHOH
+ CO 2
OH +R –OH
ZnCl 2
OH
+ H 2O
R
OHOH +R –OH
ZnCl 2
OH
+ H 2O
R
С6H 5OH + NaOH [C 6H 5O] –Na + + H 2O С6H 5OH + NaOH [C 6H 5O] –Na + + H 2O
19](/data/documents/a95635cb-b9dc-47c4-983d-34e8b31a1f32/page_19.png)
![3. Fenol etilen oksidi bilan polietilenglikolning fenil efirini hosil
qilib birikadi:
Alkil fenollarning etilen oksidi bilan hosil qilgan poliefirlari sirt
aktiv birikmalar sifatida ishlatiladi.
4. Fenollar karbon kislotalar bilan bevosita reaksiyaga
kirishmaydi. Fenolning murakkab efirlarini olish uchun fenolyatlarga
kislota galoid angidiridlari bilan ta’sir ettiriladi:
5. Fenoldagi gidroksil guruhi galogenga almashmaydi. Agar
fenolga fosfor-(III)-xlorid bilan ta’sir etilsa, fosfat kislotaning fenil efiri
hosil bo’ladi.
Agar fenoldagi o- yoki n-holatlardagi vodorodlar elektoakseptor
guruhlar bilan almashgan bo’lsa gidroksil guruh galogen bilan oson
almashinadi:
6. Fenol rux kukuni bilan qo’shib xaydalganda benzol hosil
bo’ladi:
7. Fenolni galogenlanganda n-xlor fenol hosil bo’ladi. Xlorlash
davom ettirilganda trixlorfenol hosil bo’ladi.OH + n CH 2–CH 2
O
H+
O – –CH 2–CH 2–O – –H
n
OH + n CH 2–CH 2
O
CH 2–CH 2
O
H+
O – –CH 2–CH 2–O – –H
n
C 6 H 5 ONa + CH 3 –C C 6 H 5 OCOCH 3 + NaCl
O
Cl
C6 H 5 ONa + CH 3 –C C 6 H 5 OCOCH 3 + NaCl
O
Cl
3C 6H5OH + PCl 3 (C 6H5O) 3P + 3HCl 3C 6H5OH + PCl 3 (C 6H5O) 3P + 3HCl
OH
NO 2 O2N
O N = O
NO 2 O2N
O N = O
HO Cl
NO 2 O2N
O N = O –
HO Cl
Cl
NO 2 O2N
O N = O
+ OH –
Cl –[ PCl 4]+
–
OHOH
NO 2 O2N
O N = OO N = O
NO 2 O2N
O N = OO N = O
HO Cl
NO 2 O2N
O N = O – O N = O –
HO Cl
ClCl
NO 2 O2N
O N = OO N = O
+ OH –
Cl –[ PCl 4]+
–
C6H5OH + Zn C 6H6+ ZnO C6H5OH + Zn C 6H6+ ZnO
21](/data/documents/a95635cb-b9dc-47c4-983d-34e8b31a1f32/page_21.png)
![12. Fenol oksidlovchilar ta’sirida oson oksidlanib turli birikmalarni
hosil qilishi mumkin. Fenolni vodorod peroksid bilan oksidlanganda oz
miqdorda ikki atomli fenol – perekatexin hosil bo’ladi:
Fenolni xrom aralashmasi bilan oksidlanganda esa parabenzoxinon
hosil bo’ladi.
13. Fenolga katalizatorlar ishtirokida vodorod ta’siridan siklo-
geksanol hosil bo’ladi:
Siklogeksanol kapron, neylon kabi su’niy tollalar ishlab
chiqarishda asosiy xom ashyolardan biri bo’lib xizmat qiladi.
Alohida vakillari . Fenol – 181 0
C qaynaydigan, 43 0
C
suyuqlanadigan kristall modda. Suvda 15 0
C da 8% eriydi. Suv bilan
15 0
C suyuqlanadigan gidrat hosil qiladi.
Texnikada fenol toshko’mir qatronidan hamda izopropil benzoldan
olinadi.
Fenol – fenol-formaldegid smolalar olishda, tabobatda dori-
darmonlar ishlab chiqarishda, bo’yoqlar, portlovchi moddalar olishda
ishlatiladi. Fenolning oddiy efirlari dezinfeksiyalovchi moddalar olishda
qo’laniladi.
Ikki atomli fenollar . Ikki atomli fenollar uchta izomer ko’rinishda
mavjud bo’ladilar:
pirokotexin rezorsin gidroxinon
1,2-benzendiol 1,3-benzendiol 1,4-
benzendiol O –CO –R
AlCl 3
OH
CO –R
;
OH
H2O2
OH
OH
O –CO –R O –CO –R
AlCl 3
OHOH
CO –R
;
OHOH
H2O2
OHOH
OH
OH
[O]
O
O
OHOH
[O]
O
O
OH
3H 2
OH
Ni
OHOH
3H 2
OH
Ni
OH
OH
OH
OH
OH
OH
OHOH
OH
OHOH
OH
OHOH
OH
25](/data/documents/a95635cb-b9dc-47c4-983d-34e8b31a1f32/page_25.png)
![Olinish usullari . Ikki atomli fenollarni bir atomli fenollarni olish
usularidan foydalanib hosil qilish mumkin. Ularni
benzoldisulfokislotalarni ishqorlar bilan qo’shib suyultirib,
benzoxinonlarni qaytarib, aminofenollardan foydalanib olish mumkin:
Fizika-kimyoviy xususiyatlari . Ikki atomli fenollar kristall
moddalar bo’lib suvda yaxshi eriydilar.
Kimyoviy jihatdan ular bir atomli spirtlarning xossalarini
takrorlaydilar.
1. Ikki atomli spirtlarning kislotali hususiyati bir atomli
spirtlarnikiga qaraganda kuchli ifodalangan. S h uning uchun ular faqat
ishqorlar bilangina reaksiyaga kirishmay, balki tuzlar bilan ham
reaksiyaga kirisha oladilar:
2. Ikki atomli fenollar elektrofil almashinish reaksiyalariga bir
atomli fenollarga nisbatan oson kirishadilar. OH
NH 2 HNO 2
HCl
OH
N2Cl H2O
OH
OH
+ N 2 + HCl
OHOH
NH 2 HNO 2
HCl
OHOH
N2Cl H2O
OHOH
OH
+ N 2 + HCl
SO 3Na
SO 3Na
4NaOH
ONa
ONa
+ 2NaSO 3 + 2H 2O
SO 3Na SO 3Na
SO 3Na
4NaOH
ONaONa
ONa
+ 2NaSO 3 + 2H 2O
2[H]
O
O
OH
OH
2[H]
O
O
OHOH
OH
OH
OH
+ Pb (CH 3COO) 2
O
O
Pb + 2CH 3COOH
OH
OH
+ Pb (CH 3COO) 2
O
O
Pb + 2CH 3COOH
OH
+ 2HOSO 3H
HO
OH
HO
SO 3H
SO 3H
+ 2H 2O
OH
+ 2HOSO 3H
HO
OH
HO
SO 3H
SO 3H
+ 2H 2O
OH
+ 3HONO 2
OH
OH
OH
NO 2
NO 2
O2N
+ 3H 2O
OH
+ 3HONO 2
OH
OH
OH
NO 2
NO 2
O2N
+ 3H 2O
26](/data/documents/a95635cb-b9dc-47c4-983d-34e8b31a1f32/page_26.png)
![3. Pirokatexin va rezotsin oson oksidlanib 1,2- va 1,4-
benzoxinonni hosil qiladilar:
4. Ikki atomli fenollarda aromatik hususiyat kam namoyon bo’ladi,
shuning uchun ular tautomeriyaga oson uchraydilar. Masalan, rezotsin
qaytarilganda degidrorezotsinni hosil qiladi:
Alohida vakillari . Pirokatexin 104 0
C da suyuqlanadigan, 245 0
C da
qaynaydigan kristall modda. FeCl
3 bilan ko’k rang hosil qiladi. Ko’p
o’simliklar, shuningdek otning peshobida uchraydi. Fotografiyada
ishlatiladi.
Rezotsin 118 0
C da suyuqlanadigan, 276 0
C da qaynaydigan kristall
modda. FeCl
3 bilan siyox rang hosil qiladi. Muhim bo’yoqlar olishda,
shuningdek tabobatda dezinfeksiyalovchi vosita sifatida ishlatiladi.
Gidroxinon 170 0
C da suyuqlanadi. O’simliklar tarkibida arbutin
glukozidi ko’rinishida uchraydi:
Sanoatda gidroxinon n-diazopropilbenzolni oksidlab yoki qaytarib
hosil qilinadi.
Gidroxinon xinonni hosil qiladi. Gidroxinon fotografiyada hamda
monomerlarni polimerlanishidan saqlashda ingibitor sifatida ishlatiladi.
Uning hosilalari yuqori haroratga chidamli polimerlar olishda ishlatiladi.
Uch atomli fenollar. Uch atomli fenollar ham uchta izomer
ko’rinishida mavjud bo’ladilar:
piragallol oksigidroxinon florglitsinOH
OH [O]
O
O
OH
[O]
O
OH O
OH
OH [O]
O
O
OH
[O]
O
OH O
OH
OH
O
O
+2[H]
O
O
OH
OH
OH
OH
O
O
+2[H]
O
O
O –C6H11O5 HO O –C6H11O5 HO
OH
OH
OH
OH
OH
OH
OH
OH HO
OH
OH
OH
OH
OH
OH
OH
OH HO
27](/data/documents/a95635cb-b9dc-47c4-983d-34e8b31a1f32/page_27.png)
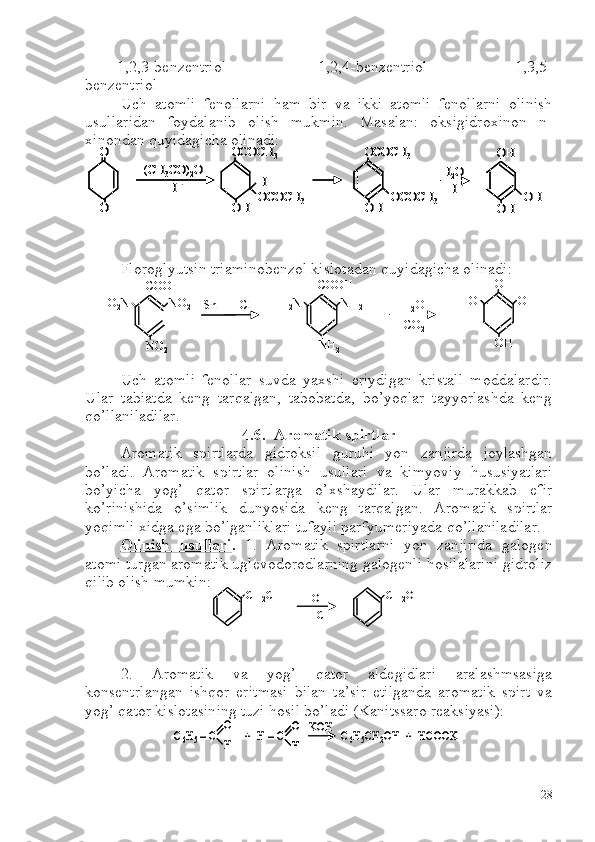
![3. Aromatik spirtlarni tegishli ketonlar, aldegidlar yoki murakkab
efirlarni qaytarib olish mumkin:
4. Aromatik spirtlarni magniy oragink birkmalarga yoki aromatik
uglevodorodlarga organik oksidlar ta’sir ettirib ham olish mumkin:
5. Aromatik yadroga nisbatan -holatda gidroksil guruhini tutgan
spirtlarni aromatik to’yinmagan kislotlar yoki spirtlarni qaytarib olish
mumkin:
Kimyoviy xususiyatlari . Aromatik spirtlar, yuqorida eslatib
o’tganimizdek yog’ qator spirtlarini xossalarini takrorlaydilar. Ular
fenollarga qaraganda neytral birikmalar bo’lib, ishqorlar bilan
reaksiyaga kirishmaydilar. Ishqoriy metallar bilan alkogolyatlarni hosil
qiladilar.
1. Aromatik halqaga nisbatan -holatda gidroksil guruhi tutgan
spirtlar galoid vodorodlar bilan oson reaksiyaga kirishadi va gidroksil
guruhi galogenga almashinadi:
2. Aromatik halqaga nisbatan -holatda gidroksil guruhi tutgan
spirtlar oson suvni yo’qotib, yon zanjirida uglevodorod qoldig’ini tutgan
birikmalarga aylanadilar:
Aromatik spirtlarning kimyoviy hususiyatlarini quyidagi
reaksiyalar yordamida ifodalash mumkin.C6H5–CO –CH 3 C6H5 –CH –CH 3
OH
[H]
C6H5–CHO C6H5 –CH 2OH +H 2
C6H5–CO –CH 3 C6H5 –CH –CH 3
OH
[H] C6H5–CO –CH 3 C6H5 –CH –CH 3
OH
[H]
C6H5–CHO C6H5 –CH 2OH +H 2 C6H5–CHO C6H5 –CH 2OH +H 2
C6H5MgBr + CH 2–CH 2 C6H5CH 2CH 2OMgBr C6H5CH 2CH 2OH HOH
-MgBrOH O
C6H5MgBr + CH 2–CH 2 C6H5CH 2CH 2OMgBr C6H5CH 2CH 2OH HOH
-MgBrOH C6H5MgBr + CH 2–CH 2 C6H5CH 2CH 2OMgBr C6H5CH 2CH 2OH HOH
-MgBrOH O
CH 2–CH 2
O +
CH 2–CH 2OH AlCl 3 CH 2–CH 2
O
CH 2–CH 2
O +
CH 2–CH 2OH AlCl 3
C6H5CH = CH – COOH C6H5CH 2CH 2CH 2OH
[H]
C6H5CH = CH – COOH C6H5CH 2CH 2CH 2OH
[H]
C6H5–CH –CH 3 + HCl C6H5–CH –CH 3 + H 2O
OH OH
C6H5–CH –CH 3 + HCl C6H5–CH –CH 3 + H 2O
OH OH
C6H5–CH 2–CH 2OH C6H5–CH = CH 2 + H 2O t C6H5–CH 2–CH 2OH C6H5–CH = CH 2 + H 2O t
C6H5CH 2OH C6H5CH 2Cl + POCl 3 + HCl
[O]
PCl 5
RCOOH
C6H5CHO C 6H5COOH [O]
C6H5CH 2OCOR + H 2O
C6H5CH 2OH C6H5CH 2Cl + POCl 3 + HCl
[O]
PCl 5
RCOOH
C6H5CHO C 6H5COOH [O]
C6H5CH 2OCOR + H 2O
29](/data/documents/a95635cb-b9dc-47c4-983d-34e8b31a1f32/page_29.png)


O’ZBEKISTON RESPUBLIKASI XALQ TA’LIMI VAZIRLIGI Sharof Rashidov nomidagi Samarqand davlat universiteti KURS ISHI Mavzu: To'yingan bir atomli spirtlar Samarqand 202
Mavzu: To’yingan bir atomli spirtlar Reja: 1. Bir atomli to’yingan spirtlar 2. Ayrim vakillari va ahamiyati 3. To’yinmagan spirtlar 4.Foydalanilgan adabiyotlar 2
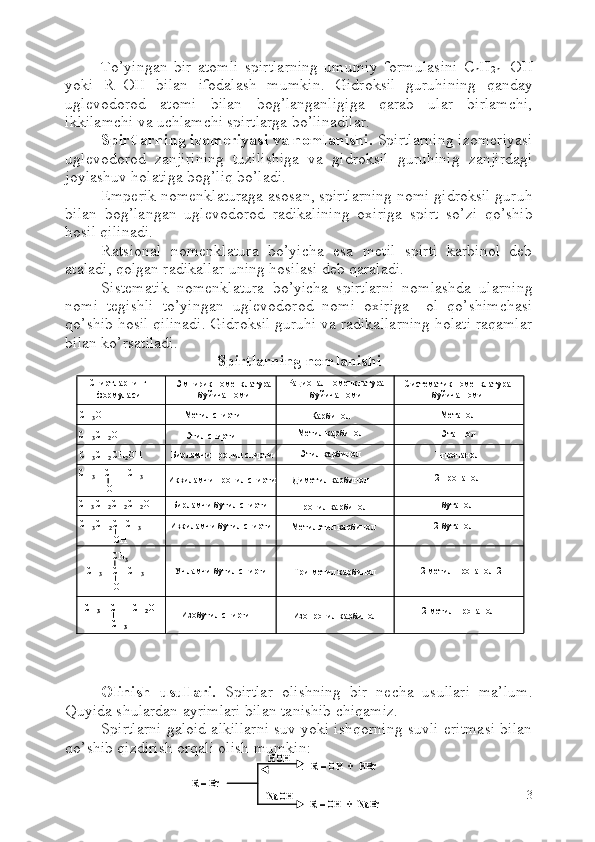
To’yingan bir atomli spirtlarning umumiy formulasini C n H 2n+1 OH yoki R–OH bilan ifodalash mumkin. Gidroksil guruhining qanday uglevodorod atomi bilan bog’langanligiga qarab ular birlamchi, ikkilamchi va uchlamchi spirtlarga bo’linadilar. Spirtlarning izomeriyasi va nomlanishi. Spirtlarning izomeriyasi uglevodorod zanjirining tuzilishiga va gidroksil guruhinig zanjirdagi joylashuv holatiga bog’liq bo’ladi. Emperik nomenklaturaga asosan, spirtlarning nomi gidroksil guruh bilan bog’langan uglevodorod radikalining oxiriga spirt so’zi qo’shib hosil qilinadi. Ratsional nomenklatura bo’yicha esa metil spirti karbinol deb ataladi, qolgan radikallar uning hosilasi deb qaraladi. Sistematik nomenklatura bo’yicha spirtlarni nomlashda ularning nomi tegishli to’yingan uglevodorod nomi oxiriga –ol qo’shimchasi qo’shib hosil qilinadi. Gidroksil guruhi va radikallarning holati raqamlar bilan ko’rsatiladi. Spirtlarning nomlanishi Olinish usullari. Spirtlar olishning bir necha usullari ma’lum. Quyida shulardan ayrimlari bilan tanishib chiqamiz. Spirtlarni galoid alkillarni suv yoki ishqorning suvli eritmasi bilan qo’shib qizdirish orqali olish mumkin: 3Спиртларнинг формуласи Эмпирик номенклатура буйича номи Систематик номенклатура буйича номи СН 3 OH Метил спирти Метанол СН 3 СН 2 OH CH 3 CH 2 CH 2 OH CH 3 – CH – CH 3 OH CH 3 CH 2 CH 2 CH 2 OH CH 3 CH 2 CHCH 3 OH CH 3 – C – CH 3 OHCH 3 CH 3 – CH – CH 2 OH CH 3 Этил спирти Бирламчи пропил спирти Иккиламчи пропил спирти Бирламчи бутил спирти Иккиламчи бутил спирти Учламчи бутил спирти Изобутил спирти Этаннол 1 - пропанол 2 - пропанол 1 - бутанол 2 - бутанол 2 - метил - пропанол - 2 2 - метил - пропанол - 1Рационал номенклатура буйича номи Карбинол Метил карбинол Этил карбинол Диметил карбинол Пропил карбинол Метилэтил карбинол Три метил карбинол Изопропил карбинол Спиртларнинг формуласи Эмпирик номенклатура буйича номи Систематик номенклатура буйича номи СН 3 OH Метил спирти Метанол СН 3 СН 2 OH CH 3 CH 2 CH 2 OH CH 3 – CH – CH 3 OH CH 3 CH 2 CH 2 CH 2 OH CH 3 CH 2 CHCH 3 OH CH 3 – C – CH 3 OHCH 3 CH 3 – CH – CH 2 OH CH 3CH 3 – CH – CH 2 OH CH 3 Этил спирти Бирламчи пропил спирти Иккиламчи пропил спирти Бирламчи бутил спирти Иккиламчи бутил спирти Учламчи бутил спирти Изобутил спирти Этаннол 1 - пропанол 2 - пропанол 1 - бутанол 2 - бутанол 2 - метил - пропанол - 2 2 - метил - пропанол - 1Рационал номенклатура буйича номи Карбинол Метил карбинол Этил карбинол Диметил карбинол Пропил карбинол Метилэтил карбинол Три метил карбинол Изопропил карбинол R –Br HOH NaOH R –OH + HBr R –OH + NaBr R –Br HOH NaOH R –OH + HBr R –OH + NaBr
Etilen uglevodorodlariga katalizatorlar ishtirokida suv biriktirilganda bir atomli spirtlar hosil bo’ladi. Katalizator sifatida asosan konsentrlangan sulfat kislotadan foydalaniladi. Etilen uglevodorodlariga suvning birikish quyidagi bosqichlar orqali sodir bo’ladi: Spirtlarni aldegid va ketonlarni katalizator ishtirokida qaytarish orqali yoki ularga magniy organik birikmalar biriktirish orqali olish mumkin: Bu jarayon mis, kobalt, nikel, platina. Palladiy katalizatorligida 300-500 0 C haroratda olib boriladi. Aldegid va ketonlarga magniy organik birikmalarni biriktirish orqali birlamchi, ikkilamchi yoki uchlamchi spirtlar olinadi. Karbonil guruhi kuchli qutblangan bo’lganligi uchun ularga nukleofil agentlar oson birika oladi: Hosil bo’lgan oraliq modda suv ishtirokida juda oson parchalanadi: 4R –CH = CH 2 + HOH R –CH –CH 3 H2SO 4 OH R –CH = CH 2+ HOSO 3H R –CH –CH 3 OSO 3H R –CH –CH 3 OH OSO 3H HOH R –CH –CH 3+ H 2SO 4 R –CH = CH 2 + HOH R –CH –CH 3 H2SO 4 OH R –CH = CH 2 + HOH R –CH –CH 3 H2SO 4 OH R –CH = CH 2+ HOSO 3H R –CH –CH 3 OSO 3H R –CH = CH 2+ HOSO 3H R –CH –CH 3 OSO 3H R –CH –CH 3 OH OSO 3H HOH R –CH –CH 3+ H 2SO 4 R –CH –CH 3 OH OSO 3H HOH R –CH –CH 3+ H 2SO 4 R –C + [H] R –CH 2OH O H R –C –R’ + [H] R –CH –R’ O OH R –C + [H] R –CH 2OH O H R –C + [H] R –CH 2OH O H O H R –C –R’ + [H] R –CH –R’ O OH R –C –R’ + [H] R –CH –R’ O OH R –C O H + CH 3MgJ R –C –H O –MgJ CH 3 + - + - R –C O H + CH 3MgJ R –C –H O –MgJ CH 3 + - + - R –C –H O –MgJ CH 3 HOH R –CH –CH 3+ Mg(OH)J OH R –C –H O –MgJ CH 3 HOH R –CH –CH 3+ Mg(OH)J OH
Bu usul bilan spirtlarni tuzilishini oldindan belgilangan holda sintez qilish mumkin. Sanoatda etil spirtini pentazan saqlovchi tabiiy birikmalar – uglevodlarni fermentlar ishtirokida bijg’itish orqali olinadi. Masalan: Bijg’itishni 4 % li sulfat kislota ishtirokida ham olib borish mumkin. Shu usul bilan g’o’zapoya, yog’och chiqindilari, oziq-ovqat chiqindilari va boshqalardan ko’p miqdorda etil spirti ishlab chiqariladi. Metil spirti sanoatda C O va H 2 dan sintez qilinadi: Bu jarayon 200-300 atm bosim, 400 0 C harorat va rux-xrom-mis katalizatori ishtirokida olib boriladi. Spirtlarni yuqorida ko’rsatilgan usullarda tashqari, yana murakkab efirlardan atsetallardan va boshqa birikmalardan olish mumkin. Spirtlarning fizik xossalari. Spirtlarning C 10 gacha bo’lganlari suyuqlik va undan yuqorilari qattiq moddalardir. Dastlabki vakillari suv bilan istalgan nisbatta aralashadi. O’ziga xos xidga ega. Ularning molekulyar massalari ortib borishi bilan suvda eruvchanligi kamayib hidi yoqimsiz bo’lib boradi, qaynash harorati ham ortib boradi. Normal tuzilishga ega bo’lgan spirtlar izomerlariga qaraganda yuqori haroratda qaynaydilar. Spirtlar vodorod bog’lanishi hosil qilagnligi sababli yuqori haroratda qaynaydilar: Spirtlar orasida metil spirti o’ta zaharli hisoblanadi, uning 10 ml inson ko’rish qobilyatini yo’qotishiga, 30 ml esa o’limiga sabab bo’ladi. 5C6H 12O 6 2C 2H 5OH + 2CO 2 фермент C6H 12O 6 2C 2H 5OH + 2CO 2 фермент СО + 2 H 2 CH 3OH СО + 2 H 2 CH 3OH : CH 3 O –H .. . . . CH 3 O –H :.. . . . O –H :.. CH 3 : CH 3 O –H .. . . . CH 3 O –H :.. . . . O –H :.. CH 3 CH 3 O –H .. . . . CH 3 O –H :.. . . . O –H :..O –H :.. CH 3
