Elektroliz jarayonlari



















Elektroliz jarayonlari.
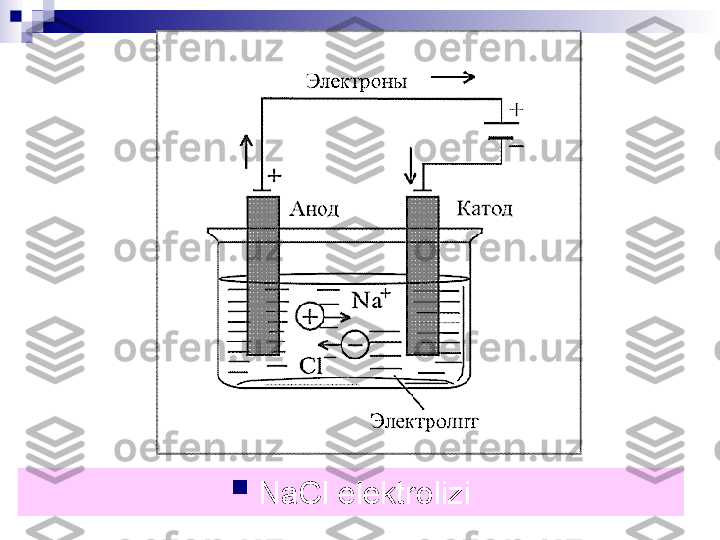
Elek t rolizning qo‘llanilishi 1. Elektrolizdan foydalanib, ishqoriy va ishqoriy yer metallari hamda ayrim aktiv metallar ularning birikmalaridan ajratib olinadi. Misol, 2NaCl (suyuq) 2Na(katod) + Cl 2 (anod) 2. Elektrolizdan foydalanib, gazlar, ayrim kislotalar va boshqa moddalarni ajratib olish mumkin. Masalan, 2H 2 0== 2H 2 (katod) + 0 2 (anod) 3. Metallarni ustki qismini boshqa metallar bilan qoplashda elektrolizdan foydalaniladi. 4. Elektroliz sanoatda nihoyatda katta ahmiyatga ega. Usiz hozirgi kimyo sanoatining juda ko‘p sohalarini tasavvur qilib bo‘lmaydi.
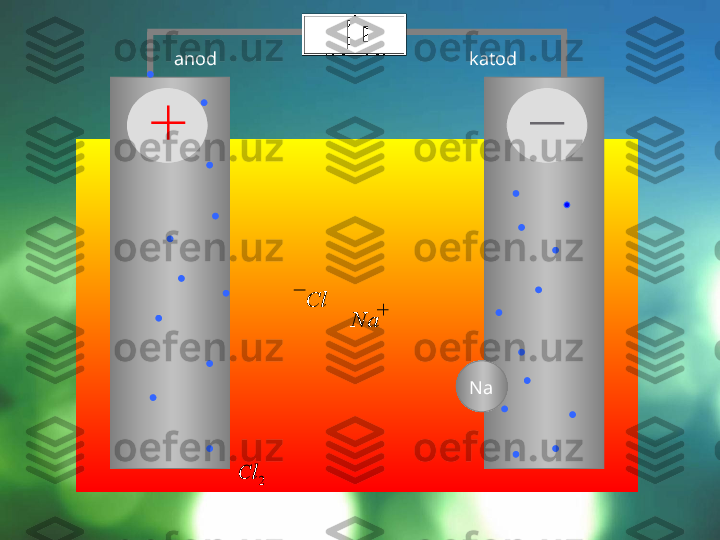
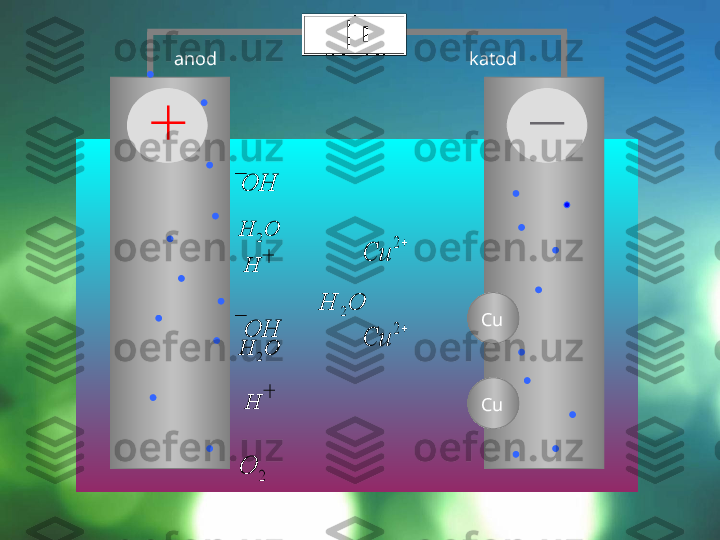
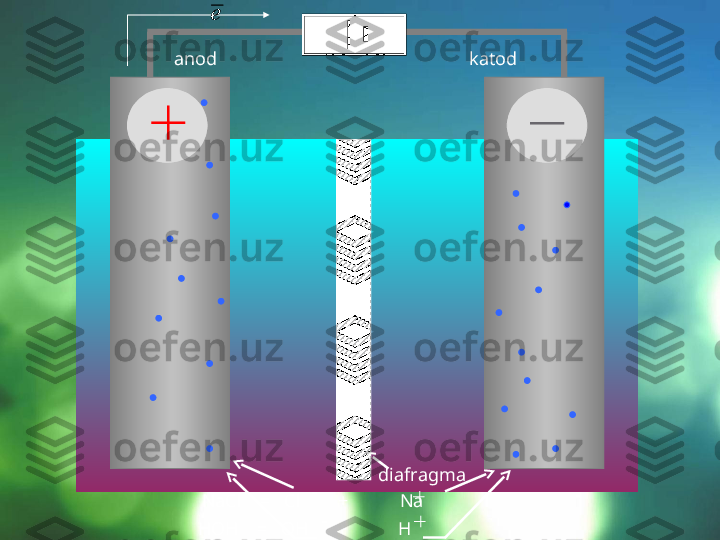
Elektroliz jarayoni maxsus qurilmalar – elektrolizerlar yoki elektrolitik vannalarda olib boriladi. Agar elektrolitning suvdagi eritmasiga o'zgarmas tok manbaiga ulangan elektrod tushirilsa, eritmada tartibsiz harakatda bo'lgan ionlar bir tomonga yo'naladi: kationlar katodga, anionlar esa anodga tomon yo'naladi. Elektr toki manbaining ishlashi natijasida elektronlar anoddan katodga uzatiladi, shu sababli anodda elektronlar yetishmay qoladi, katodda esa ko'payib ketadi. Elektronlar katoddan musbat zaryadlangan ionlarga o'tadi va ularni neytral atomlarga aylantiriladi. Manfiy zaryadlangan ionlar anodga kelib unga o'z elektronlarini beradi va o'zi zaryadsizlanadi. Shunday qilib, elektrolizning mohiyati shundaki, katodda qaytarilish anodda esa oksidlanish jarayoni boradi. 3 2 1 1
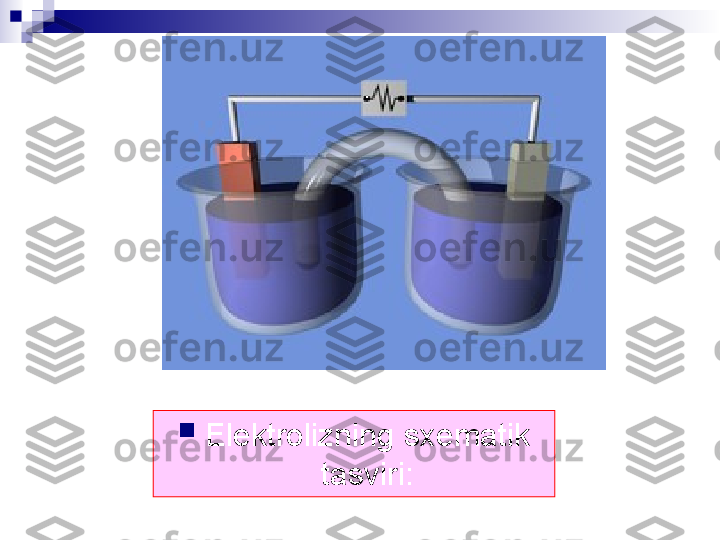
Elektrolizning sxematik tasviri:
