Elementlar davriy sistemasining o’n to’rtinchi gurux elementlarining xossalari. Elementlar davriy sistemasining o’n beshinchi gurux elementlarining xossalari.










![Fr ео nl а r. Ugl е r о dning g а l о g е nli h о sil а l а rid а n CF
4 bil а n CCl
4 а m а liy
а h а mitg а eg а . Ugl е r о d IV-ft о rid CF
4 g а z bo’lib, -128 о C
d а q а yn а ydi, -184 о C
d а
q о t а di. Jud а in е rt m о dd а bo’lib, o’zi v а uning х l о rli h о Cil а l а ri fr ео nl а r n о mi bil а n
m а ’lum. Bul а r s о vitish t ех nik а sid а qo’ll а nil а di.
Fr ео n - 12 d е b а t а luvchi dift о rdi х l о rm е t а n -CF
2 Cl
2 s о vitish m а shin а sining
ishchi suyuqligi ( х l а d оа g е nt) his о bl а n а di. Fr ое nl а r jud а b а rq а r о r m о dd а l а r bo’lib
gidr о lizl а nm а ydi, shu s а b а bli m е t а ll а rni k о rr о ziyag а uchr а tm а ydi. Ul а r
ins е kt о fungitsidl а rd а n а er о z о ll а r t а yyorl а shd а erituvchi v а ft о rli h о sil а l а r о lishd а
о r а liq m о dd а sif а tid а qo’ll а nil а di. K е ng t а rq а lg а n fr ео n-12 ugl е r о d IV- х l о rid CCl
4
bil а n NG’ d а n о lin а di (k а t а liz а t о r sif а tid а SvF
5 ishl а til а di):
CCl
4 + 2HF [SvF]
= 2HCl + CF
2 Cl
2
F о sg е n - COCl
2 . K а rb о n а t kislоtаning di х l о r а ngidridi, qo’ng’ir g а z, - 118 о
C
d а q о t а di, 8,2 о
C d а q а yn а ydi. d = 1,420. Suvd а yom о n, о rg а nik erituvchil а rd а
ya х shi eriydi. Uni ugl е r о d о ksid bil а n х l о rd а n а ktivl а ng а n ko’mir ishtir о ki d а
о lin а di. F о sg е n b а ’zi eritm а l а r (m а s а l а n, dietilk а rb о n а t), dif е nilm е t а n q а t о ri
boyoql а ri, d а v о l а sh pr е p а r а tl а ri p о lik а rb о n а t l а r v а bоshqа m о dd а l а r о lishd а
ishltil а di. U o’t а z а h а rli m о dd а . Birinchi j а h о n urushi yill а rid а (1914-1918)
z а h а rl о vchi m о dd а sif а ti d а qo’ll а nilg а n. Pr о tiv о g а z о rq а li und а n s а ql а nish
mumkin.](/data/documents/4e091ff6-052b-4cee-8f26-a3805c940692/page_12.png)

![1,4-ditsi а nbut е n - 2 - NCH
2 CH = CHCH
2 CN h а m ditsi а n h о sil а l а rid а n
bo’lib, а dip о dinitril о lishd а ishl а til а di.
Si а nid kislоtа HCN . R а ngsiz, е ngil, uchuvch а n suyuqlik, 26,5 о
C d а
q а yn а ydi, а chchiq b о d о m hidig а eg а . Eng kuchli z а h а rli m о dd а l а rd а n biri. Suvli
eritm а sid а kuchsiz kislоtа х ususiyatl а rini n а m о yon qil а di (K=2,1 .
10 -9
).
Suvsiz suyuq si а nid kislоtа kuchli i о nl о vchi erituvchi bo’lib, und а erig а n
el е ktr о litl а r i о nl а rg а diss о tsil а n а di. Si а nid kislоtа ikki hil ko’rinishg а eg а bo’lib,
t а ut о m е r muv о z а n а td а bo’l а di:
H - C = N: H - N = C:
S а n оа td а si а nid kislоtа quyid а gi k а t а litik r еа ksiyal а r bil а n о lin а di:
CO + NH
3 GeO , 600 C
= HCN + H
2 O
2CH
4 + 3O
2 + 2NH
3 Pt,1000 C
= 2 HCN + 6 H
2 O
Si а nid kislоtа qishl о q х o’j а ligid а , b а ’zi sint е zl а rd а v а k о mpl е ks birikm а l а r
о lishd а ishl а til а di.
HCN tuzl а ri si а nidl а r d е yil а di. Bul а rd а n RCN, NaCN а m а liy
а h а miyatg а eg а . Ul а r suvd а ya х shi eriydig а n z а h а rli m о dd а l а rd а n his о bl а n а di.
S а n оа td а m е t а ll а rning а midl а rini yuq о ri t е mp е r а tur а d а ko’mir bil а n qizdirib
о lin а di. Tuz sif а tid а suvd а gidr о lizl а n а di:
CN -
+ H
2 O = HCN + OH -
Tuzl а rning eritm а l а ri ishq о riy r еа ksiyag а eg а bo’lib si а nid kislоtа hidig а eg а
bo’l а di.KCN bil а n NaCN kislоrоd ishtir о kid а о ltin v а kumushni eritishg а q о dirligi
s а b а bli bu m е t а ll а rni rud а l а rd а n а jr а tib о lishd а qo’ll а nil а di. Bu tuzl а r о rg а nik
sint е zl а rd а , g а lv а n о pl а stik а v а g а lv а n о st е giyad а ishl а til а di.
T а rkibid а si а n guruhi b о r k о mpl е ksl а r h а m а nch а gin а uchr а ydi.
K
4 [Fe(CN)
6 ], Fe(CN)
4 .
4KCN, K
3 [Fe (CN)
6 ] shul а r juml а sig а kir а di.
R о d а nid kislоtа – HSCN - ti о si а n а t kislоtа d е b h а m а t а l а di. U ikki izomer
h о lid а bo’l а di:
H - S - C = N H - N = C = S
ti о si а n а t iz о ti о si а n а t
kislоtа kislоtа
U m о ysim о n, uchuvch а n o’tkir hidli suyuqlik, о s о ngin а p а rch а l а n а di.
R о d а nid kislоtаning suvli eritm а si kuchli kislоtа bo’lib, K=0,14, shu s а b а bli
ishq о riy m е t а ll а rning tuzl а ri bo’lg а n r о d а nid l а r gidr о lizg а uchr а m а ydi. R о d а nid
kislоtаning а lkil h о sill а l а ri m а ’lum, uning o’zi ti о si а n а tl а r о lishd а qo’ll а nil а di.
R о d а nid kislоtа tuzl а ri (r о d а nidl а r) krist а ll а r bo’lib, ko’p l а ri suvd а , spirt,
efir v а а s е t о nd а eriydi. Suvd а gi eritm а l а rid а kislоrоd bil а n sulf а tl а r v а HCN
g а ch а о ksidl а n а di, х l о r v а br о m bil а n birikib,si а ng а l о g е nli h о Cil а l а r b е r а di.](/data/documents/4e091ff6-052b-4cee-8f26-a3805c940692/page_15.png)

![О ltingugurt v а а z о t bil а n (600-1000 о
S d а ) h а m birik а di. B о r bil а n SiD
4 v а SiB
6
k а bi birikm а l а ri m а ’lum.
Kr е mniy v о d о r о d ft о rid bil а n nitr а t kisl о t а l а r а rl а shm а sid а , ishq о r v а ko’pgin а
m е t а ll а rning suyuql а ntirilg а n eritm а l а rid а eriy di. Ishq о rl а r kr е mniy bil а n
r еа k ц iyag а kirishib, v о d о r о d v а silik а t kisl о t а tuzl а rini h о sil qil а di:
Si + 2KOH + H
2 O = K
2 SiO
3 + 2H
2
Si + 2NaOH + H
2 O = Na
2 SiO
3 + 2H
2
Kr е mniyning ko’pgin а m е t а ll а r bil а n h о sil qilg а n sili ц idl а ri Mq
2 Si, FeSi, Cr
3 Si v а
h.k.) qiyin eriydig а n, el е ktr t о kini o’tk а zuvchi m а t е ri а ll а rd а n his о bl а n а di. Bul а r
хо ss а l а ri jih а td а n int е rm е t а ll birikm а l а rni esl а t а di.
Kv а r ц ning tuzilishi v а хо ss а l а ri. Kv а r ц krist а ll h о ld а gi kr е mniy di о ksidd а n
ib о r а t bo’lib, t а bi а td а uchr а ydi. Kv а r ц ning ti niq, r а ngsiz krist а ll а ri о lti qirr а li
pir а mid а d а j о yl а shg а n о lti qirr а li prizm а sh а klig а eg а bo’lib, t о g’ billuri d е yil а di.
А r а l а sh m а l а r t а ’sirid а bin а fsh а r а ngg а bo’yalg а n t о g’ billuri а m е tist, qo’ng’ir
r а nglisi tutunsim о n t о p а z d е b n о m о lg а n. Kv а r ц ko’rinishl а ri d а n biri ch а qm о q -
t о shdir. M а yd а krist а ll h о ld а gi а g а t v а yashm а h а m k е ng t а rq а lg а n. Kv а r ц
ko’pgin а mur а kk а b t о g’jinsl а ri (gr а nit, gn е ys) t а rkibig а kir а di. О ddiy qum
kv а r ц ning m а yd а qismch а l а ridir.
Kv а r ц о ddiy sh а r о itd а suvd а d е yarli erim а ydi, l е kin b о sim о s tid а qizdirilg а n suvd а
100 о
S d а n yuq о rid а eriydi. M а n а shu usuld а n f о yd а l а nib, sun’iy kv а r ц ning yirik
m о n о krist а ll а ri (Z0 sm v а un d а n yuq о ri) o’stiril а di. Kv а r ц kisl о t а l а rd а erim а ydi,
bund а n f а q а t v о d о r о d ft о rid must а sn о dir. Kv а r ц bil а n N А birikk а nd а quyid а gich а
r еа k ц iya b о r а di:
4HF + SiO
2 = SiF
4 + 2H
2 O
SiF
4 + 2HF = H
2 [SiF
6 ]
Kv а r ц ishq о rl а r bil а n r еа k ц iyag а kirishib silik а tl а r h о sil qi l а di. Bund а y m о dd а l а r
kv а r ц bil а n m е t а ll о ksidl а rini а r а l а shtirib qizdirilg а nd а h а m h о sil bo’l а di.
Kv а r ц t о z а kr е mniy, kv а r ц shish а , silik а l ьц it а br а ziv m а t е ri а ll а ri, qimm а tb а h о
t о shl а r t а yyorl а shd а хо m а shyodir.
Kv а r ц shish а . Kv а r ц shish а ul ь tr а bin а fsh а nurl а rni o’tk а z а di, yuq о ri t е mp е r а tur а
t а ’sirig а chid а mli. Uning t е rmik k е ng а yish k о ef fi ц i е nti jud а kichik bo’lib,
isit а lg а nd а yoki s о vitilg а nd а h а jmi o’zg а rm а ydi. Kv а r ц shish а ni 1500 о
S g а ch а
qizdirib turib, s о vuq suvg а tushirilg а nd а h а m ung а h е ch n а rs а qilm а ydi.
V а h о l а nki, о ddiy shish а d а n yas а lg а n turli buyuml а r s а l qizib turg а nd а suv
t о mchil а rid а n d а rz k е t а di. Kv а r ц shish а kimyo s а n оа tid а , l а b о r а t о riya а sb о bl а rini
yas а shd а , o’tg а v а kuchli r еа g е ntl а rg а chid а mli idishl а r, trub а v а r е а kt о rl а r
t а yyorl а shd а qo’ll а nil а di. M е di ц in а , kin о , ilmiy ishl а r v а b о shq а q а t о r s о h а l а rd а
k е ng qo’ll а nil а dig а n sim о b l а mp а l а ri h а m kv а r ц shish а d а n t а yyorl а n а di.](/data/documents/4e091ff6-052b-4cee-8f26-a3805c940692/page_17.png)

![Sit а ll а r. Bir guruh о liml а r s а n оа t miqyosid а m е t а llurgiya s а n оа ti t а shl а ndiql а ri
his о bl а ng а n shl а kd а n а j о yib хо ss а l а rni o’zid а muj а ss а ml а shtirg а n yangi m а t е ri а l -
sit а llni yar а tdi. Qism а n kris t а ll а ng а n shish а sim о n f а z о d а n ib о r а t sit а ll jud а yuq о ri
m еха nik pi shiqlik v а kimyoviy chid а mlilikk а eg а dir. T ех nik а d а sit а ll а r pir о k е r а m,
d е vitr о k е r а m n о mi bil а n h а m m а ’lum. Mikr о krist а ll а r k а t t а ligi 1 mkm d а n kichik
bo’l а di. Li
2 O - Al
2 O
3 - SiO
2 а s о sid а t а yyorl а ng а n sit а ll а r о ptik tiniq bo’l а di. MqO-
Al
2 O
3 -SiO
2 а s о sid а gi r а di о tiniqlikk а , Cs
2 O - Al
2 O
3 - SiO
2 а s о sid а gisi es а issiqlikk а
chid а mli bo’lib, eritilg а n m е t а ll а rg а nisb а t а n in е rt r а di ац iya t а ’sirig b е f а rq
bo’l а di.
.
Sit а ll а rd а n trub о pr о v о dl а r, kimyoviy r еа kt о rl а r, n а s о s d е t а ll а ri, fil ье r а l а r,
t е l е sk о pl а r uchun а str о ko’zgul а r, el е ktr о liz v а nn а l а ri uchun fut е r о vk а m а t е ri а ll а ri,
el е ktriz о lyat о rl а r, а nti k о rr о zi о n qurilish k о nstruk ц iyal а ri v а b о shq а l а r
t а yyorl а n а di. F о t о sit а ll а r es а mikr о m о d е l plit а l а ri, m а tbu о t s хе m а l а ri p а n е ll а ri v а
f о t о el е ktr о n ko’p а ytirgichl а r t а yyorl а shd а ishl а til а di.
Цео litl а r. Umumiy f о rm а l а si M
2/n O .
Al
2 O
3 .
XSiO
2 .
y H
2 O bo’lg а n
а lyum о silik а tl а r bo’lib, M - ishq о riy yoki ishq о riy- е r m е t а ll, n-uning о ksidl а nish
d а r а j а si. О ddiy sh а r о itd а bir х il tuzilishi bo’sh liql а ri suv m о l е kul а l а ri bil а nto’lg а n
bo’l а di. Suv bo’shliql а rd а n chiq а rilib, yan а to’ldirilishi mumkin.
Цео litl а r b о shq а m о dd а l а rni yutish ( а ds о rb ц iyal а sh) х ususiyatig а eg а . Bul а rning
b а ’zil а ri eritm а l а rd а gi i о nl а rni o’z t а rkibid а gi i о nl а rning ekviv а l е nt miqd о rig а
а lm а shtirish х ususiyatig а eg а bo’l а di. Цео litl а r turli k а tt а likd а gi m о l е kul а l а rni
а jr а tish х ususiya tig а eg а ligi tuf а yli m о l е kulyar el а kl а r sif а tid а qo’ll а nil а di. Mu-
him цео litl а rd а n biri n а tr о lit - Na
2 [Al
2 Si
3 O
10 ] .
2H
2 O bo’lib, s а n оа t v а ха lq
х o’j а ligining k е ng s о h а l а rid а ishl а til а di.
Sint е tik цео litl а r о lish m а qs а did а n а triy silik а t v а а lyumin а t а r а l а shm а si 80-100 о
S
d а krist а ll а n а di. Krist а litg а 15-20 % yopishq о q l о y qo’shil а di v а di а m е tri 2-4
mm bo’lg а n цео litd о n а l а ri t а yyorl а n а di. K а ti о n а lm а shinishi n а tij а sid а (CaCl
2
eritm а sid а ) n а t riy f о rm а sid а n k а l ьц iy f о rm а sig а o’tishi mumkin bo’l а di. P е rmutit
n о mli а lyum о silik а tl а r bug’ q о z о nl а rid а ishl а til а dig а n suvni yumsh а tish
m а qs а did а qo’ll а nil а di (suvd а gi k а l ьц iy o’rnini n а triy eg а l l а ydi):
2Na [AlSi
2 O
6 ] + Ca 2+
= Ca [AlSi
2 O
6 ]+2Na +
H о sil bo’lg а n k а l ьц iyli p е rmutitni NaCl eritm а sig а tushirs а k, u q а yt а d а n o’zining
d а stl а bki n а triyli f о rm а sig а o’t а di:
Ca [AlSi
2 O
6 ] + 2NaCl = 2Na[AlSi
2 O
6 ] + CaCl
2
Цео litl а rg а i о n а lm а shtirgichl а r d е bq а r а sh mumkin. О ddiy цео litl а rd а SiO
2 ning
Al
2 O
3 g а m о l ь nisb а ti 1 d а n 2 g а ch а bo’l а di. Bu nisb а t kisl о t а l а rg а chid а mli
цео litl а rd а (eri о nit, m о rd е nit, klin о ptil о litd а ) 6 d а n 10 g а ch а bo’l а di. Цео litl а r
m о dd а l а rni qu ritishd а , а r а l а shm а l а rni а j а rtish, i о n а l а shtirgichl а r, k а t а liz а t о r
sif а tid а qo’ll а nil а di.](/data/documents/4e091ff6-052b-4cee-8f26-a3805c940692/page_19.png)


![Kr е mniy о rg а nik p о lim е rl а rning ko’pl а ri о chiq а l а ng а d а yonm а ydi. Ul а rd а n o’t
o’chiruvchi l а r, m е t а llurgl а r, kimyo s а n оа ti хо diml а ri uchun kiyim-k е ch а kl а r,
k а b е ll а r, el е ktr о g е n е r а t о rl а r, tr а nsf о rm а t о r v а el е ktr о t ех nik а а sb о b-uskun а l а rini
t а yyorl а shd а muv а ff а qiyat bil а n f о yd а l а nilm о qd а . Kr е mniy о rg а nik birikm а l а r
bil а n q о pl а ng а n m е t а ll z а ngl а m а y, uning х izm а t d а vri bir n е ch а o’n b а r а v а r о rt а di.
Kr е mniy о rg а nik birikm а l а r а s о sid а yar а tilg а n l а kl а r jud а yuq о ri t е mp е r а tur а t а ’ -
sirig а chid а mli bo’lib о b-h а v о o’zg а rishl а ri, n а mlik v а turli r еа g е ntl а rg а b а rd о sh
b е r а о l а di.
Kr е mniy о rg а nik birikm а l а r m е di ц in а v а f а rm аце vtik а d а ko’pl а b qo’ll а nil а
b о shl а ndi. Ul а rd а n yas а lg а n tish pr о t е zl а ri n а m t о rtm а ydi v а о vq а t yuql а rini
tutm а ydi.
Kr е mniy о rg а nik birikm а l а r eng qimm а tli yarim o’tk а zgich bo’lg а ni s а b а bli
r а di о t ех nik а s а n оа tid а h а m k е ng ishl а til а di. Gugurt qutich а sid е k
k е l а dig а ncho’nt а k r а di о priyomnikl а rid а n t о rtib, k о smik k е m а l а rd а
qo’ll а nil а yotg а n r а di о priyomnikl а rd а h а m а n а shu yarim o’t k а zgichl а rd а n
f о yd а l а nilm о qd а .
Kr е mniy о rg а nik birikm а l а rni (ul а r p о lim е r о rg а n о sil о ks а nl а r d е b h а m а t а l а di)
yar а tish v а ul а rd а n а m а ld а f о yd а l а nishd а а k а d е mik K. А . А ndri а n о v b о shliq bir
GURU Х о liml а r ishi а h а miyatli bo’ldi.
Kr е mniyning g а l о g е nli birikm а l а ri . Kr е mniy g а l о g е nl а r bil а n о s о n r еа k ц iyag а
kirish а di. Kr е mniy g а l о g е nidl а rd а n SiCl
4 bil а n SiF
4 muhim а h а miyatg а eg а . SiCl
4
quyid а gi r еа k ц iyal а r а s о sid а о lin а di:
а ) 2FeSi+Cl
2 180-200 C
2SiCl
4 + 2 FeCl
3 Ushbu r еа k ц iyad а Si
2 Cl
6 v а Si
3 H
8 l а r h а m
h о sil bo’l а di. b)
SiO
2 +2Cl
2 +2C = SiCl
4 +2CO
SiCl
4 -57 о
S d а q а yn а b, - 68 о
S d а q о t а dig а n r а ngsiz suyuqlik, zichligi - 1,52Z7
(0 о
S). Suvd а t е z gidr о lizl а n а di:
SiCl
4 +3H
2 O = SiO
2 x H
2 O+4 HCl
а s о s а n kr е mniy о rg а nik birikm а l а r sint е zid а qo’ll а nil а di.
SiF
4 - flyu о rit H
2 SO
4 bil а n kr е mniy di о ksidning o’z а r о t а ’sirid а n о lin а di:
SiO
2 + CaF
2 + 2H
2 SO
4 = SiF
4 + 2CaSO
4 + 2H
2 O
SiF
4 o’tkir hidli r а ngsiz g а z bo’lib, suvd а gidr о lizl а n а di. Spirt v а аце t о nd а eriydi.
Ft о rsilik а tl а rni t е rmik p а rch а l а b о lin а di. SiF
4 - g е ks а ft о rsilik а t kisl о t а H
2 [SiF
6 ] v а
а n о rg а nik ft о ridl а r о lishd а хо m а shyodir.
G е ks а ft о rsilik а t kisl о t а SiF
4 gidr о lizid а n h о sil bo’l а di. Bu kisl о t а erkin h о ld а
turg а nd а NG’ bil а n SiF
4 g а p а rch а l а n а di. Suv li eritm а sid а b а rq а r о r, ikki n е gizli
kuchli kisl о t а l а rd а n his о b l а n а di (0,IH eritm а ning diss оц il а nish d а r а j а si 76,0 % g а
t е ng). SiF
6 2-
- о kt а edrik tuzilishg а (sp 3
d 2
- gibridl а nishg а ) eg а .](/data/documents/4e091ff6-052b-4cee-8f26-a3805c940692/page_22.png)


![Хо ss а l а ri . G е rm а niy m е t а ll yaltir о qligig а eg а mo’rt m о dd а . Q а l а y bil а n
qo’rg’ о shin es а о s о n suyuql а nuvch а n yumsh о q m е t а ll а rdir. Qo’rg’ о shin z а ng о ri
bo’lib t о vl а n а di, q а l а y о q v а kulr а ng bo’l а di. О q r а ngli q а l а y о lm о s k а bi tuzilishg а
eg а , kulr а ng q а l а y es а 13,2 о
C d а n p а st b а rq а r о r bo’lib, yarim o’tk а zgichlik
хо ss а sini n а m о yon qil а di. Kulr а ng q а l а y о q r а ngligid а n f а rq qilib q а ttiq v а
mo’rtdir. Q а l а yning uchinchi sh а kli 161 о
C d а n yuq о rid а m а vjud bo’l а di.
Suyuql а n tirilg а n q а l а y s о vutil а yotg а nd а m е t а llning silliq yuz а si m а ’lum bir p а ytd а
х ir а l а shib q о lishi uning sh а kl o’zg а rishig а хо s b е lgisi dir. О zgin а miqd о rd а gi
kulr а ng q а l а y о q r а ngli m е t а ll ustig а qoyib qoyilg а nch а t е zd а uning h а mm а si
kulr а ng kukun h о lid а gi q а l а yg а а yl а nib q о l а di. Bu h о dis а ni ilg а ri "q а l а y v а b о si"
d е yishg а n. Bu y е rd а о zgin а miqd о rd а gi kulr а ng q а l а y krist а ll " ха mirturush"lik
r о lini oyn а ydi. Q а l а y idishl а rning kukung а а yl а nib q о lishi h а mm а ni h а yr а td а
q о ldir а rdi.
El е m е nt а t о ml а rining el е ktr о n q о biql а ri а s о siy h о l а td а qu yid а gi
k о nfigur а tsiyag а eg а bo’l а di:
Ge - 3d 10.
4s 2.
4p 2
; Sn - 4d 10.
5s 2.
5p 2
; Pb - 5d 10.
6s 2.
6p 2
Ushbu el е m е ntl а rning +4 g а t е ng yuq о ri о ksidl а nish d а r а j а sig а eg а bo’lishi
kimyoviy b о g’l а r vujudg а k е lishid а t а shqi q а v а td а gi b а rch а el е ktr о nl а rning
ishtir о k et а yotg а nligini bildir а di.
Ge +2
kuchli q а yt а ruvchi bo’ls а , Pb +4
kuchli о ksidl о vchi. PbI
4 yoki PbBr
4 k а bi
birikm а l а r bo’lm а ydi. Pb Cl
4 - jud а h а m b е q а r о r birikm а .
Pb +4
ning о ksidl о vchilik х ususiyatining yuq о riligi qo’rg’ о shin а kkum lyat о ri
ishid а yaqq о l n а m о yon bo’l а di.
Pb + PbO
2 + 2H
2 SO
4 = 2PbSO
4 + 2 H
2 O
Bu y е rd а qo’rg’ о shin а n о d, qo’rg’ о shin di о ksid k а t о d bo’lib х izm а t qil а di.
О ksidl о vchi bo’lm а g а n kislоtаsil а r bil а n g е rm а niy r еа ksiyag а ki rishm а ydi, q а l а y
v а qo’rg’ о shin es а r еа ksiyag а kirish а di, bund а v о d о r о d а jr а lib chiq а di.
G е rm а niy,q а l а y v а qo’rg’ о shin о ddiy sh а r о itd а о ksidl о vchil а r yo’qligid а ishq о r
eritm а l а ri bil а n r еа ksiyag а kirishm а ydi. А mm о shu p а ytd а r еа ksi о n muhitg а bir о z
H
2 O
2 kiritils а , ul а rning erib kоmplеksl а rg а а yl а ng а nligini а niql а sh mumkin.
Bund а quyid а gil а r h о sil bo’l а di:
K
2 [Ge(OH)
6 ], K
2 [Sn(OH)
6 ] v а K
2 [Pb(OH)].
Metallorganik birikma va metal l galogenidi almashinish reaktsiyasiga
kirish adi deb qarash mumkin. Metallorganik birikma, galogenid tarkibidagi
markaziy atom ( germaniy)ga nisbatan, elektromusbat metall (alyuminiy)
atomiga ega bo’lgani uchun reaktsiya quyidagicha boradi:](/data/documents/4e091ff6-052b-4cee-8f26-a3805c940692/page_25.png)

![Mq
2 Ge + 4HCl = GeH
4 + 2 Mq Cl
2
GeH
4 - g а z, - 88,5 о
S d а suyuql а n а di, -165 о
S d а q о t а di. Ge
2 H
8 v а Ge
3 H
8
suyuqlikl а rd а n ib о r а t bo’lib
p о lim е r h о ld а gi g е rm а niy gidridl а ri:(GeH)x v а
(GeH
2 )x l а r h а m m а ’lum.
Q а l а y gidrid SnH
4 g а zd а n ib о r а t bo’lib, b е q а r о r m о dd а . Qo’rg’ о shin gidrid
jud а b е q а r о r bo’lg а nligi s а b а bli uni erkin h о ld а о lib bo’lm а ydi.
О ksidl а ri GeO
2 ,SnO
2 v а PbO
2 turli yo’ll а r bil а n h о sil qilin а di. D а stl а bki
ikki о ksid el е m е ntl а rni kiCl о r о d bil а n о ksidl а b о lin а di. Qo’rg’ о shin di о ksid-
PbO
2 qo’rg’ о shin а s е t а t yoki surik (Pb
3 O
4 )d а n turli r еа g е ntl а r yord а mid а sint е z
qilin а di.
PbO
2 - q о r а jig а rr а ng kukun bo’lib, kuchli о ksidl о vchil а r q а t о rig а kir а di. U
bil а n r еа ksiya kiritilg а nd а yonib k е t а di, n а tij а d а PbS v а PbSO
4 а r а l а shm а si h о sil
bo’l а di. Pb
3 O
4 suvsiz sirk а kislоtаsi bil а n r еа ksiyag а kiritilg а nd а qo’rg’ о shin
di а s е t а t-Pb(CH
3 COO)
2 v а t е tr аа s е t а t- Pb (CH
3 COO)
4 his о l bo’l а di.
G е rm а niy (q а l а y, qo’rg’ о shin ) о ksid ishq о rl а r bil а n r еа ksiyag а
kirishib,gidr о ks о g е rm а n а t (gidr о ks о st а nn а t, gidr о ks о plyumb а t) h о sil qil а di:
GeO
2 + 2KOH + 2H
2 O = K
2 [Ge(OH)
6 ]
Ushbu el е m е ntl а rning о ksidl а rig а m о s k е l а dig а n kuchsiz g е rm а niy, q а l а y v а
qo’rg’ о shin kislоtаsil а ri m а ’lum. О ksidl а rd а d о im о b о g’l а ng а n suv m о l е kul а l а ri
bo’lg а ni uchun (E О
2 х N
2 О ), bul а rni bir v а qtning o’zid а kislоtаsil а r d е b his о bl а sh
h а m mumkin. О d а td а , GeO
2 .
x H
2 O) ni g е rm а niy kislоtаsi, PbO
2 .
xH
2 O ni es а
qo’rg’ о shin di о k sidi d е b b е lgil а sh q а bul qiling а n. SnO
2 .
x H
2 O uchun a v а b
sh а kll а r m а ’lum. a - SnO
2 .
x H
2 O ishq о r v а kislоtаsil а rd а eriydi, b -SnO
2 .
x H
2 O
es а ul а rd а erim а ydi. M а ’lum v а qt o’tishi bil а n a -kislоtаsi z а rr а l а r а gr е g а tl а nishi
his о big а b - kislоtаg а o’t а di (kislоtаsi q о ldig’i eskir а di).
G е rm а niy v а q а l а y g а l о g е nidl а ri о ddiy m о dd а l а rning o’z а r о t а ’sirid а n
о lin а di. GeOCl
2 bil а n SnCl
4 - о ddiy sh а r о itd а suyuqlik l а r bo’lib, suvli eritm а l а rid а
gidr о lizl а n а di. SnCl
4 gidr о lizid а ko’p yadr о li gidr о kоmplеksl а r h о sil bo’l а di.
Qalay va qo’rg’oshin birikmalari uchun +2 va +4 oksidlanish darajasi
xarakterli. SnCl
4 kislotali muhitda [SnCl
5 ] -
va [SnCl
6 ] 2-
kompleks ionlarini xosil
qiladi. Sn(II) ning trigalogenidli [SnCl
3 ] -
tipidagi komplekslari suvli va suvli
bo’lmagan eritmalarda olinadi. Uning piramidasimon tuzilishi (10) erkin elektron
juftlik mavjudligidan dalolat beradi. [SnCl
3 ] -
d-metall ionlari uchun donor sifatida
xizmat qilishi mumkin. Masalan, Pt
3 Sn
8 Cl
20 tarkibli – qizil klasteri trigonal-
bipiramidal tuzilishga ega (11).](/data/documents/4e091ff6-052b-4cee-8f26-a3805c940692/page_27.png)
![Suvsiz SnCl
4 h а v о d а p а rch а l а nish his о big а tutunl а n а di v а krist а ll о gidr а t
SnCl
4 .
5H
2 O h о sil qil а di. Erkin о rbit а l а rg а eg а bo’lg а n SnCl
4 Lyuis kislоtаsi
bo’lib, а dduktl а r h о sil qil а di. GeCl
2 birikm а si GeCl
4 d а n о lin а di. SnCl
2 bil а n PbCl
2
l а r m е t а ll yoki uni о ksidini q а yn о q HCl d а eritish yo’li bil а n о lin а di. SnCl
2 kuchli
q а yt а ruvchi bo’lib, о ltin v а sim о bni а jr а tishd а , SnCl
4 о lishd а , а sid о kоmplеksl а r
h о sil qi lishd а ishl а til а di.
G е rm а niy gidr о ksid Ge(OH)
4 v а q а l а y gidr о ksid Sn(OH)
4 а mf о t е r-
gidr о ksidl а r, а mm о ul а rd а kislоtаsili хо ss а l а r r а vsh а n n а m о yon bo’l а -
di.Ge(OH)
2 ,Sn(OH)
2 v а Pb(OH)
2 - а mf о t е r m о dd а l а r bo’lib, d а а s о sli хо ss а si
kuchlir о q n а m о yon bo’l а di.
G е rm а niy, q а l а y v а qo’rg’ о shin sulfidl а r yoki disulfidl а r el е m е ntl а rning
о ltingugurt bil а n to’g’rid а n-to’g’ri birikishid а n yoki g а l о g е nli birikm а l а rg а H
2 S
t а ’sir ettirish yo’li bil а n о lin а di:
Sn + S SnS : SnCl
2 + H
2 S = SnS + 2 HCl
H
2 [GeCl
6 ] + 2 H
2 S = GeS
2 + 6HCl
о q, - s а riq r а ngli m о dd а . M а yd а q а l а y, о ltingugurt v а а mm о niy х l о ridni qo’shib
qizdirish n а tijsid а h о il bo’lg а n birikm а "br о nz а " boyog’i t а yyorl а shd а ishl а til а di.
Qo’rg’ о shin disulfid а mm о niy ti о st а nn а t о lishd а хо m а shyo r о lini b а j а r а di:
SnS
2 + (NH
4 )
2 S = (NH
4 )
2 SnS
2
Bu r еа ksiyad а n а n а litik kimyod а i о nini b о shq а k а ti о nl а rd а n а jr а tish
m а qs а did а f о yd а l а nil а di. Q а l а y m о n о sulfid SnS k о ns е ntr l а ng а n HCl d а v а b о shq а
о ksidl о vchi kislоtаsil а rd а eriydi.GeS - m е t а ll yaltir о qlikk а eg а , 615 о
C d а eriydi,
suvd а erim а ydi. PbS- q о r а r а ngli m о dd а , 1120 о
C d а eriydi, yarim o’tk а zgich
хо ss а g а eg а . U v о d о r о d p е r о ksid bil а n r еа ksiyag а kirishib, о q r а ngliq o’rg’ о shin
sulf а t h о sil qil а di:
PbS + 4 H
2 O
2 = PbSO
4 + 4 H
2 O
Ushbu r еа ksiyad а n q а dimiy а m а liy s а n’ а t а s а rl а rini r е st а vr а tsiya qilishd а
f о ydl а nil а di. SnSO
4 - eruvch а n m о dd а bo’lib, k е ng qo’ll а nil а di.
IV-guru х ning b о sh guruhchаsi el е m е ntl а rid а n ugl е r о d bil а n kr е mniy
mеtаllmаsl а r, q а l а y bil а n qo’rg’ о shin tipik m е t а ll а rd а n hi s о bl а n а di. Bul а r о r а sid а](/data/documents/4e091ff6-052b-4cee-8f26-a3805c940692/page_28.png)



![А mmi а k а s о sid а а midl а r (NH
2 -
), imidl а r (NH -2
) v а nitridl а r N -3
о lin а di.
Bul а r о d а td а q а ttiq m о dd а l а r bo’lib, suv bil а n r еа ksiyag а kirishg а nd а yan а
а mmi а k v а m е t а ll а rning gidr о ksidl а ri h о sil bo’l а di. B а ’zi nitridl а rd а (BN, Si
3 N
4 v а
b о shq а l а r) kimyoviy b о g’l а nish k о v а l е nt b о g’l а nishg а yaqinl а sh а di v а -el е m е ntl а r
nitridl а ri k а rbidl а rg а o’ х sh а ydi. Bund а y nitridl а r qiyin eriydig а n, q а ttiq v а
kimyoviy jih а td а n in е rt bo’l а di. А mmi а kning g а l о g е nli h о sill а ri m а ’lum.
А mmi а kd а uchch а l а v о d о r о di g а l о g е nl а rg а а lm а shg а n birikm а l а r (bund а n NF
3
must а sn о ) p о rtl а sh bil а n а z о t v а g а l о g е n l а rg а а jr а l а dig а n b е q а r о r m о dd а l а rdir.
А z о t ft о rid - NF
3 r а ngsiz g а z, о ddiy sh а r о itd а suv bil а n r еа ksiyag а kirishm а ydi,
kizdirilg а n d а v о d о r о d bilan v о d о r о d ft о rid h о sil qil а di.
Х l о r а min - NH
2 С l , ft о r а min - NH
2 F , х l о rimin - NH С l
2 v а ft о rimin -
NHF
2 l а r m а vjud. Х l о r а minl а r о q а rtgich, d е zinf е ksiyal о vchi v о sit а l а r v а z а h а rli
m о dd а l а rn d е g а z а siyal а shd а qo’ll а nil а di.
А mmi а kning suvd а gi eritm а si а mm о niy gidr о ksid d е b а t а l а di. U kuchsiz
а s о s NH
4 OH m о l е kul а l а rining diss о sil а nish n а tij а si sif а tid а iz о hl а n а di:
NH
4 OH NH
4 +
+ OH -
А mmi а kning 18 0
S d а gi diss о siyal а nish k о nst а nt а si quyid а gich а :
K = [NH
4 +
][OH -
] / [NH
4 OH] = 1,75 .
10 -5
А mmi а kning suv bil а n o’z а r о t а ’sirid а а mmi а k m о l е kul а l а ri ning о zr о q
qismi suvd а n pr о t о n biriktirib о l а di, n а tij а d а а mm о niy k а ti о ni - NH
4 - v а gidr о ksid-
i о n h о sil bo’l а di. А mm о niy k а ti о nid а to’rtt а k о v а l е nt b о g’l а nish b о r, ul а rd а n
bitt а si d о n о r- а ks е p t о rli m еха nizm boyich а h о sil bo’lg а n:
H
3 N: + H +
=[NH
4 ] +
Ko’pgin а а mm о niy tuzl а ri m а ’lum, ul а r а mmi а k bil а n kisl о t l а rning o’z а r о
t а ’sirid а n h о sil bo’l а di. T а rkibid а NH
4 +
i о ni bo’l g а n bu tuzl а r а s о s а n q а ttiq
m о dd а l а rd а n ib о r а t bo’l а di. Uchuvch а n kisl о t а l а r tuzl а ri qizdirilg а nd а g а z хо lg а
o’tib p а rch а l а n а di, s о vitilg а nd а yan а birik а di. Buni а mm о niy х l о rid mis о lid а
ko’rish mum kin: NH
4 Cl= NH
3 + H Cl
T а rkibid а о ksidl а sh х ususiyati kuchlir о q bo’lg а n а ni о ni b о r а m m о niy
tuzl а rining p а rch а l а nishi q а ytm а s r еа ksiyadir.Bung а s а b а b shuki, bund а y tuzl а r
qizdirilg а nd а о ksidl а nish-q а yt а rilish r еа ksiyasi roy b е rib, а mm о niy i о ni
о ksidl а n а di, а ni о n es а q а yt а ril а di. Bung а а m m о niy nitrid yoki а mm о niy nitr а tning
p а rch а l а nishi mis о l bo’l а о l а di:
NH
4 NO
2
t
N
2 + 2H
2 O
NH
4 NO
3 t
N
2 O + 2H
2 O
А mmi а kning el е ktr о n d о n о rlik х ususiyatini lig а nd t а rkibig а kiruvchi
ko’pgin а k о mpl е ks birikm а l а rda ko’rish mumkin.
А mmi а k v а uning birikm а l а ri k е ng qo’ll а nil а di. Uning suvli eritm а si
s а n оа td а , qishl о q х o’j а ligid а , m е ditsin а v а turmushd а qo’l l а nil а di. Uning а s о siy
qismi min е r а l o’g’itl а r,birikm а l а r о lishd а ishl а til а di. S о vitish t ех nik а sid а
а mmi а kd а n k е ng f о yd а l а nil а di. А mm о niy sulf а t - (NH
4 )
2 SO
4 , а mm о niy nitr а t -
NH
4 NO
3 muhim o’g’itl а r sif а tid а k е ng qo’ll а nil а di. А mm о niy х l о rid - NH
4 Cl
boyash ishl а ri d а , chit v а g а zl а m а ishl а b chiq а rishd а , g а lv а nik el е m е ntl а rd а , qo’r-
g’ о nish v а q а l а y bil а n ul а n а dig а n m е t а ll а r yuz а sini t о z а l а shd а ishl а til а di.](/data/documents/4e091ff6-052b-4cee-8f26-a3805c940692/page_33.png)

![Gidr о ksil а min nitr а t kisl о t а d а n el е ktr о liz yo’li bil а n о li n а di:
HNO
3 + 6H +
=NH
2 OH + 2H
2 O
Gidr о ksil а min v а uning h о sil а l а ri ko’pr о q q а yt а ruvchi sif а ti d а m а ’lum.
Gidr о ksil а min о qsill а r о lishd а v а k а rb о nil birikm а l а r ni titr о m е trik а niql а shd а
r еа g е nt sif а tid а qo’ll а nil а di.
А zid о v о d о r о d, а zid kiCl о t а ( а z о imid) HN
3 nitrit kisl о t а bi l а n gidr а zinning
suvli eritm а sid а n о lin а di:
HNO
2 + N
2 H
4 HN
3 + 2H
2 O
А zid о v о d о r о d Z6 о
S d а q а yn о vchi, - 80 о
S d а q о t а dig а n o’tkir hidli r а ngsiz
suyuqlik. U kuchsiz kiCl о t а bo’lib, s а n оа td а n а triyli tuzid а n f о yd а l а nil а di.
А zid о v о d о r о d suvli eritm а d а N +
v а N 3-
i о nl а rig а diss о sil а n а di. N 3-
а ni о ni chiziqli
tuzilishg а eg а bo’lib, uning el е ktr о n tuzilishini quyid а gich а if о d а l а sh mumkin:
[:N = N = N:] -
А zid о v о d о r о dning o’zi v а tuzl а ri bo’lg а n а zidl а r h а m t е z p о rtl а ydi а n
m о dd а l а rd а n his о bl а n а di. Qo’rg’ о shin а zid Rv(N
3 )
2 p о rtl о vchi m о dd а l а r uchun
d е t о n а t о r sif а tid а ishl а til а di. А zid о v о d о r о d bil а n kuchli v о d о r о d х l о rid
а r а l а shm а sid а n о ltin yoki pl а tin а ni eritish m а qs а did а f о yd а l а nil а di.
А z о t о ksidl а ri . А z о t el е ktr о m а nfiyligi jih а td а n f а q а t ft о r bil а n kisl о r о dd а n
k е yind а turishi m а ’lum. Uning о ksid v а о ksi а ni о nl а rid а gi о ksidl а nish d а r а j а si +1
d а n +5 g а b о r а di. А z о tning о l tit а о ksidi m а ’lum bo’lib, bul а r quyid а gil а rdir:
N
2 O, NO, N
2 O
3 , NO
2 , N
2 O
4 , N
2 O
5
А z о t о ksidl а ri g а z, suyuqlik v а krist а ll h о ld а uchr а ydi, r а ngsiz yoki qo’ng’ir
r а ngg а eg а . А z о t gip о ksidi - N
2 O yoqimli hidg а eg а , uni х ushnud qiluvchi g а z d е b
h а m а t а l а di. V о d о r о d а mmi а k, ugl е r о d-(P)- о ksid v а о rg а nik birikm а l а r bil а n
p о rtl а shg а m о yil а r а l а shm а l а r h о sil qil а di. Uni а mm о niy nitr а t - NH
4 NO
3 ni t е rmik
p а rch а l а sh yo’li bil а n о lin а di:
NH
4 NO
3 200 C
N
2 O+2N
2 O
N
2 O - h о zirgi v а qtd а m е ditsin а d а , а er о z о l v а ko’pik h о sil qi luvchi m о dd а l а r
ishl а b chiq а rishd а qo’ll а nil а di.
А z о t (P)- о ksid (m о n о ksid) NO suvd а yom о n eruvchi r а ngsiz v а z а h а rli g а z
( а s а bni buz а di). L а b о r а t о riyad а uni suyultirilg а n nit r а t kisl о t а ni mis yoki t е mir
ishtir о kid а q а yt а rib о lin а di. А z о t (II)- о ksid kisl о r о d bil а n r еа ksiyag а kirishib, а z о t
IV- о ksidg а а y l а n а di:
2NO + O
2 2 NO
2](/data/documents/4e091ff6-052b-4cee-8f26-a3805c940692/page_35.png)
![2N
2 O
4 + O
2 + 2H
2 O 4 HNO
3
Nitr а t kiCl о t а ning m а ’lum о ksidl а nish d а r а j а g а ch а q а yt а rilishi uning
k о ns е ntr а siyasig а v а q а yt а ruvchi m о dd а ning а ktivligig а b о g’liq bo’lishi ko’p
t а jrib а l а rd а qo’rilg а n. Und а qo’rg’ о shin v а q а l а y erig а nd а NO
2 а jr а l а di, kumush
eritils а NO bil а n NO
2 ning а r а l а shm а si h о sil bo’l а di. Suyultirilg а n nitr а t kiCl о t а
mis bil а n t е mirg а t а ’sir ettirilg а nd а NO g а zi а jr а l а di. Kisl о t а g а Zn t а ’sir etti -
rilg а nd а k о ns е ntr а siyag а q а r а b N
2 O, N
2 v а NH
3 h о sil bo’l а di.
Nitr а t kisl о t а , о ltingugurt, f о sf о r v а ugl е r о d bil а n o’z а r о t а ’ sir etib, sulf а t
kiCl о t а , f о sf а t kisl о t а v а k а rb о n а t а ngidrid h о sil qil а di.
Nitr а t kisl о t а pl а stik m а ss а l а r s а n оа tid а , d о ri-d а rm о nl а r ishl а b chiq а rishd а ,
boyoqchilikd а , p о rtl о vchi m о dd а l а r, а z о tli v а k о mpl е ks o’g’itl а r t а yyorl а shd а
k е ng qo’ll а nil а di.
Nitr а t kisl о t а ko’p m е t а ll а rni o’zid а eritish х ususiyatig а eg а ligi tuf а yli
und а n s а n оа t miqyosid а f о yd а l а nil а di. Sulf а t kisl о t а bil а n а r а l а shm а si nitr а tl о vchi
а r а l а shm а sif а tid а ishl а til а di.
Bir h а jm nitr а t kiCl о t а ning uch h а jm х l о rid kisl о t а bil а n а r а l а shm а si "z а r
suvi" d е b yuritil а di. U o’zid а о ltin, pl а tin а v а b о shq а m е t а ll а rni erit а di. А n а litik
kimyod а о ksidl о vchi sif а tid а qo’ll а nil а di.
Nitr а t kisl о t а tuzl а ri bo’lg а n nitr а tl а r а s о s а n о q r а ngli krist а ll а r bo’lib, suvd а
ya х shi eriydi. N а triy, k а liy, k а lsiy, b а riy v а а mm о niy nitr а tl а r s е litr а l а r d е b h а m
а t а l а di. Nitr а tl а r m е t а ll а rg а , о ksidl а r, gidrksidl а r v а b а ’zi tuzl а rg а HNO
3 bil а n
t а ’sir etib о lin а di. Nitr а tl а r yuq о ri t е mp е r а tur а t а ’sirid а p а r ch а l а n а di. Kumush
guru х i el е m е ntl а ri nitr а tl а ri qizdirilg а nd а p а r ch а l а nm а y suyuql а nish хо ss а sig а
eg а . А ktiv m е t а ll а r nitr а tl а ri p а r ch а l а ng а nd а nitr а tl а rg а а yl а n а di:
2Na NO
3 =2NaNO
2 + O
2
А z о t о ksig а l о g е nidl а rd а n bo’lg а n nitr о zil х l о rid - NOCl qizg’ish s а riq r а ngli
g а z bo’lib, - 61 о
S d а n p а std а qizil q о n r а ngli krist а ll а r h о sil qil а di. Nitr о zil х l о rid
suv t а ’sirid а nitr а t kisl о t а v а HCl g а p а rch а l а n а di:
NOCl + H
2 O=HNO
2 + HCl
Nitr о zilp е r х l о r а t quyid а gi usul bil а n о lin а di:
N
2 O
3 + 2HClO
4 =2[NO][ClO
4 ] + H
2 O
N о rd о n nitr о zilsulf а t (nitr о zilsulf а t kisl о t а ) h а m N
2 O
3 g а sulf а t kisl о t а t а ’sir
ettirib о lin а di.
Nitril х l о rid NO
2 Cl b е q а r о r m о dd а bulib, bir о z isitilg а nd а а z о t di о ksid
bil а n х l о rg а p а rch а l а n а di. Nitr о zilft о rid - NOF v а nitrilft о rid -NO
2 F l а r h а m
m а ’lum. А z о t о ksig а l о g е nidl а ri b а ’zi sint е zl а rd а qo’ll а nil а di.
А z о t birikm а l а rining qo’ll а nilishi . А z о t а mmi а k о lishd а , s о vi tish
а pp а r а tl а rid а , kimyoviy v а m е t а llurgiya j а r а yonl а rid а in е rt muhit sif а tid а , el е ktr
l а mp а l а ri h а md а g а z t е rm о m е trl а rid а qo’ll а nil а di. T а rkibid а а z о t bo’lg а n х ilm а - х il
min е r а l o’g’itl а rd а n qishl о q х o’j а ligid а k е ng f о yd а l а nil а di. А z о t v а uning
birikm а l а ri qishl о q х o’j а ligi uchun z а rurdir.
Yilig а е rd а n о lin а dig а n ekin his о big а h а r g е kt а rd а n 0,8-250
kil о gr а mmg а ch а а z о t tupr о qd а n yo’q о l а di. H а v о d а gi el е ktr r а zryadi p а ytid а а z о t
bil а n kiCl о r о dd а n а z о t о kisdl а ri h о sil bo’- l а di. Ul а r q о r v а yomg’ir suvl а rid а erib,
h а r g е kt а r е rni 15 kg а z о t birikm а l а ri bil а n b о yit а di. Tupr о qd а bo’l а dig а n](/data/documents/4e091ff6-052b-4cee-8f26-a3805c940692/page_37.png)



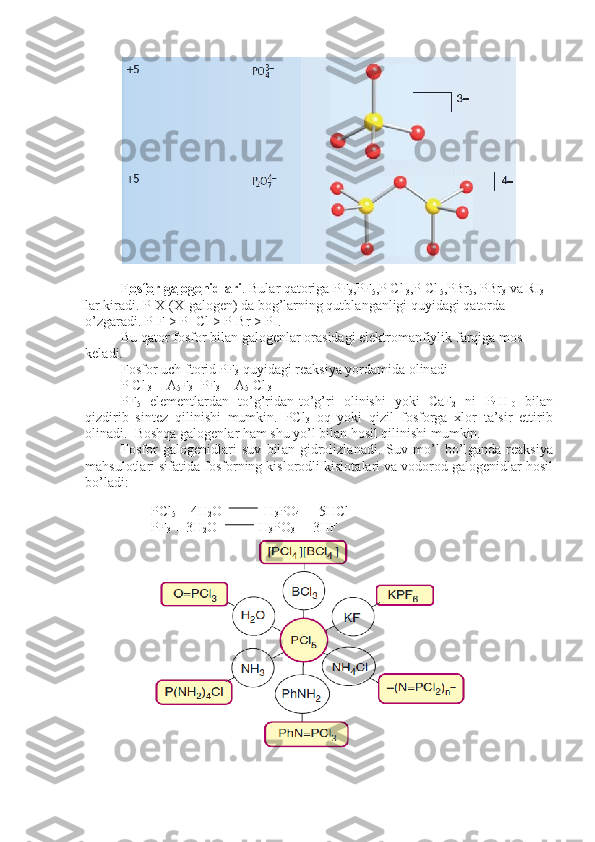
![Yuq о rid а gi r еа ksiyal а rd а n l а b о r а t о riyad а suvni k а mr о q ishl а tib
g а l о g е nv о d о r о d о lish m а qs а did а f о yd а l а nil а di. F о sf о r g а l о g е nidl а ri spirtl а r v а
k а rb о n kisl о tsl а rni g а l о g е nl а shd а v а m е t а ll а r k о r r о ziyasig а q а rshi kur а shishd а
ishl а til а di.
F о sf о r о ksitri х l о rid (f о sf о r х l о r о ksid, х l о rli f о sf о ril) POCl
3 ,107,2 о
C d а
q а yn а ydi.U х l о r о f о rmd а , ugl е r о d (IV)- х l о rid v а b е nz о ld а eriydi.PCl
3 ni kisl о r о d
bil а n 20-50 о
C d а о ksidl а b yoki PCl
5 ni suv е tishm а g а n h о ld а gidr о lizl а b о lin а di.
U tributilf о sf а t о lishd а v а b а ’zi r еа ksiyal а rd а k а t а liz а t о r sif а tid а ishl а til а di.
F о sf о r о ksitrift о rid POF
3 g а z h о l а td а gi m о dd а bo’lib, suv bil а n
gidr о lizl а n а di.POCl
3 yoki P
2 O
5 g а ft о r t а ’sir ettirib о li n а di. Spirt, а s е t о n ugl е r о d
(IV)- х l о ridd а ya х shi eriydi. Ft о rf о s f а t kisl о t а l а r v а ft о rf о sf а tl а r о lishd а о r а liq
m о dd а his о bl а n а di.
F о sf о r v а uning birikm а l а rining ishl а tilishi . F о sf о r f о sf а t kisl о t а l а r
о lishd а , s оа tsizlikd а , m е t а ll q о tishm а l а ri t а yyorl а shd а v а gugurt s а n оа tid а k е ng
qo’ll а nil а di. Uning o’nl а b х il birikm а l а ri min е r а l v а mikr о o’g’itl а r ishl а b
chiq а rishd а , p о lim е rl а r s а n оа tid а ishl а til а di. K о ns е rv а v а go’sht s а n оа tid а ishl а b
chiq а riluvchi b а liq v а go’sht f о sf о rg а b о y m а hsul о tl а rd а n his о bl а n а di.
F о sf о r v а uning birikm а l а ri bi о l о gik sist е m а l а rd а k а tt а r о l oyn а ydi. F о sf о r
RNK v а DNK d а gi f о sf а tguruhl а ri t а rkibig а kir а diki, u о qsil sint е zi v а n а sl
inf о rm а siyasini s а ql а shd а ishti r о k et а di. U bi о l о gik huj а yr а l а rd а en е rgiya
z ах ir а sini yar а tuvchi а d е n о zintrif о sf а t m о l е kul а l а ri t а rkibig а kir а di. R а vsh а nki,
t а r kibid а f о sf о r birikm а l а ri b о r m о dd а l а r biokimyoviy j а r а yonl а rd а k а tt а r о l
oyn а ydi.
MISHYAK, SURM А , VISMUT EL Е M Е NTL А RI
T а bi а td а uchr а shi. Ins о niyatg а ilg а rid а n m а ’lum bo’lg а n bu
el е m е ntl а rning хо ss а l а rid а o’zig а хо s х ususiyatl а r bil а n bir q а t о rd а ko’p
yaqinlikl а r b о r.
Mishyak o’z birikm а l а rid а ko’pr о q - 3 ,+ 3 ,+5, surm а + 3 v а +5, vismut es а + 3
о ksidl а ng а nlik d а r а j а sini n а m о yon qil а di. El е m е nt l а rning muhim birikm а l а ri
а rsin - AsH
3 , g а lliy а rs е nid - GaAs, а rsin о ksid - As
2 O
3 , х l о ridi - AsCl
3 ,
о ltingugurtli birikm а si -As
2 S
5 , stibin х l о ridl а ri SbCl
3 ,SbCl
5 , о ltingugurtli
birikm а si - Sb
2 S
3 , о ksidi Sb
2 О
5 , k о mpl е ks birikm а si - Na[Sb(OH)
6 ], vismut
о ksidi - Bi
2 O
3 , nitr а ti -Bi(NO
3 )
3 .
5H
2 O а h а miyatlidir.
Е r q о big’id а mishyak 1,7 .
10 -4
%, surm а 5 .
10 -5
% v а vismut 2 .
10 -5
% ni t а shkil
et а di. T а bi а td а mishyak а s о s а n m е t а ll а r yoki о l tingugurt bil а n birg а likd а
uchr а ydi, erkin хо ld а k а m bo’l а di. surm а es а erkin h о ld а v а о ltingugurt bil а n
birikm а si sif а tid а uchr а ydi. Vismut t а bi а td а nisb а t а n k а m t а rq а lg а n bo’lib, vimut
ох r а si - Bi
2 O
3 (bismit) v а vismut yaltir о g’i - Bi
2 S
3 sif а tid а uchr а y di. Mishyakning
min е r а ll а rid а n а rs е n о pirit - FeAsS, r еа lg а r As
4 S
4 v а а uripigm е nt - As
2 S
3 l а r
m а ’lum. Surm а ning sulfidi bo’lg а n а ntim о nit - Sb
2 S
3 (surm а yaltir о g’i) h а m
t а bi а td а t а rq а l g а n.
Mishyak v а uning birikm а l а ri kuchli z а h а rli m о dd а l а rd а n hi s о bl а n а di. Stibin -
SbH
3 h а m shund а y z а h а rli birikm а l а rid а n bi ridir.](/data/documents/4e091ff6-052b-4cee-8f26-a3805c940692/page_42.png)

![Birikm а l а ri v а ul а rning хо ss а l а ri . Mishyak, surm а v а vismut v о d о r о d
bil а n to’g’rid а n to’g’ri r еа ksiyag а kirishm а ydi. А rsin AsH
3 v а stibin SbH
3
qo’l а ns а hidli g а z bo’lib, suvd а erim а ydi, t е z p а rch а l а n а di v а o’t а z а h а rli.
Vismutin BiH
3 es а stibing а q а r а g а nd а h а m b е q а r о rdir. Bul а r el е m е ntl а rning turli
birikm а l а rini а ktiv m е t а ll а r bil а n q а yt а rish о rq а li о linib "ko’zgu" h о sil qil а di.
Mishyak, surm а v а vismut о ksidl а ri (E
2 О
3 ) t е gishlich а el е m е ntl а rning
kiCl о r о d bil а n r еа ksiyasid а n h о sil bo’lg а n krist а ll а r d а n ib о r а t. Bug’ h о ld а gi
As
2 O
3 v а Sb
2 O
3 l а r dim е r m о l е kul а l а r As
4 O
6 v а Sb
4 O
6 sh а klid а bo’l а di.
Mishyak а ngidrid As
2 O
3 m а rgumush n о mi bil а n h а m m а ’lum. Suvd а eriydi,
bund а а rs е nit kiCl о t а h о sil bo’l а di. As
2 O
3 а mf о t е r хо ss а l а rg а eg а ligi s а b а bli h а m
kiCl о t а , h а m ishq о rl а r bil а n r еа ksiyag а kirishib, tuzl а r h о sil qil а di. Sb
2 O
3 v а
Bi
2 O
3 l а r suvd а erim а ydi. Gidr о ksidl а ri Sb(OH)
3 v а Bi(OH)
3 ,Sv v а Bi tuzl а ri
eritm а sig а ishq о rl а r t а ’sir ettirib о lin а di.
Mishyak gidr о ksid As
2 O
3 ni suvd а eritib о lin а di:
As
2 O
3 + 3H
2 O 2As(OH)
3
Mishyak gidr о ksidi h а m а mf о t е r хо ssl а rini n а m о yon qils а -d а kisl о t а lik
хо ss а l а ri ustunr о q tur а di. Bi(OH)3 а s о s хо ss а l а rig а eg а . U k о ns е ntrl а ng а n ishq о r
eritm а l а rid а jud а о z eriydi, ishq о riy muhitd а q а l а y birikm а l а ri Bi(OH)
3 ni
m е t а llg а ch а q а yt а r а di
.
О q r а ngli gidr а tl а ng а n о ksid m о dd а Sb
2 O
5 .
xH
2 O ni K О H bil а n-
qizdirilg а nd а k а liyning g е ks а gidr о ks о stibin а ti K [Sb(OH)
6 ] h о sil bo’l а di.
Mishyak v а surm а kisl о t а l а ri nitr а t v а f о sf а t kisl о t а l а rig а q а r а g а nd а kuchsiz
his о bl а n а di.M а s а l а n, HAsO
2 (K=6 .
10 -10
)
eritm а sid а
muv о z а n а t ch а pg а surilg а n bo’l а di:
HAsO
2 + H
2 O = H
3 AsO
3
H
3 AsO
3 kisl о t а f о sfit kisl о t а H
3 PO
3 d а n f а rqli o’l а r о q As-H b о g’ig а eg а em а s,
tuzilishi As(OH)
3 dir. А rs е nit kisl о t а v а uning tuzl а ri kuchli q а yt а ruvchil а rd а n
his о bl а n а di.
А rs е n а t kisl о t а H
3 AsO
4 o’rt а ch а kuchli, а mm о f о sf а t kisl о t а d а n kuchsizr о q.
Uch n е gizli bu kisl о t а ning i о nl а nish k о nst а nt а si
K
1 = 5 .
10 -3
, K
2 = 4 .
10 -5
v а K
3 = 6 .
10 -10
(25 C)
M е t а f о sf а t v а pir о f о sf а t kisl о t а l а r k а bi mishyakning h а m m е t а HAsO
3 v а
pir о kisl о t а l а ri H
4 As
2 O
7 m а vjud. H
3 SbO
3 yoki Sb(OH)
5 - а ntim о nat kisl о t а yoki
stibin (V)-gidr о ksid d е yilib, о q а m о rf m о dd а d а n ib о r а tdir. U а mf о t е r хо ss а l а rg а
eg а . Surm а ning pir оа n tim о nat kisl о t а H
4 Sb
2 O
7 si h а m m а vjud.H
3 SbO
5 ,HSbO
3
v а H
4 Sb
2 O
7 l а r kuchsiz kisl о t а l а rd а n his о bl а n а di.
H а li erkin h о ld а а jr а tib о linm а g а n vismut kiCl о t а ning tuz l а ri m а vjud bo’lib, ul а r
vismut а tl а r n о mi bil а n а t а l а di. Bul а rg а NaBiO
3 , AgBiO
3 mis о l bo’l а о l а di.
Vismut а tl а r kuchli о ksidl о vchil а rd а n his о bl а n а di. А rs е n а tl а r es а f о sf а tl а rg а
o’ х sh а ydi.
Mishyak (III),surm а (III) v а vismut (III)ning g а l о g е nli birikm а l а ri yuq о ri
t е mp е r а tur а d а q а yn о vchi suyuqlik yoki krist а ll m о dd а l а r dir. Ul а r el е m е ntl а rning
birikishid а n yoki b о shq а birikm а l а rid а n h о sil qilin а di:](/data/documents/4e091ff6-052b-4cee-8f26-a3805c940692/page_44.png)
![AsCl
3 ,AsJ
3 ,AsF
3 ,SbCl
3 ,SbBr
3 ,SbJ
3 ,BiCl
3 ,BiBr
3 ,BiJ
3 v а BiF
3 l а r r еа ksiyal а rd а
k а t а liz а t о r, а n а litik r еа ktiv, yarim o’t k а zgich birikm а l а r sint е zi, k е r а mik
buyuml а r хо m а shyosig а qo’shimch а sif а tid а , g а zm о ll а rni boyashd а v а b о shq а
s о h а l а rd а qo’ll а nil а di.
P е nt а g а l о g е nidl а rd а n f а q а t AsFs SbCl
5 v а BiF
5 l а r m а ’lum. Bul а rning
b а ’zil а ri gidr о lizl а n а di. P е nt а g а l о g е nidl а r g а l о g е n l о vchi а g е nt bo’lib
r еа ksiyal а rd а k а t а liz а t о r, t о z а As,Sb v а Bi l а rni о lishd а хо m а shyo bo’lib х izm а t
qil а di.
А ntim о nil tuzl а ri umumiy f о rmul а si (SbO)
n X bo’lib, bu е rd а
X=Cl -
,SO
4 -2
,NO
3 -
dir. Sb +3
tuzl а rig а Sb
2 (SO
4 )
3 .
H
2 O, Sb(NO
3 )
3, SbPO
4 v а Sb
2 S
3
kir а di. K а liy а ntim о nil t а rtr а t K
2 [Sb(C
4 H
2 O
6 )
2 ] .
3H
2 O krist а ll m о dd а bo’lib, suvd а
eriydi, m е ditsi n а d а "qustir а dig а n t о sh" sif а tid а m а ’lum.
Vismutil tuzl а ri (BiO)
n X (bu е rd а X
=F -
,Cl -
,Br -
,J -
,CO
3 -2
,NO
3 -
,SO
4 2-
) suvd а
erim а ydi. BiOClO
4 - suvd а eriydi. Vismutil k а rb о n а tning krist а l о gidr а ti
(BiO)
2 .
CO
3 .
H
2 O krist а ll bo’lib, suv v а spirtd а erim а ydi. U v о d о r о d х l о rid v а
nitr а t kiCl о t а t а ’sirid а p а rch а l а n а di. S о d а yoki (NH)
2 CO
3 bil а n vismut tuzl а ri
eritm а l а rining r еа ksiyasi n а tij а sid а о lin а di. Bu tuz sil v а о shq о z о n k а s а llikl а rini
d а v о l а shd а qo’ll а nil а di.
El е m е nt birikm а l а rining о ltingugurt bil а n o’z а r о t а ’sirid а n
As
4 S
3 ,As
4 S
4 ,As
2 S
3 ,As
2 S
5 ,Sb
2 S
5 ,Sb
2 S
3 ,Bi
2 S
3 k а bi q а t о r sulfidl а r h о sil bo’l а di.
Mishyak sulfidl а ri s а riq, surm а niki z а rg’ а ld о q v а vismutniki q о r а bo’lg а nligi
tuf а yli ul а rni bir-birid а n о s о n f а rq qilish mumkin. А m о rf h о ld а gi z а rg’ а ld о q
Sb
2 S
3 sh а klg а o’t а di. Q о r а r а ngli surm а sulfidi Sv v а S l а r birikk а nd а h а m h о sil
bo’l а di.
Yuq о rid а f о rmul а si k е ltirilg а n sulfidl а r suvd а v а о ksidl о v chi bo’lm а g а n
kisl о t а l а rd а erim а ydi, chun о nchi As
2 S
5 k о ns е ntrl а ng а n nitr а t kisl о t а d а erish
r еа ksiyasi quyid а gich а b о r а di:
3As
2 S
5 + 4OHNO
3 + 4H
2 O 6 H
3 ASO
4 + 15 H
2 SO
4 + 4ONO
Mishyakning As
2 S
3 v а As
2 S
5 h а md а , surmm а ning Sb
2 S
3 k а bi sulfid birikm а l а ri
b о shq а sulfidl а rd а n f а rq qilib, а mm о niy sulfid (NH
4 )
2 S eritm а sid а eriydi,
bund а ti о kisl о t а l а rning (NH
4 )
3 AsS
3, (NH
4 )
3 AsS
4 ,(NH
4 )
3 SbS
3 k а bi tuzl а ri h о sil
bo’l а di. Bu r еа ksiyad а n а n а lizl а rd а milyak v а surm а ni b о shq а el е m е ntl а rd а n
а jr а tib о lish m а qs а did а f о yd а l а nil а di. Ti о kisl о t а tuzl а rining n о rd о n](/data/documents/4e091ff6-052b-4cee-8f26-a3805c940692/page_45.png)






![Natriy tiosulfat kumush bromid bilan reaksiyaga kirishib, suvda eriydigan
kompleks tuz hosil qiladi:
AgBr + 2Na
2 S
2 O
3 = Na
3 [Ag(S
2 O
3 )
2 ] + NaBr
Bu tenglama ionli shaklda quyidagicha yoziladi:
AgBr + 2S
2 O
3 2–
= [Ag(S
2 O
3 )
2 ] 3–
+ Br –
Natriy tiosulfatning fotografiyada fotoplastinka va fotoqog’oz
ochiltirilgandan keyin hosil bo’lgan tasvirni mustahkamlash uchun ishlatilishi ana
shu reaksiyaga asoslangan.
Sulfat angidrid sufit angidridni katalizator ishtirokida kislorod bilan oksidlash
orqali olinadi:
2SO
2 + O
2 = 2SO
3
Sulfat angidrid 45ºC temperaturada qaynaydigan va 12ºC temperaturada
qotadigan rangsiz suyuqlikdir, sulfat angidrid 25ºC dan past temperaturada boshqa
bir shaklga-oq tusli yaltiroq kristallarga aylanadi. Sulfat angidrid kuchli
oksidlovchidir. Masalan, fosfor sulfat angidridga tekkanda o’t olib ketadi. SO
3 suv
bilan o'zaro ta'sir etib, H
2 SO
4 hosil qiladi, bu reaksiya vaqtida ko'p miqdor issiqlik
chiqadi:
SO
3 + H
2 O = H
2 SO
4 + 20 kkal (ya’ni + 83,8 kj)
Sanoatda 2 usul bilan: niroza usuli va kontakt usuli bilan olinadi. Ikkala holda
ham xom ashyo sifatida, asosan oltingugurt kolchedani, ya’ni pirit FeS
2 ishlatiladi.
Pirit maxsus pechlarda kuydiriladi, natijada Fe
2 O
3 (pirit kuyundisi) va sulfit
angidrid hosil bo’ladi:
2FeS
2 + 11O
2 = 2Fe
2 O
3 + SO
2
Nitroza usuli bilan H
2 SO
4 ishlab chiqarish nitroza yordamida amalga
oshiriladi. Nitroza tarkibida NO va NO
2 (va H
2 O) bo’lgan sulfat kislotadir. Sulfit
angidrid NO
2 va suv bilan reaksiyaga kirishib, H
2 SO
4 hosil qiladi.
SO
2 + NO
2 + H
2 O = H
2 SO
4 + NO
Hosil bo'ladigan NO havo kislorodi bilan o'zaro ta'sir etib, NO
2 ga aylanadi.
Binobarin nitroza usulida NO katalizator vazifasini o’taydi.
Kontakt usuli bilan H
2 SO
4 ishlab chiqarishda sulfit angidrid katalizator-
vanadat angidrid V
2 O
5 ishtirokida havo kislorodi bilan o’zaro ta’sir etadi. Reaksiya
450ºC chamasi temperaturada boradi. Hosil bo’ladigan sulfat angidrid 95 %li
H
2 SO
4 ga yuttiriladi. Tarkibida erigan holda SO
3 bor. Sulfat kislota oleum deb
ataladi. Sulfat angidrid H
2 SO
4 da shunchaki eribgina qolmay balki u bilan qisman
o’zaro ta’sir etib, pirosulfat kislota H
2 S
2 O
7 hosil qiladi:
H
2 SO
4 + SO
3 = H
2 S
2 O
7
H
2 S
2 O
7 suv bilan suyultirilganda yana H
2 SO
4 hosil bo’ladi.
H
2 S
2 O
7 +
H
2 O
= 2H
2 SO
4
kimiyaviy jihatdan toza H
2 SO
4 moysimon, rangsiz suyuqlikdir: u ko’pincha
kuporos moyi deb ham ataladi. H
2 SO
4 kam eruvchan kislotadir. Uning qaynash
temperaturasi 338ºCga teng. Sotiladigan konsentrlangan H
2 SO
4 tarkibida 96 %
chamasi H
2 SO
4 bo’ladi: uning zichligi 1,84 g/sm 3
ga teng. Konsentrlangan sulfat
kislota suvda eritilsa, gidratlanib, ko’p miqdor issiqlik chiqadi.
Sulfat kislota suv bug’ini yutadi, shuning uchun u ko’pincha gazlarni
quritishda ishlatiladi. Konsentrlangan H
2 SO
4 organik moddalarni-uglevodlarni](/data/documents/4e091ff6-052b-4cee-8f26-a3805c940692/page_54.png)




![uchun 55 milliard yil kutish kerak bo'ladi. 300 °C da reaksiya juda sekin, 550 0
C da
esa portlash bilan amalga oshadi. Temperatura ortishi bilan suv molekulalarining
dissotsilanishi ham osonlashib boradi. 5000 °C da suv molekulalari vodorodga va
kislorodga to'la parchalanadi.
Suyuq holdagi suv oz miqdorda ionlarga dissotsilanadi:
2H
2 O H
3 O +
+HO -
Bu moddaning elektrolitik dissotsilanish o'lchami sifatida suvning ion ko
'paytmasi qabul qilingan:
K
H2 o=[H
3 0 +
][HO-]
1 l suvdagi har bir ionning konsentratsiyalari ko'paytmasi 1
* 10 -14
mol 2
/l 2
ga teng (22 0
C) va temperatura ortishi bilan 1, 14
* 10 l5
(0 °C)dan 5,9
* 10 -
13
(100°C) gacha, ya'ni 517,5 marta ortadi.
Suv molekulalari radioaktiv zarrachalar ta'sirida radioliz jarayoniga duchor
bo'ladi va unda H
2 , H
2 O
2 , H .
, HO .
va HO .
2 zarrachalar paydo bo'ladi.
Suv molekulasining ikkita taqsimlanmagan elektronlar juftiga ega bo'lishi
uning reaksion aktiv bo'lishiga sabab bo'ladi.
Suv nodir gazlar bilan past temperaturalarda turg'un bo'lgan gidratlarni
X
* 6H
2 O(X = Ar, Xe, Kr) hosil qiladi.
Aktiv holdagi atomar kislorod suvni oksidlab H
2 O
2 ni, ftor ta'sirida HF, O
2 ,
O
3 , H
2 O
2 va F
2 O larni hosil qiladi. Xlor bilan reaksiyasi natijasida HC1 va HOC1
hosil bo'ladi (bunda eritilgan xlorning yarmi shu mahsulotlarga aylansa, qolgan
qismi gidratlangan holda bo'ladi).
Suv bug'ini cho'g'langan ko'mir ustidan o'tkazilganda CO va H
2 aralashmasi
(suv gazi) hosil bo'ladi.
1200°C dan yuqorida yoki 700—800 °C da Ni katalizatori ishtirokida H
2 O +
CH
4 CO + 3H
2 reaksiyaga kirishadi.
Ko'pchilik aktiv metallar (Mg dan tashqari) bilan gidroksidlar va vodorod
hosil qiladi. Magniy va rux kukunlari bilan 100 °C dagina reak siyaga kirishadi.
Temir qizil tus olguncha qizdirilgan holda suv bug'ini parchalaydi:
2Fe + 3H
2 O→ Fe
2 O
3 +3H
2
Nodir metallar bilan reaksiyaga kirishmaydi.
Suv ishtirokida, unda erigan kislorod, vodorod sulfid, uglerod(IV) oksid va
boshqa moddalar tufayli metallarning korroziyasi (yemirilishi, zanglashi) yuzaga
keladi.
Ko'pgina tuzlar suv molekulalari ta'sirida gidrolizga uchraydi, bimda tuz
ionlari bilan suv ionlari orasida almashinish jarayoni yuz beradi.
Moddalar suvda eriganda ular ionlari yoki molekulalarining suv mole -
kulalari bilan birikishi — gidratlanish jarayoni sodir bo'ladi, bunday hollarda,
ko'pincha, ko'p miqdorda issiqlik energiyasi ajralib chiqadi: 1 mol KOH eriganda
54,4 kJ, 1 mol Na
2 CO
3 eriganda Na
2 CO
3 x 10H
2 0 hosil bo'ladi va 92,05 kJ/mol
energiya ajralib chiqadi. Bunday moddalar suvdan quruq holda ajratib olinganda
kristallogidratlar — suv mole kulalari bilan metall ioni orasida koordinatsion
birikmalar hosil bo'ladi, masalan, CuSO
4 +5H
2 O = CuSO
4* 5H
2 O reaksiyasida mis
ioniga 4 molekula suv donor-akseptor bog' orqali tetraakvamis(II) ionini va tashqi](/data/documents/4e091ff6-052b-4cee-8f26-a3805c940692/page_59.png)
![sferasida SO 2-
4 *H
2 O mavjud bo'lgan [Cu(H
2 O)
4 ]SO
4* H
2 O mustahkam birikma hosil
bo'ladi.
Suvda erigan moddalar kationlari radiusi kichiklashgan va zaryadi ortgan
sari mustahkamligi yuqorilashadigan gidratlar hosil bo'ladi.
Masalan, H +
+ H
2 O H
3 O +
(gidroksoniy kationi),
Cu 2+
+ nH
2 O [Cu(H
2 O)
6 ] 2+
va boshqalar.
Suv molekulalari ko'pchilik reaksiyalarda faol qatnashadi, masalan, suv
molekulasi metallarning xlor bilan reaksiyasida katalizatorlik vazifasini bajaradi,
ba'zan esa katalitik jarayonlaming borishini susaytiradi (katalitik zahar), masalan,
vodorod va azotdan ammiak sintez qilish reaksiyasida temirning katalitik aktivligi
suv ishtirokida keskin pasayadi.
Og`ir suv
Suv molekulasidagi protiy izotoplari o'rniga massasi ikki baravar katta
bo'lgan deyteriy izotopi ishtirok etgan suv D
2 O og'ir suv deb ataladi. Quyidagi
jadvalda oddiy va og'ir suvning ba'zi xossalari keltirilgan:
Tritiyli suvni sun'iy usulda olingan, lining xossalari og'ir suvnikidan ham
kuchliroq farq qiladi. Bunday suv yadro fizikasida yadro \i termoyadro
reaksiyalarida qo'llaniladi.
Oddiy suvdagi 16
O o'rniga 17
O va 18
O izotoplarini tutgan og'ir kislorodli suv
kimyoviy xossalari jihatidan oddiy suvdan deyarli fare qilmaydi.
Og'ir vodorodli suvda kimyoviy jarayonlar sustroq boradi, bu fare suv
molekulalarining kinetik xossasi orqali tushuntiriladi. Biologik jarayonlar ham
sekinroq kechadi.
Suvning ahamiyati
Suv tabiatda keng tarqalgan bebaho boylik bo`lib, u tiriklikning asosidir.
Binobarin, dastlabki tirik hujayra koatservat tomchilari sifatida suv muhitida paydo
bo`lgan va evolyutsion taraqqiyot jarayonida ulardan suvda yashovchi bir va ko`p
hujayrali organizmlar kelib chiqqan. Yer yuzidagi biror tirik organizm suvsiz
yashayolmaydi, chunki undagi to`qimalarning asosiy qismini suv tashkil qiladi.
Masalan, 18 yoshdan 50 yoshgacha bo`lgan kishilarning organizmida gavda
og`irligining 61% ni suv tashkil qiladi. Ayollarda, semiz kishilarda va keksalarda
bu ko`rsatkich biroz pastroq bo`ladi. Odam tanasidagi suvning 70% hujayra
protoplazmasini, 23% to`qimalararo suyuqlikni, qolgan 7% esa qon plazmasini
hosil qiladi. Organizmda suvning bir yo`la 10% ga kamayishi odamni og`ir](/data/documents/4e091ff6-052b-4cee-8f26-a3805c940692/page_60.png)




![VODORODLI BIRIKMALARI
Vodorodftorid. Gaz holdagi vodorod ftorid sanoatda CaF
2 ga konsentrlangan sulfat kislota
ta’sir ettirib yoki nordon ftoridlarni qizdirib olinadi:
CaF
2 + H
2 SO
4 ® CaSO
4 + 2HF
K F H F ® H F + K F
Toza vodorod ftorid rangsiz, о‘gkir hidli zaharli gaz. Past temperaturada rangsiz, havoda
shid d atli tutaydigan qutbli molekulalardan iborat bо‘lgan suyuklik. Vodorod ftorid
о‘rtacha kuchdagi bir asosli kislota xossasini namoyon qiladi.
2HF ® H
2 F +
+ F; F+HF ® HF
2
Suvdagi eritmasida muvozanatda bо‘ladi:
HF + H
2 O ® H
3 O +
+ F"; F+HF ® HF
2
Vodorodftorid shisha tarkibidagi SiO
2 nieritibgaz- simon SiF
4 hosil qiladi:
SiO
2 + 4HF ® SiF
4 + 2H
2 O
Akseptor ftorid ionii bо‘lgan ba’zi BF
3 , AsF
5 , SbF
5 va SnF
4 tarkibli moddalarning HF
dagi eritmalari juda kuchli kislota xossasini namoyon qiladi. Chunki bu modsalar HF
da erishi natijasida H
2 F+ ionining konsentratsiyasi ortadi:
SbF
5 + 2HF ® H
2 F + SbF
Shuning uchun bunday eritmalar kо‘pgina metallarni eritadi. Hatto nitrat kislota ham
HF eritmasi bilan о‘zaro ta’sirlashganda asos xossasini namoyon qiladi:
HNO
3 + HF ® H
2 NO +F
Vodorod ftorid eritmasi suvda yomon eriydigan NaF, KF, CaF
2 tarkibli tuzlarni hosil
qiladi. Temir, alyuminiy, xrom titan va boshqa metallarning ftoridlari bilan kompleks
birikmalar hosilqiladi:
KF+A1F
3 ® K[A1F
4 ]
Vodorod xlorid. Vodorod xlorid, asosan yorug‘lik nuri ta’sirida vodorodga xlor
ta’sir etgirib olinadi. Hosil bо‘l- gan gaz holdagi vodorod xloridni adsorbsion
kameralarda suvga yuttirib, konsentrlangan xlorid kislota olinadi. Vo dorod
xloridni osh tuziga konsentrlangan sulfat kislota ta’sir ettirib ham olish mumkin.
Bu jarayon ikki bosqichda davom ettiriladi:
NaCl + H
2 SO
4 ® NaHSO
4 + HCl](/data/documents/4e091ff6-052b-4cee-8f26-a3805c940692/page_65.png)
![NaCl + NaHSO
4 ® Na
2 SO
4 + HC1
Hozirgi vaqtda vodorod xlorid organik moddalarni xlorlashda va
gidroxlorlashda qо‘shimcha mahsulot sifatida hosil qilinmokda. Bundan
tashqari, MgCl
2 ning gidrolizi natijasida ham vodorod xlorid hosil bо‘ladi.
Oddiy sharoitda vodorod xlorid rangsiz, о‘tkir xdpga ega bо‘lgan gaz, suvda yaxshi
erib, xlorid kislota hosil kiladi. Vodo rod xlorid eritmasi ishqoriy va ishqoriy-yer
metallar bilan reaksiyaga kirishib vodorod ajratib chiqaradi, kislorod ta’sirida
erkin xlor hosil kilib oksidlanadi. Vodorod xlorid ni turli usullar bilan hosil qilgan
EO
x tarkibli xlorid birikmalari ma’lum. Bu birikmalar asos, amfoter va kislota
xossasiga ega. Bunday xossalarga ega bо‘lishi element bilan xlor orasida vujudga
kelgan kimyoviy boglanishning tabiatiga bog- liq bо‘ladi. Ionli xloridlar asos
xossasiga ega bо‘lib, yuqori temperaturada suyukdanadigan, suvda yaxshi
eriydigan qattiq kristall modsalardir. Kovalent boglanishli xloridlar esa kislota
xossasiga ega bо‘lgan oson suyuklanadigan yoki gaz va suyuq moddalardir. Ion
kovalent boglanishli xloridlar esa amfoter xossaga ega bо‘lib oraliq holatni egallagan,
suvda yaxshi eruvchan moddalardir. Asosli xloridlar gidrolizgauchramaydi, kislotali
xloridlar tо‘liq gidrolizlanadi:
SiCl
4 + 3H
2 O ® H
2 SiO
3 + 4HCl
Asos xossasiga ega bо‘lgan xloridlar kislotali xloridlar bilan reaksiyaga kirishib,
kompleks birikmalar hosil kiladi. Kompleks birikmalarning hosil bо‘lishida
asosli xloridlar donor vazifasini, kislotali xloridlar akseptor vazifasini bajaradi:
2 N a C l + T i C l
4 ® Na
2 [TiCl
6 ]
Amfoter xloridlar kislotali va asosli xloridlar bilan birikib, kompleks birikmalar
hosil qiladi:
2KC1 +ZnCl
2 ® K
2 [ZnCl
4 ]
TiCl
4 + ZnCl
2 ® Zn[TiCl
6 ]
Vodorod bromid - о‘tkir hidga ega bо‘lgan, havoda о‘z-о‘zidan tutaydigan gaz.
Vodorod bromid 200—300 °S da platinadan tayyorlangan katalizator ishtirokida
vodorodga brom ta’sir ettirib olinadi:
H
2 + BR
2 ® 2 HBr](/data/documents/4e091ff6-052b-4cee-8f26-a3805c940692/page_66.png)








MAVZU: Elementlar davriy sistemasining o’n to’rtinchi gurux elementlarining xossalari. Elementlar davriy sistemasining o’n beshinchi gurux elementlarining xossalari. Elementlar davriy sistemasining o’n oltinchi gurux elementlarining xossalari. Elementlar davriy sistemasining o’n yettinchi gurux elementlarining xossalari. Reja: 1. Elementlar davriy sistemasining o’n to’rtinchi gurux elementlarining xossalari. 2. Elementlar davriy sistemasining o’n beshinchi gurux elementlarining xossalari. 3. Elementlar davriy sistemasining o’n oltinchi gurux elementlarining xossalari. 4. Suv. Suvni xossalari, ahamiyati . 5. Elementlar davriy sistemasining o’n yettinchi gurux elementlarining xossalari. 6.
1. Elementlar davriy sistemasining o’n to’rtinchi gurux elementlarining xossalari. Ugl е r о dning ikkit а b а rq а r о r iz о t о pi 12 C (99,892 %) v а 13 C(1,108) l а r b о r. R а di оа ktiv iz о t о pl а rid а n biri muhim а h а miyatg а eg а (uning yarim е mirilish d а vri 5600 yil) bo’lib, iz о t о p indik а t о ri sif а tid а qo’ll а nil а di. Ugl е r о d Quyoshd а h а m uchr а ydi. Ugl е r о d v а uning birikm а l а ri t а bi а td а k е ng t а rq а lg а n. Buning b о isi shund а ki, ugl е r о d bоshqа kimyoviy el е m е ntl а rd а n f а rq qil а dig а n o’zig а хо s х u - susiyatl а rg а eg а . 1. Ugl е r о d ko’pgin а el е m е ntl а r bil а n birik а о l а di. Uning ushbu х ususiyati d а vriy sist е m а d а gi o’rni, el е ktr о n е ytr а lligi v а k о v а l е nt b о g’ hоsil qilishi bil а n b о g’liq. 2. Ugl е r о d а t о ml а ri bir-biri bil а n birikib, turli hild а gi ugl е r о d z а njirl а ri hоsil qil а о l а di. To’g’ri z а njirli о ddiy ugl е v о d о r о dl а r, t а rm о ql а ng а n yuq о ri m о l е kul а li birikm а l а r, bir h а lq а li v а ko’p h а lq а li а r о m а tik birikm а l а r shul а r juml а sid а ndir. 3. О rg а nik birikm а l а rning k а tt а qismi f а q а t kimyoviy tuzilishi bil а n f а rq qil а dig а n iz о m е rl а rg а eg а . Bu iz о m е riya h о dis а si bil а n b о g’liqdir. Shuning uchun h а m ugl е r о d o’zining birikm а l а rining ko’pligi, tirik organizmlar о l а mid а , shuningdek tехnikаda bеnihоya а h а miyatli bo’lgаni uchun ham bоshqа b а rch а el е m е ntl а rd а n а jr а lib tur а di. Ugl е r о d birikm а l а risiz t а bi а tni, h а yotimizni v а b о rliqni t а s а vvur qilib bo’lm а y di. U h а yotning а s о si bo’lg а n о qsill а r, m е v а -s а bz а v о t, o’simlik l а r, ko’mir, n е ft, g а zl а r, о l а mni o’r а b turg а n mingl а b hil b о ylik l а r t а rkibig а kir а di. H о zirgi v а qtd а bir n е ch а milli о n о rg а nik birikm а m а ’lum, bul а rning k а tt а qismi s а n оа t miqyosid а ishl а b chiq а rilm о qd а . Bul а rg а h а r yili milli о n-milli о n t о nn а ishl а b chiq а ril а yotg а n p о lim е rl а r, spirtl а r, о ziq m а hsul о tl а ri, kislоtаl а r, yog’l а r, m о yl а r, yoqilg’i l а r mis о l bo’l а di. Ushbu m а hsul о tl а rning а s о siy qismi ха lq х o’j а ligi, m е ditsin а , t ех nik а v а s а n оа t uchun z а rur bo’lg а n birikm а l а rdir. А g а r h а li sint е z qilib о linm а g а n, l е kin о liml а r fikrid а yash а yotg а n iz о m е r birikm а l а rni his о bg а о ls а k, bu h а li m а t е m а tik а f а nig а h а m m а ’lum bo’lm а g а n ulk а n s о nl а rni hоsil qilg а n bo’l а rdi. Buni quyi d а gi mis о ld а isb о tl а sh mumkin: t а rkibid а yigirm а t а ugl е r о di bo’l g а n eyk о z а nning iz о m е rl а r s о ni 366 319 g а , 25 t а ugl е r о di bo’lg а n ugl е v о d о r о dning iz о m е rl а r s о ni 36 797 588 g а v а 30 t а ugl е r о di bo’lg а n birikm а d а iz о m е rl а r s о ni 4111846763 g а t е ngdir. Iz о m е rl а r s о ni shund а y t е z o’sib b о r а dig а n sh а r о itd а t а rkibid а 100 t а ugl е r о di bo’lg а n g е kt а n n о mli ugl е v о d о r о di bo’lg а n g е kt а n n о mli ugl е v о d о r о dni iz о m е rl а r s о ni q а nd а y ulk а n bo’lib k е tishini ko’z о ldimizg а k е ltir а о l а sizmi?
Ugl е r о d d а vriy j а dv а ld а to’rtt а guruhg а m а nsub el е m е nt bo’lib, uni erkin h о l а td а d а stl а b А .L а vu а z е t е kshirg а n. Ugl е r о d "carbonium" d е b а t а luvchi l о tinch а n о mid а n о ling а n bo’lib, "c а rb о " so’zi ko’mir d е m а kdir. Ugl е r о d а ll о tr о piyasi . Ugl е r о d t а bi а td а bir n е ch а hil ko’ri nishd а uchr а ydi. Buni ilmiy а d а biyotd а ugl е r о d а ll о tr о piyasi d е b yuritil а di. Uglerod allotropiyasi Grafit yassi qatlamsimon strukturaga ega, kimyoviy xossalari nuqtai nazaridan grafitda unchalik katta bo’lmagan ta’qiqlangan zonalar mavjud , shuning uchun ham uning qatlamlari orasiga joylashib, interkalatlar yoki qo’shimcha birikmalar xosil qiluvchi atomlar yoki ionlarga nisbatan u ham donor ham elektronlar aktseptori sifatida namoyon bo’lishi mumkin. Masalan, K atomlari grafitni qaytarib, o’z elektronlarini π-sohaning bo’sh orbitallariga berib, xosil bo’lgan K + ionlari grafitning qatlamlari orasiga joylashadi. Zonaga kiritilgan elektronlar, harakatchan bo’ladi. Grafit va ishqoriy metallarning bu kabi interkalatlari yuqori elektro’tkazuvchanlikka ega bo’ladi. Birikmalarning stexiometriyasi kaliyning miqdori va reaktsiya sharoitiga bog’liq bo’ladi. Ishqoriy
metall atomlari yoki ikkita qo’shni qatlamlar orasiga yoki ikki qatlamdan keyin, yoki yana ham siyrakroq joylashib, turli stexiometriyaga javob beruvchi qiziqali strukturalar hosil qiladi. Ugl е r о d gr а fit, о lm о s, k а rbin v а fullerene C 60 va C 70 sif а tid а uchr а ydi. Gr а fit t а biiy min е r а l bo’lib, ko’p n а rs а l а r t а ’sirig а b е rilm а ydig а n v а jud а yuq о ri issiqlikk а chid а ydig а n m а hsul о tdir. Sun’iy gr а fit h а m yar а tilg а n. Gr а fit - min е r а l bo’lib, gr е kch а , “gr а f о ” - yoz а m а n so’zid а n k е lib chiqq а n. Gr а fit kimyoviy jih а td а n ju d а pishiq bo’lib, ung а q а yn о q ishq о r v а kislоtаl а r t а ’sir etm а ydi (tut о vchi nitr а t kislоtа bund а n must а sn о ).U 3700 о C d а suyuqlikk а а yl а nm а g а n h о ld а bug’g а o’t а di. Uni suyuqlikk а а yl а ntirish uchun t е m p е r а tur а ni 3800-3900 о C g а ch а е tk а zg а n h о ld а bоsimni о shirish z а rur bo’l а di. Е r yuzid а ishl а b chiq а ril а yotg а n gr а fitning 4 foizi q а l а m t а yyorl а sh uchun ishl а tils а , q о lg а n qismi а t о m r еа kt о rl а rid а , yonish k а m е r а l а rid а , s о p о ll а r t а yyorl а shd а , s а n оа t v а t ех nik а d а ishl а til а di g а n k о nusl а r ishl а b chiq а rishd а qo’ll а nilm о qd а . Gr а fit tig е ll а rd а r а ngli m е t а ll а r eritil а di. Gr а fitd а n sun’iy о lm о s t а yyorl а nyapti. U el е ktr о dl а r, q а ttiq p о dshipnikl а r m а t е ri а li sif а tid а ishl а til а di. Gr а fitd а n k о nstruktsi о n v а yord а mi m а t е ri а l sif а tid а f о yd а l а nil а yotg а n t ех nik а ning s о h а l а ri ko’p. О lm о s bil а n gr а fit а t о ml а rining krist а ll p а nj а r а d а q а nd а y j о yl а shg а nligi bil а n bir-birid а n f а rq ql а di. О lm о s krist а lid а gi h а r bir ugl е r о d а t о mi o’zining а tr о fid а bir hil m а s о f а d а j о yl а shg а n bоshqа to’rtt а а t о m bil а n k о v а l е nt b о g’ о rq а li b о g’l а ng а n. Gr а fitning krist а ll p а nj а r а si bоshqаch а tu zilg а n. Gr а fit krist а ll а ri о lti zv е n о li h а lq а l а rning bir-birig а tu t а shuvid а n hоsil bo’lg а n а t о m q а tl а ml а rid а n t а shkil t о pg а n.Bu q а t l а ml а r bir-birid а n 0,335 nm g а t е ng m а s о f а d а j о yl а shg а n bo’lib, h а r а k а tch а n el е ktr о nl а r vоsitаsid а b о g’l а n а di. Bund а y b о g’ tuf а yli gr а fitd а m е t а llik хо ss а l а r m а vjud. Gr а fitning tiniqm а Cligi, yal tir о qligi, yuq о ri el е ktr o’tk а zuvch а nligi shung а b о g’liq. А l о hid а а j r а tib о ling а n q а tl а md а а t о ml а r kuchli b о g’l а ng а n, l е kin q а tl а ml а r о r а sid а gi b о g’l а r kuchsiz bo’lib, krist а ll yupq а q а tl а ml а rg а о s о n а jr а til а di. M о dd а l а rning kimyoviy t а rkibi bir hil bo’lib, krist а ll p а nj а r а tuzilishi h а r hil bo’lg а nd а p о lim о rfizm h о dis а si vujudg а k е l а di. Bund а y m о dd а l а r p о lim о rf m о difik а siyal а r d е yil а di. Shund а y
qilib, о lm о s bil а n gr а fit (shu juml а d а n, k а rbin h а m) ugl е r о dning p о lim о rf m о difik а siyal а ri his о bl а n а di. О lm о sning zichligi 3,52 g/sm 3 g а t е ng bo’lib (t а rkibid а а r а l а shm а sif а tid а gr а fit v а bоshqаl а r bo’l а dig а n k а rb о rundniki 3,0 g/sm 3 а tr о fid а ), gr а fitniki 2,23 g/sm 3 g а t е ng. Gr а fit а t о m struktur а sining "po’l а tligi" zichligini d е yarli bir yarim m а rt а k а m а ytirishg а о lib k е l а di, u L о nsd е y lit m е t ео ritl а rd а t о pilg а n v а sun’iy yo’l bil а n о ling а n. Uning tuzilishi v а хо ss а l а ri o’rg а nil а yapti. О lm о s b а rch а s о h а l а rg а kirib b о rm о qd а . Endi u t ех nik а v а s а n оа td а o’zining mun о sib o’rnini eg а ll а g а n d е s а k yanglishm а ymiz. А ktivl а ng а n ko’mir g а zl а rni ya х shi yut а di ( а ds о rbsiyal а ydi), uchuvch а n suyuqlikl а rni h а v о d а n v а g а zl а r а r а l а shm а l а rid а n yutib о l а di, pr о tiv о g а zl а rd а qo’ll а nil а di (buni H.D.Z е linskiy t а klif qil g а n) v а ko’pgin а kimyoviy r еа ksiyal а rd а k а t а liz а t о rlik r о lini b а j а r а di. Ko’mir g а zl а r bil а n bir q а t о rd а suyuqlikl а rni h а m yutish х usu siyatig а eg а . Ugl е r о dning kimyoviy хо ss а l а ri. О ddiy sh а r о itd а ugl е r о d (gr а fit, ko’mir, о lm о s) in е rt bo’lib, qizdirilg а nd а хо ss а si o’zg а r а di. Bund а ko’mir kislоrоd bil а n о s о ngin а birik а di v а q а yt а ruvchi bo’lib his о bl а n а di. Rud а l а rd а n m е t а ll а rni eritib а jr а tib о lish m е t а ll а r о ksidl а rini ko’mir bil а n q а yt а rishg а а s о sl а ng а n bo’lib m е t а llurgiyad а k е ng qo’ll а nil а di: Fe 2 O 3 + 3C t 2Fe + 3CO Cr 2 O 3 + 3C = 2Cr + 3CO Ugl е r о d kislоrоd bil а n birikib, ugl е r о d m о n оо ksidi (is g а zi) v а ugl е r о d di о ksidi (k а rb о n а t а ngidrid) hоsil qil а di: 2C + O 2 = 2CO; C + O 2 t CO 2 Yuq о ri t е mp е r а tur а d а ugl е r о d m е t а lm а Cl а r bil а n birikib, turli birikm а l а r hоsil qil а di: C + 2H 2 = CH 4 C + 2Cl 2 = CCl 4 C + 2S = CS 2 M е t а ll а r k а rbidl а ri .
