MAGNIY XLORID, AMMIAK, MONOETANOLAMIN, SUVDAN IBORAT POLITERMIK ERUVCHANLIK SISTEMALARINI O‘RGANISH VA FAZALARNING TARKIBINI TAXLIL QILISH

![AJRATISh ............................. ................................................
§ 3. 1 Dolomitni xlorid kislota bilan parchalash, hosil bo‘lgan
eritmadan kalsiy va magniy xloridlarni
ajratish …………………. 26
§ 3 .2 MgCl
2 ·6H
2 O – NH
2 C
2 H
4 OH – H
2 O eruvchanlik sistemasini
o‘rganish ………………………………………………………
… 28
§ 3 .3 Mg Cl
2 ·6H
2 O – [ 25% NH
3 +
75% H
2 O] - H
2 O politermik
eruvchanlik
sistemasi ……………………………………………. 33
§ 3 .4 Magniy tuzini kalsiy va magniy tuzlari eritmasidan ajratib
olishda monoetanolaminning ta’sirini
o‘rganish …………………………. 36
§ 3. 5 Uchinchi bob b o‘ yicha xulosa ………………………………... . 44
XULOSA ……………………………………………………………. ........
. 45
FOYDALANILGAN ADABIYoTLAR …………………… .......... .......... 46
KIRISh
Dissertatsiya mavzusining dolzarbligi. Hozirgi kunda kalsiy va magniy
tuzlariga bo‘lgan talab yuqori bo‘lib, kimyo sanoati, qishloq xo‘jaligi, va
farmasevtika sohalarida keng miqyosda ishlatiladi. Kalsiy va magniy saqlagan
xomashyolarni qayta ishlab respublikamiz uchun kerakli bo‘lgan preparatlarni
ishlab chiqarish muhim ahamiyat kasb etadi.
Olimlar tomonidan mahalliy xomashyolar dolomit, fosforit, silvinit,
oxaktosh va boshqalar asosida preparatlarni olish va ishlab chiqarish bo‘yicha
ilmiy tadqiqotlar olib borilgan. Bu borada, dolomit mineralini kislotalar yordamida
parchalab, uning asosida kalsiy xlorid va magniy sulfat preparatlari ishlab
2](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_2.png)


![Dissertatsiya mavzusining dissertatsiya bajarilayotgan ilmiy tadqiqot
muassasasining ilmiy tadqiqot ishlari bilan bog‘liqligi. Dissertatsiya ishi
Umumiy va noorganik kimyo institutining ilmiy-tadqiqot ishlari rejasining PZ-
20170926386 “Mahalliy xom ashyo asosida kompleks ta’sir etuvchi, samaradorli
defoliant sintezi va olinish texnologiyasini ilmiy asoslarini ishlab chiqish”
mavzudagi loyiha doirasida bajarilgan.
Tadqiqotning maqsadi magniy xlorid, ammiak, monoetanolamin
sistemalarini o‘rganish, fazalar tarkibini taxlil qilish va kalsiy, magniy tuzlaridan
magniy tuzini ajratishdan iborat.
Tadqiqotning vazifalari :
“Sho‘rsu” dolomitini xlorid kislotada parchalab olingan kalsiy, magniy
xlorid eritmasidan, magniy xloridni ajratish usulini ishlab chiqish;
Mg Cl
2 ·2H
2 O – NH
2 C
2 H
4 OH – H
2 O eruvchanlik sistemasini o‘rganish va
taxlil qilish;
Mg Cl
2 ·2H
2 O – [ 25% NH
3 +
75% H
2 O] - H
2 O politermik eruvchanlik
sistemasini keng harorat va konsentratsiya oralig‘ida o‘rganish;
Eruvchanlik diagrammalarida hosil bo‘lgan fazalarning tarkibini kimyoviy
va fizik-kimyoviy tahlil usullari yordamida aniqlash;
[21,92% CaCl
2 + 15,49% MgCl
2 ] eritmasini monoetanolamin bilan
ta’sirlashuvini, tushadigan cho‘kmaning miqdoriga, eritmaning tarkibiga va pH
muhitiga bog‘lab o‘rganish;
kalsiy, magniy xlorid eritmasidan, magniy xloridni ajratib olishda,
monoetanolaminni ammiak bilan aralashma miqdorini magniy tuzini mol
miqdoriga bog‘lab o‘rganish.
Tadqiqotning ob’ekti kalsiy xlorid, monoetanolamin, ammiakli suv, xlorid
kislota.
Tadqiqotning predmeti respublikamizda mavjud bo‘lgan dolomit
mineralini kislotada parchalash, kalsiy va magniy tuzlarini ajratishdan iborat.
Tadqiqotning usullari. Dissertatsiyada vizual-politermik, piknometrli,
analitik, termik va rentgenfazali tahlil usullaridan foydalanilgan. Vizkozimetr VPJ
5](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_5.png)
![yordamida eritmaning qovushqoqligi tekshirildi, pH ni aniqlashda METTLER
TOLEDO FE 20/ FG 2 pH metrda va sindirish ko‘rsatkichini BM modelli IRF 454
refraktometrida aniqlandi.
Tadqiqotning ilmiy yangiligi quyidagilardan iborat:
- “Sho‘rsu” dolomitini xlorid kislotada parchalab olingan kalsiy, magniy
xlorid eritmasidan, magniy xloridni ajratishning maqbul usuli ishlab
chiqilgan;
- MgCl
2 ·2H
2 O – NH
2 C
2 H
4 OH – H
2 O eruvchanlik sistemasi keng xarorat va
konsentratsiya oralig‘ida o‘rganilgan va hosil bo‘lgan fazalar tarkibi
aniqlangan;
- MgCl
2 ·2H
2 O – [ 25%NH
3 +75% H
2 O ] – H
2 O eruvchanlik sistemasi keng
xarorat va konsentratsiya oralig‘ida o‘rganilgan va politermik
diagrammasi qo‘rilgan;
- o‘rganilgan sistemalarda hosil bo‘lgan fazalar tarkibi aniqlangan;
- “kalsiy, magniy xlorid eritmasidan kalsiy xloridni ajratishda [21,92%
CaCl
2 + 15,49% MgCl
2 ] : MEA massa nisbati 100 10 nisbat maqbul˸
sifatida tanlab olingan;
- [21,92% CaCl
2 + 15,49% MgCl
2 ] eritmasini magniy xloridni 1 mol
qismga, monoetanolaminni ammiak bilan aralashmasini [0.1 mol +0.9
mol] dan [0.9 mol + 0.1 mol] nisbatda qo‘shib, magniy tuzini ajratish
o‘rganilgan.
Tadqiqotning amaliy natijalari quyidagilardan iborat:
Magniy xlorid, monoetanolamin va ammiak asosida o‘rganilgan eruvchanlik
sistemalari tahlili asosida magniy tuzini ajratishni tashkil etishdan iborat.
Tadqiqot natijalarining ishonchliligi. Foydalanilgan kimyoviy (analitik
kimyo) va fizik-kimyoviy (rentgenfazali, termik, kuzatuv-politermik) tahlil
natijalari.
Tadqiqot natijalarining ilmiy va amaliy ahamiyati. Tadqiqot
natijalarining ilmiy ahamiyati tarkibida magniy xlorid, monoetanolamin, ammiakli
suvdan iborat bo‘lgan suvli murakkab sistemlardagi komponentlarning o‘zaro
6](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_6.png)

![I-BOB. ADABIYOTLAR SHARHI
§1.1 Dolomit rudasi xususiyatlari va undan kalsiy va magniylarni o‘zaro
ajratib olish usullari
Dolomit ( CaM g (CO
3 )
2 )- kalsiy va magniyning qo‘sh karbonatli tuzi
xisoblanadi . Texnik xususiyatlariga ko‘ra, dolomit ohaktoshlardan bir oz farq
qiladi. Dolomitning sof shakli: CaCO
3 - 54,2%; MgCO
3 - 45,8%. Oksidlar
bo‘yicha dolomit tarkibida: CaO - 30,41%; MgO - 21,86%; CO
2 -47,73%.
Dolomitning kristall tuzilishi olti burchakli rombi k shaklda (1.1 - rasm ) bo‘lib
uning rangi xilma-xil: oq, kulrang, och sariq va jigarrang ( aralashmalar, temirli
birikmalarga qarab ) . Ba’zida qora dolomit mavjud bo‘lib, uning rangi t arkibi da
bitumli yoki karbona t li aralashmalar mavjudligiga bog‘liq. Texnologiyada ular
quyidagich a guruhlana di: dolomit mineralining donalaridan hosil bo‘lgan dolomit
yoki marmar dolomit; ohaktoshga o‘xshash zich dolomit; toshli va uyali dolomit
[1].
1.1 Rasm. Dolomit kristalining struktura tuzilishi
Dolomit tarkibida aralashmalar, xususan: magnezit, kvars, siderit, gil
mineral guruhlari, FeO, Fe
2 O
3 , Al
2 O
3 , MnO va boshqa organik moddalar mavjud.
CaMg(CO
3 )
2 ning solishtirma og‘irligi 2,85 dan 2,95 gacha. Mineralogik shkala
8](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_8.png)
![bo‘yicha qattiqlik 3,5-4,0; bosim kuchi - 400 dan 1300 kg / sm 2
gacha, issiqlik
quvvati - 0,217 kal/g/g rad [2].
Dolomitning suvda eruvchanligi CaCO
3 ning eruvchanligidan kamroq.
Ammo karbonat angidrid bilan to‘yingan suvda dolomitning eruvchanligi kalsiy va
magniy bikarbonatlarining hosil bo‘lishi tufayli sezilarli darajada oshadi [3].
Dolomitning mineral kislotalardagi eruvchanligi kalsit va magnezit
eruvchanligiga nisbatan oraliq joyni egallaydi. Sovuq xlorid kislotada dolomitning
erishi sekin kechadi. Agar kukunli dolomitni suyultirilgan xlorid kislotada
qizdirilsa u butunlay eriydi eritmada faqat erimaydigan aralashmalar qoladi [1].
Schvbrzenbach va uning hamkasblari (1, 4, 5) etilendiamin tetraasetat
kislotaning (odatda Versen nomi bilan tanilgan) gidroksidini tuproq va boshqa
metallar uchun komplekslashtiruvchi vosita sifata hamda Eriochrome Schvartz T
yordamida suvdagi kalsiy va magniy yig‘indisi uchun titrant sifatida (Indikator F-
241) foydalanishni taklif qilishdi. Diehl, Goetz va Xach [2] ushbu usulni suvning
umumiy kalsiy va magniy qattiqligini aniqlash bilan bog‘liq holda o‘rgandilar.
Kalsiy va magniyni o‘z ichiga olgan eritmani to‘g‘ridan-to‘g‘ri titrlash ushbu ikki
elementning yig‘indisini berganligi sababli, ulardan kalsiyni oksalat shaklida
bog‘lab, keyin filtratdagi magniyni titrlash orqali ushbu ikki elementni miqdorini
topishni va ajratib olishni taklif etishdi. Ushbu tadqiqotning maqsadi bir qator
ohaktoshlar va dolomitlar tarkibidagi kalsiy oksidi va magniy miqdorini aniqlash
uchun qo‘llashdan iborat[4].
Ixtiro mineral xomashyoni, asosan past navli dolomitni qayta ishlash
texnologiyasiga ta’luqli bo‘lib, qog‘oz sanoatida to‘ldiruvchi, plastmassa, mineral
o‘g‘itlar va boshqa ishlab chiqarishda qo‘llaniladigan magniy oksidi yoki uning
hosilalarini olishda foydalanish mumkin. Ixtironing mohiyati CaO = 1,87 SiO
2 +
0,35 Fe
2 O
3 + 0,55 Al
2 O
3 massa nisbatini ta’minlash uchun dolomit, serpantinit yoki
sungulit bilan aralashtiriladi, aralashma briketlanadi, 800-900 o
C haroratda 0,75-
1,25 soat davomida pishiriladi. Mahsulot xlorid, magniy sulfat yoki sulfat kislota
eritmasi bilan T:W=1:20-100 nisbatda yuviladi, cho‘kma filtrlanadi hamda
filtratdan magniy birikmasi ajratiladi. Sulfat kislota eritmasi sifatida, magniy
9](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_9.png)
![birikmasini neytrallashdan qolgan sulfat angidrid bilan to‘yingan eritma ishlatiladi.
Erishilgan natija bog‘langan magniy birikmalarining tozaligini oshirish va jarayon
haroratini pasaytirishdan iborat bo‘lib ulardagi aralashmalar miqdori 0,85 - 2,5%
og‘irlik dan ko‘p bo‘lmaydi [5].
«Navbaxor» koni dolomitini xlorid kislotada parchalash yo‘li bilan kalsiy va
magniy xloridlari eritmalarini olingan. Dolomitni parchalashda ko‘pik hosil
bo‘lish jarayoni kislota konsentratsiyasi, uning uzatilish tezligi va temperaturasiga
bog‘liq [6].
40% nitrat kislota 110% stavkada magniy va kalsiyning ekstraksiya tezligi
mos ravishda 99,88-99,92% va 98,21-99,90% ni tashkil qiladi, jarayonning
davomiyligi 30 minut [ 7 ].
Dehqonobod koni dolomitini 40% li n itrat kislota bilan parchala shda harorat
va jarayon davomiyligi ta ’ sirini o‘rganish natijalari keltirilgan. 40% nitrat kislota da
jarayonning davomiyligi 30 minut bo‘lganda magniy va kalsiyning ekstraksiya
tezligi mos ravishda 99,88-99,92% va 98,21-99,90% ni tashkil qiladi . Eritmadagi
magniy oksidi tarkibiga temperatura va jarayon davomiyliklar ta’sir etmasligi
aniqlangan. 20 °C haroratda jarayon davomiyligini 10 - 60 minutgacha
uzaytirilganda kalsiy oksidi tarkibi 8,76% dan 9,07% gacha, 60 °C haroratda esa
8,90% dan 9,14% gacha oshadi, ya’ni temperatura eritmadagi kalsiy oksidi
tarkibiga ham qariyib ta’sir etmaydi. Temir va aluminiy oksidlari miqdori yuzdan
bir protsentni tashkil etadi. Parchalanish jarayoni davomiyligining ortishi qattiq
faza tarkibidagi magniy oksidiga ta’siri ko‘rib chiqilganda: jarayon davomiyligi 10
minut bo‘lganda 1,51-1,92% gacha, jarayon davomiyligi 60 minut bo‘lganda 0,72-
0,92% gacha kamayishi aniqlangan. Parchalanish haroratining ko‘tarilishi bilan
magniy oksidi miqdori 20 ° C da 0,92-1,92% ga, 60 ° C da esa 0,72-1,51% gacha
kamayadi [8] .
Dolomitni qayta ishlashning ya’na bir usuli, xom ashyoga sulfat kislota
eritmasini ta’sir ettirib, cho‘kma ko‘rinishidagi gips va magniy sulfati eritmasi
oli n adi . Magniy oksidi olish uchun eritmaga ishqoriy muhud berilib 1 soat
davomida arlashtiriladi va magniy gidroksidi ch o‘ ktiriladi . Dolomit xomashyosini
10](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_10.png)
![sulfat kislota bilan parchalashda kislota va xomashyo molyar nisbatda olinadi.
Dolomit xomashyosi bilan kislotaning ta’sirlashuvi 2 soat davom etadi. So‘ngra
aralashmaga suv solinib kamida 1 soat 2,4-2,5 GGs chastotali, quvvati 0,01-0,5
Vt/g bo‘lgan SVCh-maydonli qurilma yordamida karbonat angidrid gazi ajralib
chiqishi tugagunicha aralashtiriladi. Hosil bo‘lgan gips ko‘rinishidagi cho‘kma
filtrlanadi, tortiladi va albastr olinishda o‘lchangan gips massasidan 15% dan kam
bo‘lmagan massaga kamayguncha bug‘latiladi. Magniy sulfat eritmasi unga
qo‘shilgan ishqor bilan 2,4-2,5 GGs chastotali, quvvati 0,01-0,5 Vt/g bo‘lgan
SVCh-maydonli qurilmada magniy gidroksid ko‘rinishidagi quyqa hosil
bo‘lguncha aralashtiriladi, so‘ngra aralashma filtrlanadi va 2,4-2,5 GGs chastotali,
quvvati 1-4 Vt/g SVCh-maydonli qurilma bilan kaustik magniy oksidi olinguncha
5-20 minut davomida aralashtiriladi [9].
Ushbu ishda d olomitni tanlab o lib kalsinatsiya qilish , yarim
kal s in atsiya langan namunadan magniy sulfatni sof eritma sini olish va magniy
gidroksidni cho‘ktirish bo‘yicha o‘tkazilgan tadqiqot natijalari keltirilgan.
Dolomitni kuydi rish mexanizmi aniqlang an va MgCO
3 ni dekarbonizatsiya
darajasining harorat va jarayonning davomiyligiga bog‘liqligi t opilgan . Yarim
k uydi rilgan dolomit ga ammoniy sulfat eritmasi ta’sir ettirilib magniyni eritmaga
o‘ tkazish jarayoni moddalarning massasiga bog‘liqligi o‘ rganil gan [10].
Quyidagi ishda yelektromagnit ajratish natijasida olingan izotop bilan
boyitilgan kalsiyni ajratish va tozalash keltirilgan . Izotop bilan boyitilgan kalsiy
konsentrati xlorid kislotada e ritiladi, e ritma aralashmalardan tozalanadi, kalsiy
oksalat ammiak muhitida tartar ik kislota ishtirokida cho‘k tirila di hamda og‘ir
metallar aralashmalari sulfidlar shaklida cho‘k tirila di va ajratiladi . Olingan
e ritmadan kalsiy oksalat ammiak muhitida tartarik kislota ishtirokida qayta
cho‘kadi, kalsiy oksalat kislotada e ritiladi, tozalangan e ritma karbonat e ritmasida
cho‘kadi. Kalsiy ammoniy karbonat bilan to‘yingan ammiak e ritmasi bilan kalsiy
karbonat cho‘kmasi ajratiladi va 200-300°C va 800-850°C da qizdirilib ikki
bosqichda ishlov beriladi. Kalsiy o‘z ichiga olgan kon s entratni tozalash usuli ,
aralashmani yetarlicha to‘liq tozalash, kalsiyni deyarli yo‘qotishsiz chiqarilishini
11](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_11.png)
![ta’minl ashga va cho‘kindi ni qizdirib tayyor mahsulotni kerakli kimyoviy shaklini
olishga imkon beradi [7].
Ushbu tadqiqot to‘rt bosqichni o‘z ichiga olgan , dolomit rudasidan turli xil
xususiyatlarga ega magniy oksidi (MgO) zarralarini olishga qaratilgan . 1.
Namunani tayyorlash (S
1 ), 2. HCl eritmasi (S
2 ), 3. cho‘ktirish (S
3 ) va 4.
kalsinatsiya (S
4 ). Ikkinchi bosqichda olingan eritmadan magniy gidroksidi
[Mg(OH)
2 ] hosil qilish uchun , uchinchi bosqichda cho‘ktiruvchi sifatida uch xil
ishqor (NaOH, KOH va NH
4 OH) ishlatilgan. Keyin Mg(OH)
2 zarralari turli
vaqtlarda (1-5 soat) 600 dan 1000 °C gacha bo‘lgan harorat oralig‘ida xosil
bo‘ladi . Ushbu asoslarning ta’siri har bir mahsulotning xossa lari rentgen nurlari
difraksiyasi (XRD), skanerlash elektron mikroskopiyasi (SEM), Brunauer-Emmett-
Teller (BET), atom kuchi mikroskopiyasi (AFM) va nam kimyoviy tahlil bilan
o‘rganildi. Eksperimental natijalar shuni ko‘rsatdiki, har bir mahsulot ishlab
chiqarish sharoitlariga qarab 4,49-44,54 m 2
/g ma’lum sirt maydoni (SSA) bilan
olingan periklaza minerali (MgO) sifatida aniqlangan. SEM tahlili shuni
ko‘rsatdiki, 600 yoki 800 °C da ishlab chiqarilgan MgO zarralari amorf bo‘lib,
uning kristallari 1000 °C da silliq yaltiroq ko‘rinishga ega. Nihoyat, barcha
eksperimental ma’lumotlarga asoslanib, NaOH bilan MgO zarralari ning
ta’sirlashuvi, KOH va NH
4 OH bilan MgO zarralari ta’sirlashuvidan yaxshi
ekanligini ko‘rsatadi [ 11 ].
Ushbu maqolada magniy o‘z ichiga olgan tabiiy mineral dolomit, nitrat
kislota ta’sirida kalsiy va magniy tuzlariga parchalanishi haqida ma’lumot
berilgan. Maqolada mineral dolomitning tarkibi haqida ma’lumot beruvchi
jadvallar mavjud. Dolomitdan magniy va kalsiy tuzlarini olish, parchalanish
jarayoni bosqichlari va olingan mahsulotlarni qo‘llash sohalari tasvirlangan.
Maqolada parchalanish jarayonida yuzaga keladigan kimyoviy reaksiyalar
keltirilgan [12].
Magniyning elektrolitik ishlab chiqarilishi bilan bog‘liq tadqiqot ishlarining
katta qismi magniy gidroksixlorid (MgOHCl) ni o‘rganishga qaratilgan.
Moldnehauer [13] MgOHCl magniy xlorid gidratlarining suvsizlanishi va magniy
12](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_12.png)
![xloridning gidrolizlanishi natijasida hosil bo‘lishini birinchi bo‘lib aniqladi. Kelli
[14] va Kassner [15] MgOHCl ning hosil bo‘lishi va parchalanishini va uning
termodinamik xususiyatlarini o‘rgandilar. Vilnyanskiy va Savinkova [16]
MgOHCl turli xil Mg:OH:Cl nisbatlari bilan turli shakllarda bo‘lishi mumkinligini
aniqladilar. Ushbu birikmalar guruhi MgOHCl ning MgCl
2 dagi qattiq eritmasi
hisoblangan va MgCl(OH,Cl) sifatida ifodalanishi mumkin [17, 18].
Gidroksixloridlarning termal va gidrolitik parchalanishi va ularning magniy
ishlab chiqarish jarayonlariga ta’sirini o‘rganish uchun ko‘plab tadqiqotlar
o‘tkazildi [19-21]. MgOHCl ga bo‘lgan qiziqish, MgO kabi, agar u elektrolitda
mavjud bo‘lsa, u hujayra komponentlarini yo‘q qilishga yordam beradi va elektrod
reaksiyalariga xalaqit beradi. Shunday qilib, uning mavjudligi magniyning
elektrolitik ishlab chiqarilishiga ham jiddiy zarar etkazadi.
So‘nggi o‘n yilliklarda chiqindilarni boshqarishda iqtisodiy jihatdan
tasdiqlangan qayta ishlash konsepsiyasi eng mashhur bo‘lmoqda hamda keng
qo‘llanila boshlandi. Mineral resurslarning kamayishi va yangi qayta ishlash
texnologiyalarining paydo bo‘lishi bilan saqlanadigan chiqindilar sanoat
maqsadlarida foydalanish uchun miqdor va sifat jihatidan mos keladi [22].
Dunyoda har yili 25 milliard tonna qattiq sanoat chiqindilari chiqmoqda. Bu
miqdorning 70-80% ini mezbon jinslar, qayta ishlash chiqindilari, kimyo va
metallurgiya sanoati, va energiya boshqarish substandart minerallari o‘z ichiga
oladi [23]. Sun’iy yoki ikkilamchi kalsiyni o‘z ichiga olgan xom ashyolardan
kalsiy xloridlarini [24] sanoatda ishlab chiqarilishi natijasida, bir qator tarmoqlarda
sanoat chiqindilari miqdorini kamaytirish mumkin.
§1.2 Kalsiy va magniy tuzlari asosida defoliantlar olish usullari va
texnologiyasi
Defoliantlarni sanoat miqyosida ishlab chiqarishni yo‘lga qo‘yish, sintez
qilish, samarali qo‘llash usulini izlash, ishlab chiqishda birmuncha mehnatni talab
etadi. Shuningdek, 1987 yilda butifosdan foydalanish taqiqlanganidan so‘ng,
O‘zbekiston va mintaqaning boshqa paxta yetishtiradigan davlatlarida
13](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_13.png)
![paxtachilikda asosiy defoliant sifatida noorganik birikma - magniy xlorat qo‘llanila
boshladi.
Noorganik defoliantlar guruhi asosan xlorat kislota tuzlari bilan ifodalanadi:
magniy xlorat, natriy xlorat va kalsiy xlorat-xlorid.
Sanoat sharoitida magniy xlorat eritmadagi natriy xloratning bishofit bilan
o‘zaro ta’siridan olinadi [30-32]. 60 ± 2% magniy xlorat geksagidratini o‘z ichiga
olgan qattiq kristalli mahsulot 100% xom ashyodan foydalanganda olinadi.
Texnologik jarayon yopiq rejimda amalga oshiriladi va quyidagi bosqichlardan
iborat:
- bishofit eritmasi ni MgCl
2 · 6N
2 O olish;
- magniy xlorat defoliantining eritmasini olish uchun bi sh ofit ni natriy xlorat
eritmasiga solish ;
- mahsulotning kristallanishi yoki erishi ;
- mahsulotni joylash va qadoqlash;
- drenajlarni tozalash.
Bishofit aralashtirgich va bug‘latgich bilan maxsus jihozlangan
kislotabardosh qoplamalar bilan qoplangan eritgichlarda 110-120 0
C haroratda
namlik 5-10 % bo‘lguncha bug‘ holida suv qo‘shib eritiladi. Keyin kristall holdagi
natriy xlorat solinadi va doimiy ravishda aralashtiriladi. Almashinuv reaksiyasi
natijasida magniy xlorat olinadi.
MgCl
2 • 6N
2 O + 2NaClO
3 = 2 NaCl + Mg(ClO
3 )
2 • 6 H
2 O
Ortiqcha namlik bug‘latilgandan so‘ng, reaktordagi defoliant eritmasi - 12÷15 0
C
da suv bilan sovutiladigan kristalizator barabani qolipining tagiga yuboriladi.
Aylanadigan qolipli jixozda mahsulot plyonka shaklida kristallanadi va pichoq
bilan kesiladi. Barabandan kesilgan defoliant plastinalari yoki bo‘lakchalari lentali
uzatgichga yuboriladi va qadoqlashga o‘tkaziladi, u erda maxsulot qog‘oz yoki
polietilen qoplamali qoplarda qadoqlanadi. Bu usul bo‘yicha “Farg‘onaazot”
OAJda magniy xlorat defolianti ishlab chiqariladi.
“ UzDEF ” defolianti suyuq magniy xlorat defolianti, karbamid, asetat
monoetanolamin va ammoniy nitrat asosida sintezlanadi [25, 26].
14](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_14.png)
![Uni ishlab chiqarish texnologiyasining mohiyati karbamid, asetat
monoetanolamin va ammoniy nitratni 36% suyuq magniy xlorat defoliantida
komponentlarning 8,82:1:0,03:0,15 bo‘lgan massa nisbatida ketma-ket eritib,
so‘ngra bir hil eritma olishdan iborat [27].
Texnologik jarayon quyidagi asosiy bosqichlardan iborat [ 28 ]:
- magniy xloratning 36% li eritmasini reaktorga solish ;
- magniy xlorat dikarbamid olish uchun karbamidni magniy xlorat
eritmasiga solish va eritish;
- hosil bo‘lgan magniy xlorat dikarbamid eritmasi ga ammiakli selitrani
solish va eritish;
- hosil bo‘lgan bir jinsli eritma da a s etat mono e tanolaminni eritish;
- olingan tayyor “UzDEF” defoliantini drenajlash va qadoqlash.
S uyuq magniy xlorat defoliant i “Farg‘onaazot” ak s iyadorlik jamiyatida ishlab
chiqariladi.
Zaharlilik darajasi past “ Sadaf ” defolianti natriy xlorat va karbamiddan
sintez qilib olinadi [29, 30].
"Sadaf" defoliantini ishlab chiqarish usulining mohiyati karbamidni natriy
xloratning 46,5% eritmasida 1,69:1,0 komponentlarning massa nisbatida eritib,
so‘ngra natriy xlorat trikarbamidning bir hil 70% eritmasini olishdan iborat.
Texnologik jarayon quyidagi asosiy bosqichlardan iborat:
- omborga karbamid va natriy xlorat qabul qilish;
- reaktorga suv solish ;
- natriy xloratni suv g a solish va erishi;
- natriy xlorat trikarbamidning 70,0% eritmasini olish uchun karbamidni
natriy xlorat eritmasiga solish va eritish;
- olingan mahsulotni qadoqlash.
" Sardor " natriy xlorat, 2-xloroetilfosfat kislota va monoetanolamin asosida
sintezlanadi [31].
15](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_15.png)
!["Sardor" suyuq defoliantini ishlab chiqarish 50% li natriy xlorat va 2-
xloroetilfosfat kislota eritmalari yordamida amalga oshiriladi.
Asosiy texnologik jarayon quyidagi bosqichlardan iborat [32]:
- 2-xloroetilfosfa t kislotasining 50% li suvl i eritmasini reaktorga solish va
uni monoetanolamin bilan ammonizatsiya qilish;
- natriy xloratning 50% li eritmasini 2-xloroetilfosfonat
monoetanolam moniy va monoetanolamin eritma lari aralashmasiga solish va
aralashtirish;
- olingan mahsulotni qadoqlash.
Olingan mahsulot 39,51% natriy xlorat, 10,81% 2-xloroetilfosfonat
monoetanolam moniy , 2,53% monoetanolamin va 47,15% suvni o‘z ichiga olgan
biroz sarg‘ish rangga ega shaffof suyuqlikdir.
Xlorat li defoliant ning yana bir guruhi kalsiy xloratdir . Uning asosiy
miqdori ohak sutini xlorlash yo‘li bilan olinadi [ 33 ].
6Ca(OH)
2 + 6Cl
2 = Ca(ClO
3 )
2 + 5CaCl
2 + 6H
2 O
Olingan eritma suvli muhitda yaxshi eruvchanligi tufayli kalsiy xloriddan
kalsiy xlorat ajratib olish juda qiyin [34]. Shu sababli kalsiy xlorat yaqingacha
eritma shaklida xlorat-xlorid kalsiy defolianti savdo nomi ostida ishlab
chiqarilmoqda [35].
Sanoat usulida soda eritmasi va ohak sutini alohida xlorlashga asoslangan
bo‘lib, ular ClO
3 -
/ Cl -
1,05:1,25 nisbatlarda aralashgan bo‘ladi.
Natriy xloratning suvsiz kalsiy xlorid bilan aseton muhitidagi reaksiyasiga
asoslangan qattiq holatda defoliantni olish usuli ham ishlab chiqilgan [36].
2NaClO
3 + CaCl
2 = Ca(ClO
3 )
2 + 2NaCl
" Xayot " defolianti karbamid va kalsiy xlorat asosida ishlab chiqariladi.
Buning uchun 25-28% Ca(ClO
3 )
2 va 23-25% CaCl
2 bo‘lgan kalsiy xlorat-xlorid
eritmasiga 55-60 °C da 46,0% karbamid eritiladi [37].
Texnologik jarayon davriy rejimda amalga oshiriladi va quyidagi
bosqichlardan iborat:
16](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_16.png)
![- karbamidni kalsiy xlorat-xlorid eritmalariga solish va eritish;
- mahsulotning kristallanishi va filtrlanishi;
- ishchi eritmaning konversiyasi va bug‘latilishi;
- mahsulotni quritish, qadoqlash va yuklash .
Olingan preparat sarg‘imtir tusli oq kristall modda bo‘lib, tarkibida 86.98% faol
modda- Ca(ClO
3 )
2 ko‘pincha Ca(ClO
3 )
2 ·4CO(NH
2 )
2 · 2H
2 O, 11 , 21% kalsiy xlorid
t o‘rt karbamid va 1 , 81% suv bo‘ladi.
Suyuq kalsiy xlorat-xlorid defolianti va kristall kalsiy xlorat tayyorlash [ 38 ,
39 ] adabiyotlarda ko‘rib chiqilgan.
Suyuq xlorat-xlorid kalsiy defolianti va kristal kalsiy xlorat ishlab chiqarish
soda ishlab chiqarish chiqindilarini xlorlash natijasida olingan kristalli natriy xlorat
va xlorli su v hamda ohak ishtirokida amalga oshiriladi [ 40-46 ].
Texnologik jarayon quyidagi asosiy bosqichlarni o‘z ichiga oladi:
- distiller suyuqligi va ohakni reaktorga solish, so‘ngra xlorli suyuqlik olish
uchun xlorlash jarayoni;
- xlorli suyuqlikni natriy xlorat reaktoriga solish, so‘ngra bug‘latish va pulpa
filtratsiyasi purkash va natriy xloridni ajratish usun konvertatsiya qilish;
- ishchi eritmani sovutish va pulpani cho‘kindi jinslardan filtrlash va natriy
xloratni ajratish;
- olingan tarkibida kalsiy xlorat bo‘lgan, ishchi eritma kalsiy xlorat-xloridni
defolianti sifatida qadoqlash;
- kristalli kalsiy xlorat olish uchun ishchi eritmas ini bug‘la tish ;
- kalsiy xlorid bo‘lgan konsentrlangan eritmani sovutish va kalsiy bikarbonat
olish uchun pulpani cho‘kindi jinslardan filtrlash;
- qattiq mahsulotni qadoqlash va yuklash.
" Fandef-alo " preparatini ishlab chiqarish 3 bosqichdan iborat:
birinchi bosqichda kalsiy va magniy xloridlari eritmasi dolomitni xlorid
kislota li parchalash yo‘li bilan olinadi [ 44 ];
17](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_17.png)
![ikkinchi bosqichda kalsiy-magniy defoliant xlorat kalsiy va magniy
xloridlari eritmasini natriy xlorat bilan konversiyalash yo‘li bilan olinadi [45, 46];
uchinchi bosqichda "Fandef-alo" preparatining sintezi "Fandef", karbamid
va etilen ishlab chiqaruvchilar asosida amalga oshiriladi.
Kalsiy va magniy xloridlari eritmasini olish [ 47 ]
Kalsiy va magniy xloridlari eritmasini olish quyidagi bosqichlardan iborat:
- dolomitning xlorid kislota bilan ikki bosqichli parchalanishi [ 48 ; 49 ];
- olingan suspenziyani e rimaydigan qoldiqlardan tozalash;
- olingan kalsiy va magniy xloridlari eritmasini neytrallash;
- chiqindi gazlar dan tozalash (uskunalardan CO
2 va dolomit changlarini
chiqarish) [ 50 ].
"Fandef" kalsiy-magniy xlorat defoliantini tayyorlash [ 51 ].
Texnologik jarayon quyidagi bosqichlardan iborat:
- 60% eritma olish uchun kristalli natriy xloratni suvdv eri ti sh;
- kalsiy va magniy xloridlari eritmasini bug‘la t ish va natriy xlorat bilan
konversiyasi [ 52 ];
- pulpa filtratsiyasi va kristal natriy xloridni ajratish;
- qolgan suyuqli k ni sovutish, pulpa ni filtrlash va natriy xloratni ajralishi;
– tarkibida kalsiy va magniy xlorat bo‘lgan eritmani suyuq kalsiy-magniy
xlorat defolianti "Fandef" sifatida qadoqlash; [ 53 ].
"Fandef-alo" preparatini ishlab chiqarish [ 54-57 ] quyidagi asosiy bosqichlardan
iborat:
- reaktorga kalsiy-magniy xlorat defoliantini "Fandef" eritmasini solish ;
- bir jinsli eritma olish uchun karbamidni "Fandef" eritmasiga solish va
eritish;
- reaktorga e tanolni solish va tarkibida karbamid bo‘lgan kalsiy-magniy
xlorat eritmasida eritish;
- 2-xloroetilfosfat kislota va di e tanolaminni reaktorga 1:1 molyar nisbatda
solish va 2-HEF•D E A olish;
18](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_18.png)
![- sintez reaktoriga "Fandef", karbamid va e tanoldagi 2-HEF•D E A
eritmasidan iborat eritmani solish va ularni murakkab ta’sir e tuvchi
defoliant olish uchun eritish;
- olingan mahsulotni qadoqlash.
§1.3. Kuzatuv politermik usulda o‘rganilgan eruvchanlik diagrammalari
tahlili
Mualliflar [58] natriy trikarbamidoxlorat - asetamiprid - suv sistemasidagi
komponentlarning -19,0 dan 60 ° C gacha bo‘lgan harorat orlig‘idagi
eruvchanliklarini o‘rgangan. Tuzilgan politermik eruvchanlik diagrammasida muz,
natriy trikarbamid xlorat, karbamid va asetamipridning kristallanish maydonlari
chegaralangan, sistemaning evtektik nuqtasi -19,0 °C da 45,4%
NaClO
3 ·3CO(NH
2 ), 0,15% C
10 H
11 ClN
4 va 54,45% N
2 O ga to‘g‘ri keladi.
C
10 H
11 ClN
4 - CO(NH
2 )
2 - H
2 O sistema sakkizta ichki kesmalar yordamida -
16,4 dan 58,0°C gacha harorat oralig‘ida o‘rganilgan. O‘rganilayotgan sistema
holatining fazaviy diagrammasida muz, karbamid va asetamiprid kristallanish
maydonlari mavjudligi bilan tavsiflangan. C
10 H
11 ClN
4 - CO(NH
2 )
2 - H
2 O tizimida
yangi kimyoviy birikma hosil bo‘lmagan [59].
NaClO
3 ·3CO(NH
2 )
2 - CH
3 COOH·NH
2 C
2 H
4 OH - H
2 O sistemasidagi
komponentlarning o‘zaro ta’siri tabiati to‘qqizta ichki kesma yordamida o‘rganildi.
Ikkilik sistemalar va ichki kesmalar ma’lumotlari asosida -56,0 dan +50 0
C gacha
bo‘lgan haroratda NaClO
3 ·3CO(NH
2 )
2 - CH
3 COOH·NH
2 C
2 H
4 OH - H
2 O
sistemasining politermik eruvchanlik diagrammasi tuzildi [60]. Politermik
eruvchanlik diagrammasida muz, karbamid, natriy trikarbamid xlorat, sirka
kislotasi, sirka kislotasi monoetanolamin va sirkakarbamid monoetanolaminning
kristallanish sohalari chegaralangan.
Natriy xlorat dikarbamid va asetat monoetanolammoniy asosida samarali,
yumshoq ta’sir qiluvchi defoliant olish uchun NaClO
3 ·
2CO(NH
2 )
2 -
NH
2 C
2 H
4 OH
·CH
3 COOH - H
2 O sistemasidagi komponentlarning o‘zaro ta’siri
o‘rganilgan [61].
19](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_19.png)
![Natriy xlorat dikarbamid, asetat monoetanolamin va asetamiprid asosidagi
defoliantlarning yangi sinfini olish jarayonini fizik-kimyoviy asoslash maqsadida
mualliflar NH
2 C
2 H
4 OH · CH
3 COOH – C
10 H
11 ClN
4 - H
2 O sistemasidagi
koponentlarning o‘zaro ta’sirini vizual politermik usulda o‘rgangan [62].
Mualliflar tomonidan Ca ( ClO
3 )
2 – 2 NH
2 C
2 H
4 OH · H
3 C
6 N
5 O
7 – N
2 O sistemasi
komponentlarining o‘zaro eruvchanligi sakkizta ichki kesma yordamida vizual-
politermik usulda o‘rganilgan, kristallanish maydonlari topilgan va har 10 0
C
haroratda ichki izotermalar o‘tkazib tadqiq qilingan. [63,64].
Ikkilik sistemalar va ichki kesimlar yordamida -35,8 dan 40 0
C gacha
bo‘lgan harorat oralig‘igacha C a(ClO
3 )
2 ·4CO(NH
2 )
2 - CH
2 ClCOONa - N
2 O
sistemaning politermik eruvchanlik diagrammasi tuzilgan. Faza diagrammasida
boshlang‘ich moddalar va yangi birikma Ca(C
2 H
2 ClO
2 )OH·H
2 O ning kristallanish
maydonlari chegaralangan. [60% Ca(ClO
3 )
2 ·4CO(NH
2 )
2 +40% H
2 O] –
ClCH
2 COONa sistemaning qovushqoqlik, zichlik, pH, nur sindirish ko‘rsatkichlari
komponentlar nisbatiga bog‘liq xolda o‘rganilgan [65].
Komponentlarning C a(ClO
3 )
2 ·4CO(NH
2 )
2 - HOC
2 H
4 NH
2 ·ClCH
2 COOH -N
2 O
sistemadagi eruvchanligi vizual-politermik usulda o‘rganilgan. Ikkilik sistemalar
va ichki kesmalar asosida sistemaning politermik eruvchanlik diagrammasi
tuzilgan. Sistemaning politermik eruvchanlik diagrammasida muz, kalsiy xlorat
to‘rt karbamid, monoetanolamin va monoxloroasetatning kristallanish
maydonlariga ajratilgan hamda sistemaning tarkib – xossa diagrammasi qurilgan
[66].
Ilk bor ikkilik tizimlar va politermaning ichki kesimlariga asoslanib, -58.6
dan 70.0 °C gacha bo‘lgan harorat oralig‘ida Ca(ClO
3 )
2 -
CH
2 ClCOOH·NH
2 C
2 H
4 OH - H
2 O sistemasining politermik eruvchanlik
diagrammasi tuzildi. Sistemada o‘rganilgan konsentratsiya va harorat oralig‘ida
yangi birikma hosil bo‘lishi kuzatilmagan va sistema oddiy evtonik tipga
mansubligi aniqlangan [67].
Kalsiy xlorat - monoxlorasetat kislotaning natriyli tuzi - suv sistemadagi
komponentlarning eruvchanligi harorat va konsentratsiyaning keng oralig‘ida
20](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_20.png)
![vizual-politermik usul bilan o‘rganildi. Faza diagrammasida muzning,
Ca(ClO
3 )
2 ·6H
2 O, Ca(ClO
3 )
2 · H
2 O, Ca(ClO
3 )
2 · 2H
2 O, ClCH
2 COONa kristallanish
maydonlari ajratilgan. Yangi birikmalarning hosil bo‘lishi IQ spektri, rentgen faza
va kimyoviy analiz usullar bilan tasdiqlangan [68].
Ushbu ishda mualliflar tomonidan oksalat monoetanolammoniy, asetamiprid
va etanoldan iborat komponentlarning o‘zaro ta’sirlashuvi o‘rganilgan bo‘lib,
HOOC-COOH·NH
2 C
2 H
4 OH - [10% C
10 H
11 ClN
4 + 90% C
2 H
5 OH] – H
2 O sisiemasi -
4 °C dan 26,8 °C harorat oralig‘ida politermik eruvchanlik diagrammasi qurilgan
[69] .
Binar sistemalar va ichki kesmlarning politermalari asosida
CH
3 COOH·CO(NH
2 )
2 – NH
2 C
2 H
4 OH - H
2 O sistemasining politermik eruvchanlik
diagrammasi -53,0 dan 20,0 ° C gacha bo‘lgan harorat oralig‘ida qurilgan. 50%;
60%; 70% li uksus karbamid eritmalariga monoetanolamin qo‘shilgan
sistemalarning qovushqoqligi, zichligi va muhitning pH darajasi
aniqlangan [70].
§1.4 Adabiyotlar sharhi bo‘yicha xulosa
Ushbu bobda dolomit mineralini hususiyatlari va parchalab undan olingan
mahsulotlar haqida umumiy ma’lumotlar berilgan. Noorganik birikmalar kalsiy va
magniy xloratlar asosida olingan defoliantlarning batafsil tavsifi keltirilgan.
Xloratli yangi defoliantlarni olinishi va ishlab chiqarish bo‘yicha kimyoviy va
fizik-kimyoviy tadqiqotlarga alohida e’tibor qaratilgan. Kalsiy va magniy
tuzlarining o‘zaro ta’sirlashuvini keng harorat va konsentratsiya oralig‘ida
eruvchanlik sistemalarini o‘rganib, ularning kristallanish sohalari chegaralarini
aniqlash bo‘yicha ma’lumotlar keltirilgan.
21](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_21.png)

![sarg‘ish-yashil rangga ega. Xlorid kislotaning eritmasi tarkibida turli xil HCl
bo‘lishiga ko‘ra zichligi 1,018 dan 1,179 g / sm 3
gacha o‘zgarib turadi. Xlorid
kislota kimyoviy jihatdan juda faol. U manfiy normal potensialga ega bo‘lgan
barcha metallarni eritadi, ko‘plab metall oksidlari va gidroksidlarini xloridlarga
aylantiradi va fosfatlar, silikatlar, boratlar va boshqalar kabi tuzlardan erkin
kislotalarni chiqaradi.
Etanol C
2 H
5 OH - b ir atomli spirt bo‘lib, u ning molekular og‘irligi 46,063
g/mol . Bu rangsiz suyuqlik, 78,3 °C da qaynaydi, zichligi 0,806 g/sm 3
tashkil etadi .
§2.2 Kimyoviy va fizik-kimyoviy tahlil usullari
Dastlabki moddalarni va politermik eruvchanlik diagrammalarida hosil
bo‘lgan yangi fazalarning kimyoviy tarkibini aniqlashda quyidagi kimyoviy va
fizik-kimyoviy usullar qo‘llanildi: amidli azotni - spektrofotokolorimetriya yo‘li
bilan aniqlandi [71; 56-b.]. Kalsiy miqdori - hajmiy kompleksonometrik usulda
aniqlandi [72]. Xlorid ionining miqdori - permanganometrik usul bilan [73; 5-b.],
uglerod, azot va vodorod uchun elementar tahlil [74; 224-b.] usuliga muvofiq
amalga oshirildi.
Politermik eruvchanlik sistemalarda fazalarning eruvchanligini o‘rganishda
vizual-politermik usuldan foydalanilgan [75; 94-b.]. Vizual-politermik usul bir
tekis sovutilganda birinchi kristallarning paydo bo‘lish haroratini yoki sekin
qizdirilganda va eritmalarni doimiy aralashtirishda oxirgi kristallarning
yo‘qolishini vizual kuzatishga asoslangan. Eruvchanlikni aniqlash moslamasi
yopilgan tiqinli probirkada aralashtirgich yordamida, bo‘linish qiymati 0,1 °C
bo‘lgan termometrda olib borildi. Bir xil sovutish va isitish uchun probirka
sovutish yoki isitish aralashmasida joylashgan tashqi gilzaga joylashtiriladi.
Sovutish suyuq azot yoki quruq muz bo‘lgan Dyuar idishlarida amalga oshiriladi.
Birinchi natija sifatida vizual-politermik usul eruvchanlik egri chiziqlarini beradi,
ular asosida nuqtalar joylashtiriladi. Komponentlar aralashmasining tarkibini
muntazam ravishda o‘zgartirib, tabiati va yo‘nalishi sistemaning o‘ziga xos
xususiyati bilan bog‘liq bo‘lgan politermik kesmalar olinadi. Politermik kesmalar
23](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_23.png)
![va binar sistemalar haqidagi ma’lumotlar asosida o‘rganilayotgan sistemaning
eruvchanlik diagrammasi tuziladi, unda tugun nuqtalarining holati qo‘shma
kristallanish egri chizig‘ining yo‘nalishini belgilaydi. Uchta birgalikda kristallanish
egri chizig‘ining kesishgan nuqtasi uchlamchi nuqtasidir. Eruvchanlik egri
chiziqlari natijasida, aniqlangan nuqtalar asososida politermik eruvchanlik
diagrammasi shakllantirildi va ichki izotermalar o‘tkazildi. Komponentlarning
eritmada turli massa konsentratsiyasida turli xaroratga bog‘lab ikki komponentli,
uch komponentli va ko‘p komponentli eruvchanlik diagrammalari quriladi.
Sintez qilib olingan birikmalarning tarkibiy qismlari o‘rtasidagi o‘zaro
ta’sirning tabiatini aniqlash uchun IQ spektroskopik tahlil o‘tkazildi. Dastlabki
komponentlar va sintez qilib olingan birikmalarining IQ yutilish spektrlari Specord
IQ-75 spektrofotometrida 4000–400 sm –1
chastota diapazonida qayd etildi.
Namunalar tabletkalarni kaliy bromidi bilan presslash orqali tayyorlangan [80; 52-
b.].
O‘rganilayotgan yangi fazalarning termik tahlil qilish 10 daraja/min
qizdirish tezligida havo atmosferasida Paulik-Paulik-Erdei sistemasining
derivatografiyasida moddaning namunasi 100 mg, galvanometrlarning sezgirligi
DTA 1/5 va DTG 1/10, T 900°C da amalga oshirildi. Standart sifatida kalsiylangan
aluminiy oksidi ishlatilgan [81; 222-b.].
Rentgen faza tahlili Dron-3.0 difraktometrida 40 kV kuchlanish, 20 mA
oqim va qarshi disk tezligi 2 deg/min bo‘lgan filtrlangan mis nurlanishi bilan
amalga oshirildi.
Eritmalarning kinematik qovushqoqligi kapillyar diametri 1,47 mm bo‘lgan
VPJ tipidagi viskozimetr [ 76; 117-124-b.] yordamida o‘lchandi. Natijalarning
aniqligi ±0,0001 10-1 m 2
/sek tashkil etadi.
Nur sindirish ko‘rsatkichi BM modelining IRF 454 refraktometrida bitta
refraktometrik birlik bilan 1,2 dan 1,7 gacha bo‘lgan diapazonda aniqlandi [77].
O‘rganilayotgan birikmalar va eritma namunalarining solishtirma z ichligi
piknometrik usulda 20°C da aniqlandi [ 78 ; 572-b. ]. Bunda 5 sm 3
hajmli kapillyar
piknometr ishlatilgan. Hajmni aniqlash uchun harorat doimiy 25 °C da, piknometr
24](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_24.png)
![bidistillangan suv bilan maxsus belgisigacha to‘ldirilgan hamda massasi
o‘lchangan. Quruq piknometrning og‘irligini, 25° C da suvning zichligini va suv
bilan to‘ldirilgan piknometrning og‘irligini bilib, uning hajmi hisoblab chiqilgan.
Tarozi ± 0,00005 mg aniqlikda amalga oshirildi. Natijalar ±0,1 kg/m 3
aniqlik bilan
taqdim etiladi.
Defoliantlarning ishchi eritmalarining pH qiymati [79; 310-b.] usul bo‘yicha
"METTLER TOLEDO pH –metr FE20 da aniqlandi.
§ 2.3. Ikkinchi bob bo‘yicha xulosalar
Bobda boshlang‘ich komponentlarning xususiyatlari, shuningdek, yangi
birikmalar, ularni sintez qilish usullari, kimyoviy, fizik-kimyoviy tahlil usullari
bilan aniqlash yoritilgan. Ko‘p komponentli sistemalarni keng harorat va
konsentratsiya oralig‘ida eruvchanlikni o‘rganish usullari, shuningdek, tizimli
eritmalarning fizik-kimyoviy xususiyatlarini o‘rganish usullari keltirilgan.
25](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_25.png)



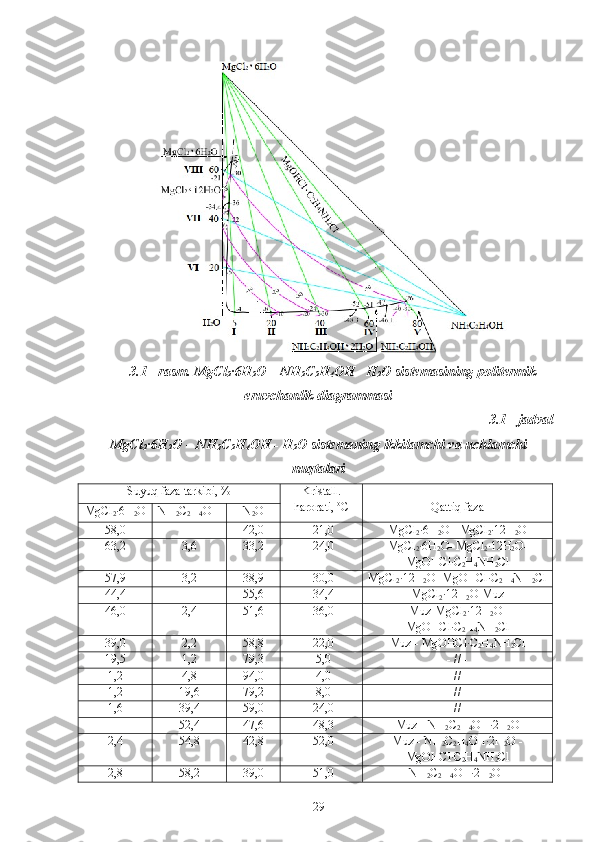


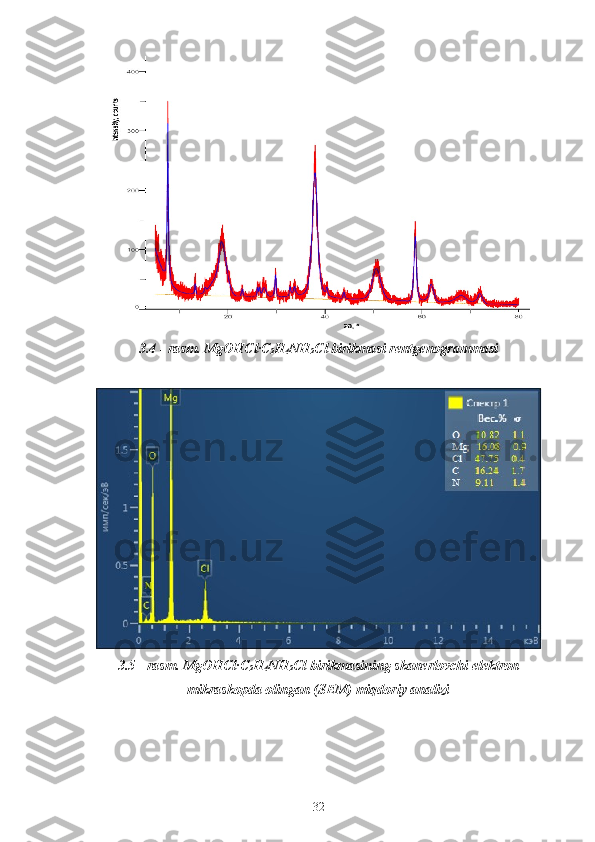
![3.6 - rasm. Mg OHC l ·C
2 H
4 NH
2 Cl birikmasining skanerlovchi elektron
mikraskopda (SEM) kattalashtirib olingan surati
Ajratib olingan birikmani kimyoviy va fizik - kimyoviy tahlil usullari
ntijasida, yangi Mg OHC l ·C
2 H
4 NH
2 Cl tarkibli birikmaning tahlil qiymatlari
dastlabki komponentlardan farq qilishi aniqlandi.
§3.3 Mg Cl
2 ·6H
2 O – [ 25% NH
3 +
75% H
2 O] - H
2 O politermik eruvchanlik
sistemasi
Magniy xlorid – ammiak - suv sistemasi kuzatuv -politermik usulda keng
harorat va konsentratsiya oralig‘ida o‘rganildi.
Dastlab magniy xlorid – suv ikki komponentli sistemasi o‘rganildi va
diagrammasi chizildi. Diagramma to‘rtta fazaga muz, magniy xloridning o‘n ikki
suvli, magniy xloridning olti suvli kristallanish maydonlariga ajraldi. Magniy
xloridning konsentratsiyasi 44,4 % gacha qo‘shilganda muz kristallari, 58,0 %
gacha qo‘shilganda o‘n ikki suvli magniy xlorid kristallari, 58,0% dan ortiq
magniy xlorid qo‘shilganda esa olti suvli magniy xlorid kristallanadi.
33](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_33.png)
![Mg Cl
2 ·6H
2 O – [ 25% NH
3 +
75% H
2 O] - H
2 O sistemasi -36,0 dan 40,0 o
C
harorat oralig‘ida yettita ichki kesmalar o‘tkazib diagrammasi qurildi 3.7 -3.8- 3.9
- rasmlar.
3.7-rasm. Mg Cl
2 ·
6H
2 O – [ 25% NH
3 +
75% H
2 O] - H
2 O sistemaning politermik
eruvchanlik diagrammasi
Politermik eruvchanlik diagrammada muzning, magniy xloridning o‘n ikki
suvli, magniy xloridning olti suvli va magniy gidrooksoxlorid ammoniy xlorid
qo‘sh tuzining kristallanish maydonlari chegaralari aniqlandi. Diagrammada -36,0
dan -34,4 o
C harorat oralig‘ida muz bilan o‘n ikki suvli magniy xlorid birgalikda
kristallanadi, -29,0 dan 21,0 o
C harorat oralig‘ida o‘n ikki suvli magniy xlorid olti
suvli kalsiy xlorid bilan birgalikda kristallanadi, -3,0 dan -17,0 o
C harorat oralig‘ida
34](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_34.png)
![magniy gidrooksoxlorid ammoniy xlorid qo‘sh tuzi muz bilan birgalikda
kristallanadi. Diagrammada fazalar ikkita uchlamchi no‘qtalar orqali tutashadi.
3 .8 - rasm . [ 25% NH
3 +
75% H
2 O] dan Mg Cl
2 ·6H
2 O tomonga proeksiyasi
3 .9 - rasm . Mg Cl
2 ·
6H
2 O dan [ 25% NH
3 +
75% H
2 O] tomonga proeksiyasi
O‘tkazilgan tadqiqotlar natijasida chizilgan diagrammaning fazalari eritmadan
ajratib olindi va olingan eritmaning tarkibi kimyoviy va fizik-kimyoviy usullarda
35](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_35.png)
![tarkibi aniqlandi. Diagrammadan shu jihatiga etibor qilish mumkinki, ammiakning
konsentratsiyasi ortib borishi bilan suvda erimaydigan fazaning maydoni
kattalashib boradi. Diagrammada barcha fazalar ichida asosiy qismini
magniygidrooksoxlorid ammoniy xloridning kristallanish maydoni tashkil etadi, bu
nimani anglatadi diagrammadagi barcha fazalarni hosil qilgan moddalar ichida
eruvchanligi yomonligini tushunish mumkin.
Xulosa o‘rnida shu narsani aytish mumkinki, diagrammaning taxlili
natijasida ammiakli suvdan 4% dan ortiq miqdorda magniy xloridga qo‘shsak
suvda erimaydigan yangi modda hosil bo‘ladi, bu esa kalsiy va magniy tuzlari
ichidan magniy tuzini eritmadan ajratib olish imkoniyatini beradi.
§3.4 Magniy tuzini kalsiy va magniy tuzlari eritmasidan ajratib olishda
monoetanolaminning ta’sirini o‘rganish
Tadqiqotlar davomida kalsiy xlorid eritmasini ajratishda texnologik
jarayonlarni asoslash uchun “Sho‘rsu” dolomitini xlorid kislota bilan parchalab
olingan kalsiy va magniy xloridlari eritmasiga oshib boruvchi turli nisbatlarda
monoetanolamin qo‘shib borish tartibida, hosil bo‘lgan cho‘kmaga, kalsiy xlorid
eritma massasiga va pH o‘zgarishiga bog‘lab o‘rganildi 3.2 - jadval.
3.2 - jadval
Kalsiy xlorid eritmasini ajratib olishda 21,92% CaCl
2 va 15,49% MgCl
2
eritmasiga turli nisbatda monoetanolamin qo‘shib borish tartibida maqbul sarf
meyorini aniqlash
№ Eritma [21,92% CaCl
2
+ 15,49% MgCl
2 ] :
MEA
gr Eritma
massasi, gr Cho‘kma
massasi, gr Eritmadagi
CaCl
2
miqdori
% pH
1 100:1 98,494 2,506 22,26 6,01
2 100:2 96,988 5,012 22,60 6,36
3 100:3 95,485 7,519 22,96 6,65
4 100:4 93,975 10,025 23,33 6,87
36](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_36.png)


![0 2 4 6 8 1 0 1 2 1 4 1 602468101214
МЭА массаси, (гр)рН
3. 13 - rasm. 21,92% CaCl
2 va 15,49% MgCl
2 eritmasiga MEA qo‘shib
borilganda, pH ko‘rsatkichining MEA miqdoriga bog‘liqligi
Olib borilgan tadqiqotlar natijasida kalsiy, magniy xlorid eritmasiga
monoetanolamin qo‘shib borishda, MEA:MgCl
2 bilan 1:1 ekvivalent mol nisbatda
bo‘lganda to‘liq birikib Mg OHC l ·C
2 H
4 NH
2 Cl tarkibli yangi birikmani hosil qilib
cho‘kishi aniqlandi.
Tadqiqotlar davomida magniy tuzlarini ammiak eritmasi bilan cho‘kma hosil
qilishini va kalsiy xlorid eritmasini ajratib olishning arzon samarali usulini yaratish
maqsadida, kalsiy, magniy xlorid eritmasidan magniy xloridni ajratishni
monoetanolaminni ammiak bilan turli nisbatdagi aralashmasini MgCl
2 :
[NH
2 C
2 H
4 OH+NH
3 ] qo‘shib borib o‘rganildi 3.3 - jadval.
Olingan ma’lumotlardan ko‘rinadiki MEA + NH
3 aralashmasida
ammiakning miqdori ortishi bilan umumiy eritma massasi ortib, cho‘kma massasi
kamayib boradi, bu esa ammiak massasining monoetanolamin massasidan
kichikligi bilan izohlanadi. Eritmaning umumiy massasi ortishi bilan kalsiy
xloridning konsentratsiyasi kamayib boradi, pH muhiti deyarli o‘zgarmaydi,
bundan eritmada ortiqcha miqdorda MEA va ammiak qolmaganligini anglatadi.
Tadqiqot natijasida MgCl
2 : [0,1 mol NH
2 C
2 H
4 OH + 0,9 mol NH
3 ] nisbat maqbul
sifatida tanlab olindi.
39](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_39.png)
![3.3 - jadval
MgCl
2 eritmasiga
turli nisbatda [NH
2 C
2 H
4 OH+NH
3 ]qo‘shib borish tartibida
umumiy eritma massasi, cho‘kma massasi, eritmadagi CaCl
2 ni % miqdorini va
eritma pH muhitiga bog‘liqligi
MgCl
2 : [NH
2 C
2 H
4 OH+NH
3 ]
(mol) Umumiy eritma
massasi, gr. Cho‘kma
massasi C a Cl
2 , % pH
1 : [1,0+0] 483,74 192,0 31,24 6,84
1 : [0,9+0,1] 490,42 187,6 30,82 6,85
1 : [0,8+0,2] 497,09 183,2 30,41 6,86
1 : [0,7+0,3] 503,71 178,8 30,00 6,83
1 : [0,6+0,4] 510,45 174,4 29,61 6,84
1 : [0,5+0,5] 517,12 170,0 29,23 6,86
1 : [0,4+0,6] 523,80 165,6 28,86 6,85
1 : [0,3+0,7] 530,47 161,2 28,49 6,83
1 : [0,2+0,8] 537,14 156,8 28,14 6,84
1 : [0,1+0,9] 543,81 152,4 27,79 6,86
1 : [0+1,0] 550,50 148,0 27, 45 6,85
Ushbu tanlab olingan [0,1 mol NH
2 C
2 H
4 OH + 0,9 mol NH
3 ] aralashmani
turli 20; 25; 30; 40 haroratda CaCl
2 va MgCl
2 eritmasiga qo‘shib borishda, hosil
bo‘lgan magniy saqlagan cho‘kmaning miqdorini, pH ko‘rsatkichlarini vaqt
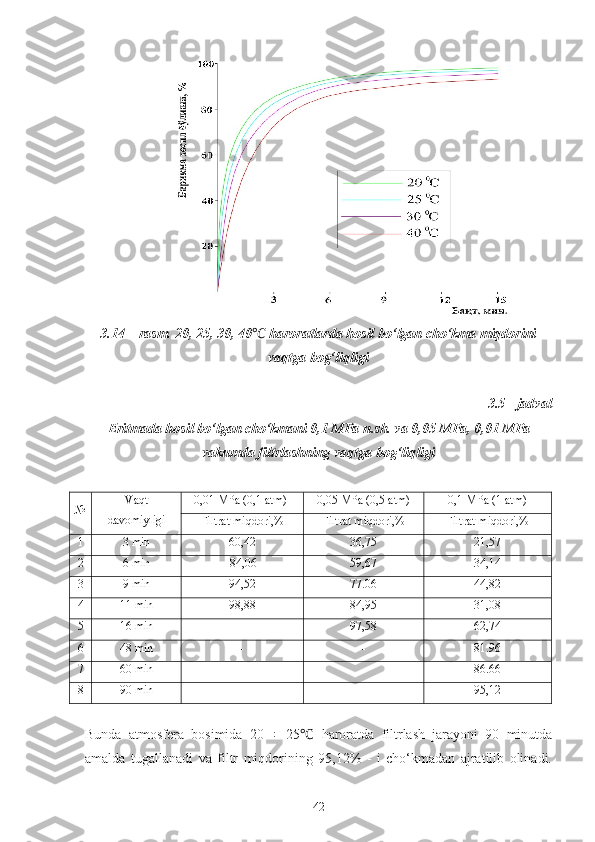
davomiyligiga bog‘liqligi o‘rganildi. Tadqiqotlar natijasida kimyoviy reaksiyaning
davomiyligi 20 ÷ 25 0
C haroratda maqbul meyor sifatida tanlab olindi 3.4 - jadval,
3.14 - rasm.
Kalsiy va magniy xlorid eritmasini [0 , 1 mol MEA + 0, 9 mol NH
3 ]
aralashmasi bilan neytrallashdan hosil bo‘lgan pulpa normal sharoit (n.sh.)da va
vakum ostida filtrlash jarayonining vaqtga bog‘liqligi o‘rganildi 3.5 - jadval.
40](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_40.png)
![3.4 - jadval
21,92% CaCl
2 va 15,49% MgCl
2 eritmasiga [0 , 1 mol MEA + 0, 9 mol NH
3 ]
qo‘shishda, turli haroratda hosil bo‘lgan cho‘kma miqdori va eritmaning pH
ko‘rsatkichini vaqt davomiyligiga bog‘liqligi
Vaqt
davomiyligi
(min.) 20 0
C 2 5 0
C 30 0
C 40 0
C
Reaksiya
borishi,% pH Reaksiya
borishi,% pH Reaksiya
borishi,% pH Reaksiya
borishi,% pH
1 69,8 7,12 64,9 7,07 55,4 7,04 42,5 6,86
2 82,2 7,14 79,2 7,09 75,6 7,06 62,4 6,89
3 88,1 7,16 86,3 7,11 83,4 7,08 76,6 6,91
4 91,5 7,17 89,7 7,13 87,6 7,09 83,5 6,93
5 93,6 7,18 92,2 7,14 90,5 7,10 87,7 6,94
6 95,2 7,19 93,9 7,15 92,6 7,11 90,2 6,95
7 94,0 7,20 95,2 7,16 93,8 7,12 92,0 6,95
8 94,1 7,21 95,8 7,17 94,7 7,13 93,1 6,96
9 95,2 7,22 96,3 7,18 95,6 7,14 93,8 6,97
10 95,6 7,23 96,6 7,19 95,8 7,14 94,3 6,98
11 97,8 7,24 96,9 7,20 96,0 7,15 94,9 6,99
12 98,1 7,25 97,2 7,20 96,4 7,15 95,2 7.00
13 98,4 7,26 97,7 7,21 96,6 7,16 95,4 7,01
14 98,8 7,26 98,0 7,22 96,8 7,16 95,6 7,02
15 99,4 7,26 98,4 7,22 97,1 7,16 95,8 7,02
41](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_41.png)

![3.16 - rasm. Kalsiy va magniy xlorid eritmasidan kalsiy xlorid ajratib
olishning blok sxemasi
§3.5. Uchunchi bob bo‘yicha xulosalar
Ushbu bobda dolomitni xlorid kislota bilan parchalab kalsiy va magniy
xloridlarni olish, olingan kalsiy va magniy xloridlardan magniy tuzini eritmadan
ajratib olish natijalari keltirilgan. Xususan “Sho‘rsu” dolomitini xlorid kislotasi
bilan parchalab olingan kalsiy va magniy xloridlarini monoetanolamin bilan
ajratish jarayonini ilmiy asoslash maqsadida birinchi marta MgCl
2 ·6H
2 O –
N H
2 C
2 H
4 OH - H
2 O va Mg Cl
2 ∙6H
2 O – [ 25% NH
3 +
75% H
2 O] - H
2 O sistemalari
kuzatuv–politermik usulida keng harorat va konsentratsiya oralig‘ida o‘rganildi.
Olingan ma’lumotlar asosida magniy xloridi – monoetanolamn – suv sistemasida
hosil bo‘lgan yangi birikma ajratib olindi hamda kimyoviy va fizik–kimyoviy
usullar bilan tahlillar o‘tkazildi.
44](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_44.png)
![XULOSA
1. “Sho‘rsu” dolomitini xlorid kislotada parchalab olingan kalsiy, magniy
xlorid eritmasidan, magniy xloridni ajratishning maqbul usuli ishlab chiqildi.
2. MgCl
2 ·6H
2 O – N H
2 C
2 H
4 OH – H
2 O sistemaning eruvchanligi kuzatuv -
politermik usulda - 52,0 dan -4,0° C gacha harorat oralig‘ida o‘rganildi. Olti suvli
magniy xlorid – monoetanolamin - suv uchlik sistemasining eruvchanligi yettita
ichki kesmalar yordamida o‘rganildi. Sistemaning fazaviy diagrammasida
muzning, MgCl
2 · 12 H
2 O , MgCl
2 ·6H
2 O , N H
2 C
2 H
4 OH · 2 H
2 O , N H
2 C
2 H
4 OH va
Mg OHC l ·C
2 H
4 NH
2 Cl tarkibli yangi birikmaning kristallanish maydonlari
chegaralari aniqlandi.
3. MgCl
2 ·6H
2 O – [ 25% NH
3 +
75% H
2 O] - H
2 O sistemasi -36,0 dan 40,0 o
C
harorat oralig‘ida yettita ichki kesmalar o‘tkazib diagrammasi qurildi. Politermik
eruvchanlik diagrammada muzning, magniy xloridning o‘nikki suvli, kalsiy
xloridning olti suvli va magniygidrooksoxlorid ammoniy xlorid tuzining
kristallanish maydonlari chegaralari aniqlandi.
4.O‘rganilgan eruvchanlik sistemalarining diagrammalarida hosil bo‘lgan
fazalarning tarkibi kimyoviy va fizik-kimyoviy tahlil usullari yordamida aniqlandi.
5. Magniy tuzini eritmadan ajratib olishda 21,92% CaCl
2 va 15,49% MgCl
2
eritmasiga turli nisbatda monoetanolamin qo‘shib borish tartibida massa nisbati
100 10 nisbat maqbul sifatida aniqlandi.˸
6. MgCl
2 eritmasiga
turli nisbatda [NH
2 C
2 H
4 OH+NH
3 ]qo‘shib borish tartibida
umumiy eritma massasi [0,1 mol NH
2 C
2 H
4 OH + 0,9 mol NH
3 ], 152,4 gr cho‘kma
tushishi, eritmadagi CaCl
2 27,79 % miqdorni va eritma pH-6,86 bo‘lishi aniqlandi.
45](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_45.png)
![ADABIYOTLAR RO‘YHATI
1.Paffengolsa K . N . i dr . Geologicheskiy slovar: v 2 - x tomax . Pod redaksiey,
M . :1978 . Nedra .
2.Pettidjon F . Dj . Karbonatn ы e porod ы , per . s angl ., t . 1 - 2 , M ., 1970 - 71 ;
Osadochn ы e porod ы , per . s angl ., M ., 1981 .
3.Kozlovskogo Ye . A . Gornaya ensiklopediya . Sovetskaya ensiklopediya .
Pod redaksiey. M . : 1984-1991 .
4. Determination of Calcium and Magnesium in limestones and Dolomites
Application of the Ethylenediaminetetraacetic Acid Method. JOHN J.
BANEWICZ AND CHARLES T. KENNER. Department of Chemistry,
Southern Methodist University, Dallas, Tex.
5. (PATENT) Sposob pererabotki dolomita. Lokshin E.P. , Makarov
V.N. , Kalinnikov V.T. , Kremeneskaya I.P., podacha zayavki:1996-12-03 ,
publikatsiya patenta: 20.02.1998
6.Universum: Texnicheskie nauki : elektron. nauchn. jurn. Ergashev D.A. [i dr.].
2019. № 11(68). URL: http://7universum.com/ru/tech/archive/item/8219
7.Issledovanie vliyaniya temperatur ы i prodoljitelnosti protsessa na razlojenie
dolomitov Dexkanabadskogo mestorojdeniya . Mixliev O.A. [i dr.]. 2019. №
1(58). URL: http://7universum.com/ru/tech/archive/item/6855
8.Universum: Texnicheskie nauki : elektron. nauchn. jurn. Mixliev O.A. [i dr.].
2019. № 1(58). URL: http://7universum.com/ru/tech/archive/item/6855
9. Petrov Vladimir Ernestovich, Konovalov Sergey Anatolevich, Zayavka:
2016123009, 09.06.2016, 196006, Sankt-Peterburg, a/ya 70, Petrovu V.E.
10. Poluchenie magnezii iz poluobojjennogo dolomita. B.A.Dmitrevskiy, N. N.
Treuщenko, S. K. svetkov. Tekst nauchnoy stati po spesialnosti « Ximicheskie
nauki »
11.( Patent) Sposob polucheniya oksida kalsiya . Izobretatel: Polyakov L.A.,
Tatarinov A.N., Monastыrev Yu.A., Izovskaya L.N., Kiseleva T.G.,
46](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_46.png)




![53.Xamrakulov Z.A., Askarova M.K., Tuxtaev S. Poluchenie rastvora xloridov
kalsiya i magniya iz dolomita // Ximicheskaya promыshlennost. - Sankt-
Peterburg, - 2013. - T. 90, - №2. – S. 70-78.
54.Ergashev Dilmurod, Mamura Askarova, Saydiahral Tukhtaev. Investigation of
the mitual interactions of the components of system substantiatiang the
process of obtaining a new defoliant // Austrian Journal of Technical and
Natural Sciences Austria, Vienna, - 2016. March-April - № 3-4. - P. 135-141.
55.Ergashev D., Askarova M., Tuxtaev S. Physico-chemical studies of novel
chlorate containing defoliant // Austrian Journal of Technical and Natural
Sciences Austria, Vienna, - 2016. May-June. - №5-6. - P. 58-63.
56.Ergashev D.A., Askarov a M.K., Tuxtaev S. Vzaimodeystvie komponentov v
vodnoy sisteme s uchastiem xloratov i xloridov kalsiya, magniya i 2-xloretil
fosfonat bis monoetanolammoniya // Universum: Ximiya i biologiya:
elektron. nauchn. jurn. - 2016. - №8. (26). URL:
57.Ergashev D.A. Izuchenie reologicheskix svoystv rastvorov v sisteme
{[20,26%Ca(ClO
3 )
2 +15,76%Mg(ClO
3 )
2 +3,9%CaCl
2 +2,81%MgCl
2 +47,27%H
2
O]+10%CO(NH
2 )
2 }+C
2 H
5 OH // Universum: Texnicheskie nauk: elektron.
nauchn. jurn. 2016. №6 (27). URL:
58.Adilov Z.X., Askarova M.K., Ishanxodjaev S.S., Tuxtaev S. Rastvorimost v
sisteme NaClO
3 ·3CO(NH
2 )
2 –C
10 H
11 ClN
4 –H
2 O.// Ximicheskiy Jurnal
Kazaxstana. -Almatы, -2008. - № 3. –S. 200-202.
59.Adilov Z.X. Rastvorimost v sisteme CO(NH
2 )
2 – C
10 H
11 ClN
4 – H
2 O.//
Uzbekskiy ximicheskiy jurnal. –Tashkent-2008. - № 3. –S. 25-28.
60.Tog‘asharov A.S., Ishanxodjaev S.S., Narxodjaev A.X., Tuxtaev S. Politerma
rastvorimosti sistemы NaClO
3 ·3CO(NH
2 )
2 -CH
3 COOH·H
2 NC
2 H
4 OH-H
2 O.//
Uzb. xim. jurn. Tashkent-2010. - № 1.- S. 17-22.
61.Shukurov J.S., Ishanxodjaev S.S., Askarova M.K., Tuxtaev S. Izuchenie
rastvorimosti komponentov v sisteme NaClO
3 ·2CO(NH
2 )
2 -
NH
2 C
2 H
4 OH·CH
3 COOH- H
2 O.// Jurnal neorganicheskoy ximii. -Moskva,
2011. –T.56. -№3. -S. 502–505
51](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_51.png)
![62. Shukurov J.S. Rastvorimost komponentov v sisteme NH
2 C
2 H
4 OH·CH
3 COOH
– C10H
11 ClN
4 - H
2 O.// Uzb. xim. jurn. –Tashkent, 2010g. -№ 3. -S. 37-40.
63.Toghasharov A.S., Tukhtaev S. Study of the Solubility of Components in the
System Ca(ClO
3 )
2 -2NH
2 C
2 H
4 OH·H
3 S
6 N
5 O
7 -N
2 O.// Austrian Journal of
Technical and Natural Sciences. Vienna, 2015 May-June. -R 144-148
64.Tog‘asharov A.S. Politerma rastvorimosti sistemы Ca(ClO
3 )
2 -
2NH
2 C
2 H
4 OH
·H
3 S
6 N
5 O
7 -N
2 O.// Perspektivы razvitiya nauchnыx
issledovannыy v 21 veke sbornik materialov VIII Mejdunarodnaya nauchno-
prakticheskaya konferensiya g. Maxachkala 28 iyunya 2015 g. S. 18-19.
65. Turaev K.A., Ikramov M.X., Shukurov J.S., Togasharov A.S. Politerma
rastvorimosti v sisteme Sa(ClO
3 )
2 ·4CO(NH
2 )
2 – CH
2 ClCOONa – N
2 O.//
Uzbekskiy ximicheskiy jurnal, 2022, №2, S.15-21
66.Turaev K.A., Raxmonov O.O., Togasharov A.S., Tuxtaev S. Politerma
rastvorimosti sistemы tetrakarbamidoxlorata kalsiya – monoxlorata
monoetanolamina – vodы.// Universum: texnicheskie nauki: elektron. nauchn.
jurn. 2021. №10. -S. 91. URL:
https://7universum.com/ru/tech/archive/item/12462
67. Turaev K.A., Togasharov A.S., Tuxtaev S. Politerma rastvorimosti v sisteme
xlorat kalsiya – monoetanolamin monoxlorasetat–voda.// Uzbekskiy
ximicheskiy jurnal, 2021, №3. S. 18-23.
68.Turayev K.A., Togasharov A.S., Tukhtaev S. An effective defoliant based on
calcium chlorate and sodium salt of monochloroacetic acid. Journal of
Chemical Technology and Metallurgy, 2022, № 5,-R. 57.
69. Akhmedov B. B., Shukurov J. S.. Polythermic solubility of the system
HOOC-COOH ·NH
2 C
2 H
4 OH - [10% C
10 H
11 ClN
4 + 90% C
2 H
5 OH] – H
2 O.//
O‘zbekiston kimyo jurnali, 2022, №5. –R. 3-7.
70.Xusanov E.S., Shukurov J.S., Xamidov O.J., Togasharov A.S. Rastvorimost
komponentov v sisteme asetat karbamid–monoetanolamin-voda.// Uzbekskiy
ximicheskiy jurnal, 2022, №4, -S. 20-26.
52](/data/documents/99f3a403-2819-4768-bda1-aa81afc607e7/page_52.png)

MAGNIY XLORID, AMMIAK, MONOETANOLAMIN, SUVDAN IBORAT POLITERMIK ERUVCHANLIK SISTEMALARINI O ‘ RGANISH VA FAZALARNING TARKIBINI TAXLIL QILISH MUNDARIJA KIRISH . ........ ………………………………………………………….. ... 3 I -BOB. ADABIYOTLAR SHARHI ……………………………………… 8 § 1 .1 Dolomit rudasi xususiyatlari va undan kalsiy va magniylarni o‘zaro ajratib olish usullari ..... ....................................................... 8 § 1 .2 Kalsiy va magniy tuzlari asosida defoliantlar olish usullari va texnologiyasi ……………………………………………………. . 1 3 § 1 .3 Kuzatuv politermik usulda o‘rganilgan eruvchanlik diagrammalari tahlili............... ................... ............... ..................... 18 § 1 . 4 Xulosa va adabiyotlar tahlili ……… ....... ……… …… …………. . 21 II BOB . TADQIQOT O‘TKAZISh USULLARI ……………… .. …….. ... 22 § 2.1. Tadqiqot ob’ektlarining xususiyatlari .. …………… ...... ........... .... 22 § 2. 2 Kimyoviy va fizik-kimyoviy tahlil usullari....................... ........ ... .. 23 § 2. 3 Ikkinchi bob bo‘yicha xulosa … ... .…………………… .. ……. ….. 25 III BOB . DOLOMITNI PARChALAB KALSIY VA MAGNIY TUZLARINI 26 1
AJRATISh ............................. ................................................ § 3. 1 Dolomitni xlorid kislota bilan parchalash, hosil bo‘lgan eritmadan kalsiy va magniy xloridlarni ajratish …………………. 26 § 3 .2 MgCl 2 ·6H 2 O – NH 2 C 2 H 4 OH – H 2 O eruvchanlik sistemasini o‘rganish ……………………………………………………… … 28 § 3 .3 Mg Cl 2 ·6H 2 O – [ 25% NH 3 + 75% H 2 O] - H 2 O politermik eruvchanlik sistemasi ……………………………………………. 33 § 3 .4 Magniy tuzini kalsiy va magniy tuzlari eritmasidan ajratib olishda monoetanolaminning ta’sirini o‘rganish …………………………. 36 § 3. 5 Uchinchi bob b o‘ yicha xulosa ………………………………... . 44 XULOSA ……………………………………………………………. ........ . 45 FOYDALANILGAN ADABIYoTLAR …………………… .......... .......... 46 KIRISh Dissertatsiya mavzusining dolzarbligi. Hozirgi kunda kalsiy va magniy tuzlariga bo‘lgan talab yuqori bo‘lib, kimyo sanoati, qishloq xo‘jaligi, va farmasevtika sohalarida keng miqyosda ishlatiladi. Kalsiy va magniy saqlagan xomashyolarni qayta ishlab respublikamiz uchun kerakli bo‘lgan preparatlarni ishlab chiqarish muhim ahamiyat kasb etadi. Olimlar tomonidan mahalliy xomashyolar dolomit, fosforit, silvinit, oxaktosh va boshqalar asosida preparatlarni olish va ishlab chiqarish bo‘yicha ilmiy tadqiqotlar olib borilgan. Bu borada, dolomit mineralini kislotalar yordamida parchalab, uning asosida kalsiy xlorid va magniy sulfat preparatlari ishlab 2
chiqilgan. Dolomit tarkibidagi kalsiy va magniy tuzlarini ajratish va ular asosida yangi preparat turlarini olinish texnologiyasini ishlab chiqish, ularni faolligini aniqlash kimyogarlar oldida turgan dolzarb masalalardan hisoblanadi. Respublikamizda mahalliy xom ashyolarni qayta ishlab defoliantlar, o‘g‘itlar, fiziologik faol moddalar va boshqa turdagi kimyoviy preparatlarni olish va qishloq xo‘jaligini ushbu preparatlar bilan ta’minlash borasida muayyan natijalarga erishilgan. Jumladan, natriy, kalsiy va magniy xloratlar asosida O‘zDef, Sixat, Sadaf, Morel, Super XMD, PoliDef, suyuq o‘g‘itlarning preparatlarini alohida ta’kidlash mumkin. O‘zbekiston Respublikasining “ 2022 - 2026 yillarga mo‘ljallangan yangi O‘zbekistonning taraqqiyot strategiyasi to‘g‘risida ”gi PF-60- sonli farmonida “ Milliy iqtisodiyot barqarorligini ta’minlash va yalpi ichki mahsulotda sanoat ulushini oshirishga qaratilgan...” muhim vazifalar belgilangan . Bu borada, mahalliy dolomit mineralini parchalab, kalsiy va magniy tuzlarini ajratish, komponentlarning o‘zaro ta’sirlashish bo‘yicha eruvchanlik sistemalarini o‘rganish, diagrammaning hosil bo‘lgan fazalarini kimyoviy va fizik- kimyoviy usullarda aniqlash va olib borilgan tadqiqotlar natijasida kalsiy xlorat sintez qilishni yangi uslubini taklif etish muhim ahamiyat kasb etadi. O‘zbekiston Respublikasi Prezidentining 2022 yil 28-yanvardagi PF-60- sonli “ 2022 - 2026 yillarga mo‘ljallangan yangi o‘zbekistonning taraqqiyot strategiyasi to‘g‘risida ”gi farmonida “ Milliy iqtisodiyot barqarorligini ta’minlash va yalpi ichki mahsulotda sanoat ulushini oshirishga qaratilgan sanoat siyosatini davom ettirib, sanoat mahsulotlarini ishlab chiqarish hajmini oshirish” va 2021 yil 13 fevraldagi PQ-4992-sonli “ Kimyo sanoati korxonalarini yanada isloh qilish va moliyaviy sog‘lomlashtirish, yuqori qo‘shilgan qiymatli kimyoviy mahsulotlar ishlab chiqarishni rivojlantirish chora- tadbirlari to‘g‘risida ”gi qarori hamda, mazkur faoliyatga tegishli boshqa me’yoriy- xuquqiy xujjatlarda belgilangan vazifalarni amalga oshirishga ushbu dissertatsiya tadqiqoti muayyan darajada xizmat qiladi. Tadqiqotning respublika fan va texnologiyalari rivojlanishi-ning asosiy ustuvor yo‘nalishlariga bog‘liqligi. Mazkur tadqiqot respublika fan va 3
texnologiyalar rivojlanishining VII. «Kimyo texnologiyalari va nanotexnologiyalar» ustuvor yo‘nalishiga muvofiq holda bajarilgan. Muammoning o‘rganilganlik darajasi. Adabiyotlarda organik va noorganik moddalar asosida preparatlar olish bo‘yicha ishlar keng yoritilgan. O‘zbekistonda Nabiev M.N. rahbarligida noorganik moddalar texnologiyasi ixtisosligi bo‘yicha ilmiy maktab yaratilib, S.Tuxtaev, M.K. Askarova, B.M. Beglov, B.S. Zakirov, Sh.S. Namazov, X. Kucharov, Z.Isabaev, S.M. Tajiev va boshqa namoyandalari kimyo-texnologiya fanining rivojiga o‘zlarining o‘lkan hissalarini qo‘shgan. A.I. Imamaliev, T.S. Zakirov, N.N. Melnikov, A.M. Prugalov, L.D. Stonov, R.S. Nazarov, Sh.J. Teshaev, F.J. Teshaev kabi yetakchi olimlar g‘o‘za defoliatsiyasi samaradorligiga turli tashqi omillar va agrotexnik tadbirlarning ta’sirini o‘rgangan va ular hozirgi vaqtga kelib soha rivojining asosi bo‘lib xizmat qilmoqda. Dunyoda Jayms Kost, Loston Rove , J. Dan Smit , Ch.S. Vulyams, J.K. Suttle, F.R.H. Katterman, V.K. Hall, L.K. Brown, K.L. Rhyne, Yo Gan kabi olimlar organik moddalar asosida preparatlar olish va ishlab chiqarish texnologiyalarini yaratish bo‘yicha qator ilmiy izlanishlar olib borgan. Adabiyotlarda dolomit mineralini sulfat kislotada parchalab, gips va magniy sulfat olish (Dmitrevskiy B.A.); xlorid kislotada parchalab, olingan kalsiy, magniy xloridlarni natriy xlorat bilan konversiya qilib “Fandef” defoliantini olish (Xamraqulov Z.A.), hamda sulfat va xlorid kislota asosida kalsiy sulfat va magniy xlorid olish bo‘yicha (Dadaxodjaev A.T.) olimlar tomonidan ilmiy tadqiqotlar olib borilgan. Olimlar tomonidan dolomit mineralini parchalab, kalsiy, magniy xloridlarni olish va ularni ajratib undan olingan kalsiy xloridni natriy xlorat bilan konversiya qilib, kalsiy xlorat sintez qilish, hamda kalsiy xlorati, oziqlantiruvchi, fiziologik faol va insektitsidlar asosida yangi defoliantlar olish texnologiyasini yaratish bo‘yicha hozirga qadar ilmiy tadqiqotlar olib borilmagan. Ushbu dissertatsiya ishi kalsiy xlorat asosida kompleks defoliant turini mahalliy xomashyo dolomitdan olishga va ularni paxtachilikda qo‘llab, hosildorlikni oshiruvchi preparatlarni yaratishga imkon beradi. 4
Dissertatsiya mavzusining dissertatsiya bajarilayotgan ilmiy tadqiqot muassasasining ilmiy tadqiqot ishlari bilan bog‘liqligi. Dissertatsiya ishi Umumiy va noorganik kimyo institutining ilmiy-tadqiqot ishlari rejasining PZ- 20170926386 “Mahalliy xom ashyo asosida kompleks ta’sir etuvchi, samaradorli defoliant sintezi va olinish texnologiyasini ilmiy asoslarini ishlab chiqish” mavzudagi loyiha doirasida bajarilgan. Tadqiqotning maqsadi magniy xlorid, ammiak, monoetanolamin sistemalarini o‘rganish, fazalar tarkibini taxlil qilish va kalsiy, magniy tuzlaridan magniy tuzini ajratishdan iborat. Tadqiqotning vazifalari : “Sho‘rsu” dolomitini xlorid kislotada parchalab olingan kalsiy, magniy xlorid eritmasidan, magniy xloridni ajratish usulini ishlab chiqish; Mg Cl 2 ·2H 2 O – NH 2 C 2 H 4 OH – H 2 O eruvchanlik sistemasini o‘rganish va taxlil qilish; Mg Cl 2 ·2H 2 O – [ 25% NH 3 + 75% H 2 O] - H 2 O politermik eruvchanlik sistemasini keng harorat va konsentratsiya oralig‘ida o‘rganish; Eruvchanlik diagrammalarida hosil bo‘lgan fazalarning tarkibini kimyoviy va fizik-kimyoviy tahlil usullari yordamida aniqlash; [21,92% CaCl 2 + 15,49% MgCl 2 ] eritmasini monoetanolamin bilan ta’sirlashuvini, tushadigan cho‘kmaning miqdoriga, eritmaning tarkibiga va pH muhitiga bog‘lab o‘rganish; kalsiy, magniy xlorid eritmasidan, magniy xloridni ajratib olishda, monoetanolaminni ammiak bilan aralashma miqdorini magniy tuzini mol miqdoriga bog‘lab o‘rganish. Tadqiqotning ob’ekti kalsiy xlorid, monoetanolamin, ammiakli suv, xlorid kislota. Tadqiqotning predmeti respublikamizda mavjud bo‘lgan dolomit mineralini kislotada parchalash, kalsiy va magniy tuzlarini ajratishdan iborat. Tadqiqotning usullari. Dissertatsiyada vizual-politermik, piknometrli, analitik, termik va rentgenfazali tahlil usullaridan foydalanilgan. Vizkozimetr VPJ 5
